- Получение этилена и исследование его свойств
- Просмотр содержимого документа «Получение этилена и исследование его свойств»
- Лабораторная работа получение этилена лабораторным способом
- Практическая работа № 2 Получение этилена и изучение его свойств.
- Дистанционное обучение как современный формат преподавания
- Современные педтехнологии в деятельности учителя
- Методическая работа в онлайн-образовании
- Оставьте свой комментарий
- Безлимитный доступ к занятиям с онлайн-репетиторами
- Подарочные сертификаты
Получение этилена и исследование его свойств

Данная практическая работа может использоваться как теоретический материал при подготовке к практической работе на уроке. Учащиеся дома повторяют правила техники безопасности, изучают цель работы, какое оборудование и реактивы необходимы в ходе работы, а так же какие наблюдения и выводы нужно будет записать при оформлении отчета.
Просмотр содержимого документа
«Получение этилена и исследование его свойств»
Общие положения техники безопасности на уроках химии
Химия – предмет, который предполагает изучение и работу с химическими веществами.
Во время урока, при работе учащихся могут иметь место вредные и опасные факторы:
отравление химическими веществами;
получение химических ожогов агрессивными веществами;
травмирования осколками стекла;
травмирования в результате взрыва или самовозгорания химических веществ, при нарушении условий их хранения.
Поэтому на уроках химии учащимся, прежде всего, нужно усвоить «химическую практику» и правила безопасного обращения с химическими веществами.
Это означает, что:
учащиеся обязаны знать свойства веществ, с которыми они работают и безопасные приемы обращения с ними;
выполнять требования безопасности при обращении со стеклянной посудой и ампулами;
знать правила обезвреживания и уничтожения вредных веществ;
выполнять только порученную учителем работу;
выполнять правила эксплуатации используемого оборудования;
соблюдать правила личной гигиены;
содержать рабочее место в чистоте;
правильно применять средства индивидуальной и коллективной защиты;
знать и соблюдать требования пожарной безопасности и уметь пользоваться средствами пожаротушения;
немедленно извещать учителя о любой ситуации, угрожающей здоровью и жизни людей (учеников), об инциденте или ухудшении состояния своего здоровья;
уметь оказывать первую (доврачебную) помощь при несчастных случаях (отравлении, термическом и химическом ожогах).
В кабинете химии должны быть в наличии:
аптечка, содержащая медикаменты для оказания первой медицинской помощи;
раствор для нейтрализации токсичных веществ, применяемых в работе;
средства индивидуальной защиты;
средства пожаротушения (огнетушитель, ящик с песком). Тара, в которой хранятся химические вещества должна иметь четкие надписи.
В кабинете химии ЗАПРЕЩАЕТСЯ:
выполнение работ, не связанных с заданием или во внеурочное время;
хранение химических веществ в таре, не имеющей надписи;
совместное хранение в непосредственной близости друг к другу веществ, которые могут вызвать в результате химического взаимодействия пожар или взрыв;
хранение химических веществ в количествах, превышающих суточную норму;
применение химической посуды для личного пользования;
бегать и прыгать;
Практическая работа № 2
Получение этилена и изучение его свойств.
Цель: научиться получать в лаборатории этилен; изучить физические и химические свойства этилена.
Оборудование: пробирки, пробка с газоотводной трубкой, штатив, спиртовая горелка, спички.
С правилами техники безопасности ознакомлен(а) и обязуюсь их выполнять.
Описание опыта, рисунок
Наблюдения и уравнения реакций
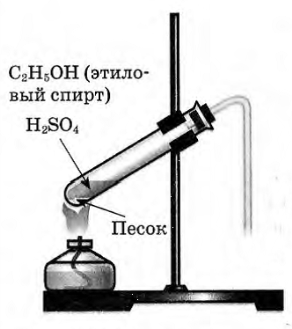
В пробирку налили 1 мл этилового спирта и осторожно добавьте 6—9 мл концентрированной серной кислоты. Затем всыпали немного прокаленного песка (чтобы предотвратить толчки жидкости при кипении). Закрыли пробирку пробкой с газоотводной трубкой, закрепили ее в штативе и осторожно нагрели содержимое пробирки.
В пробирке начинается выделяться газ — этилен.
С2H5OH 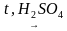
В ходе реакции концентрированная серная кислота забирает воду из спирта, врезультате образуется этилен.
Такую реакцию называют – реакция дегидратации.
Изучение свойств этилена.
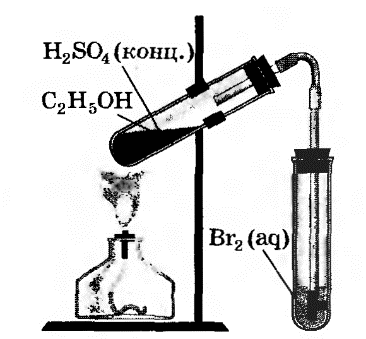
В другую пробирку налили 2-3 мл бромной воды. Опустили газоотводную трубку первой пробирки до дна пробирки с бромной водой и пропускали через неё выдедяющийся газ.
При пропускании газа через бромную воду, происходит обесцвечивание бромной воды.
В ходе реакции происходит окисление этилена бромной водой по двойной связи.
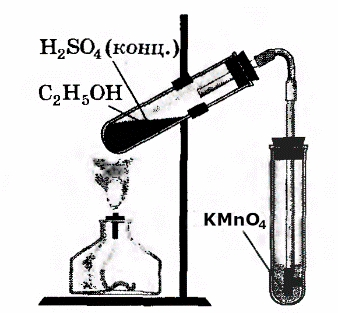
В третью пробирку налили 2-3 мл разбавленного раствора KMnO4, поодкисленного серной кислотой, и пропустили через него газ.
При пропускании газа через подкисленный раствор KMnO4, происходит обесцвечивание раствора KMnO4.
В ходе реакции происходит окисление этилена подкисленным раствором перманганата калия.
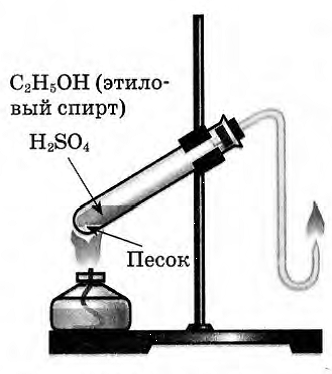
Выделяющиеся газ первой пробирки подожгли.
Этилен на воздухе горит ярким светящимся пламенем.
Этилен горит ярким светящимся пламенем, что доказывает наличие кратных связей.
Общий вывод: на данной практической работе мы научились получать в лаборатории этилен реакцией дегидратации спиртов; изучили химические свойства этилена, а именно, действие этилена на бромную воду и подкисленный раствор перманганата калия.
Какой из гомологов этена имеет плотность по воздуху 1,45?
Ответ: D(возд.) = Mr (алкена)/Mr (воздуха);
Mr (алкена) = D(возд.)* Mr (воздуха);
Mr (алкена) = 1,45*29 = 42.
Какой из гомологов пропена имеет плотность по водороду 14?
Ответ: D(Н2) = Mr (алкена)/Mr (Н2);
Источник
Лабораторная работа получение этилена лабораторным способом

Ответы и вывод полученный в результате лабораторной работы

Научиться получать этилен в лаборатории путём нагревания смеси этилового спирта с концентрированной серной кислотой и проводить качественные реакции на непредельные углеводороды этиленового ряда, изучить свойства этилена.
Реактивы и оборудование:
Прибор для получения газов, водный раствор перманганата калия, раствор брома в воде (бромная вода), реакционная смесь этилового спирта и серной концентрированной кислоты (1:3), спиртовка, спички.
1. Получение этилена дегидратацией этилового спирта.
Получите готовую реакционную смесь у учителя. Соберите прибор для получения газов.
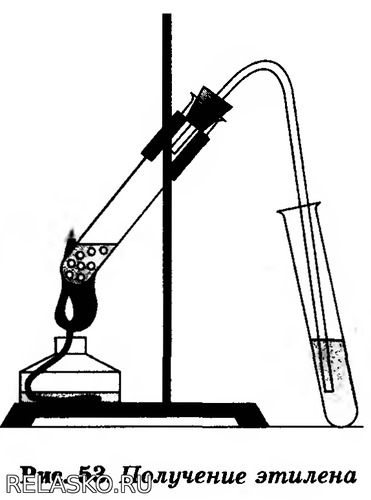
В пробирку налейте 2-3 мл этилового спирта и осторожно добавьте 6-9 мл концентрированной серной кислоты. Затем всыпьте немного прокаленного песка (песок или мелкие кусочки пемзы вводят для того, чтобы предотвратить толчки жидкости при кипении). Закройте пробирку пробкой с газоотводной трубкой, закрепите ее в штативе и осторожно нагрейте содержимое пробирки (рис.53). Что вы наблюдаете?
Осторожно, равномерно нагрейте смесь.
Соблюдайте осторожность. Вы работаете с концентрированной серной кислотой.
2. Окисление этилена кислородом перманганата калия
В другую пробирку налейте 2-3 мл разбавленного раствора перманганата калия, и пропустите через него газ. Что при этом наблюдаете?
3. Взаимодействие этилена с бромной водой.
В третью пробирку налейте 2-3 мл бромной воды, опустите газоотводную трубку до дна этой пробирки и пропустите через бромную воду выделяющийся газ. Что вы наблюдаете?
4. Окисление этилена кислородом воздуха (горение) Вынув газоотводную трубку из раствора и повернув ее отверстием кверху, подожгите выделяющийся газ. Каким пламенем горит этилен? Почему?
5. Оформите работу в тетради в виде таблицы:
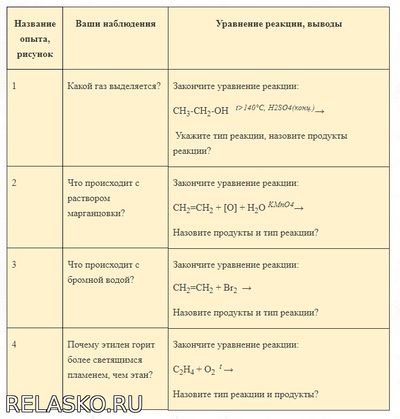
Вывод:
При взаимодействии этилена с бромной водой, красно-бурый раствор бромной воды обесцвечивается. Эта реакция является качественной на двойную связь.
При окислении этилена водным раствором перманганата калия образуется этиленгликоль. Заметно, что фиолетовая окраска раствора исчезает. Реакция является качественной на двойную связь.
В отличие от метана этилен горит светящимся пламенем, что обусловливается повышенным содержанием углерода

Видеоурок. Получение и изучение свойств этилена. Опыт
Получение этилена и его горение
 |  |
| pvqvau7ge | Дата: Среда, 21.08.2019, 21:43 | Сообщение # 2 |
| | Формула этилена 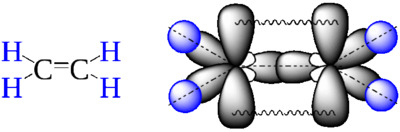 Этилен, или этен, имеет структурную формулу C2H4 и является простейшим представителем непредельных этиленовых углеводородов: Атомы углерода в данном соединении находятся в состоянии sp2-гибридизации. Следовательно, каждый углеродный атом образует две ковалентные сигма-связи с атомами водорода и одну — с соседним атомом C. Благодаря одной негибридизованной орбитали между атомами C образуется пи-связь. Оси трех гибридных орбиталей, а также центры шести атомов в молекуле этена находятся в плоскости, перпендикулярной плоскости пи-связи. Валентный угол в молекуле C2H4 равен 120 градусам. Молекула этилена является плоской. Строение молекулы этилена Важно! В молекуле этилена невозможно свободное вращение sp2-гибридизованных углеродных атомов друг относительно друга без разрыва пи-связи. В обычных условиях данное органическое вещество является газом без цвета и запаха. А теперь можем перейти к главной теме — химическим свойствам этилена. Если для предельных органических соединений характерны реакции замещения, то для алкенов, в частности этилена, типичны реакции присоединения: Источник Практическая работа № 2 Получение этилена и изучение его свойств. Нечаев Дмитрий Валерьевич, учитель химии ГУ ЛНР «ЛУВК « ИНТЕЛЛЕКТ» Практическая работа № 2 Получение этилена и изучение его свойств. Цель: научиться получать в лаборатории этилен; изучить физические и химические свойства этилена. Оборудование: пробирки, пробка с газоотводной трубкой, штатив, спиртовая горелка, спички. С правилами техники безопасности ознакомлен(а) и обязуюсь их выполнять. В пробирку налили 1 мл этилового спирта и осторожно добавьте 6—9 мл концентрированной серной кислоты. Затем всыпали немного прокаленного песка (чтобы предотвратить толчки жидкости при кипении). Закрыли пробирку пробкой с газоотводной трубкой, закрепили ее в штативе и осторожно нагрели содержимое пробирки. В пробирке начинается выделяться газ — этилен. В ходе реакции концентрированная серная кислота забирает воду из спирта, врезультате образуется этилен. Такую реакцию называют – реакция дегидратации. Изучение свойств этилена. В другую пробирку налили 2-3 мл бромной воды. Опустили газоотводную трубку первой пробирки до дна пробирки с бромной водой и пропускали через неё выдедяющийся газ. При пропускании газа через бромную воду, происходит обесцвечивание бромной воды. В ходе реакции происходит окисление этилена бромной водой по двойной связи. В третью пробирку налили 2-3 мл разбавленного раствора KMnO 4 , поодкисленного серной кислотой, и пропустили через него газ. При пропускании газа через подкисленный раствор KMnO4 , происходит обесцвечивание раствора KMnO 4 . В ходе реакции происходит окисление этилена подкисленным раствором перманганата калия. Выделяющиеся газ первой пробирки подожгли. Этилен на воздухе горит ярким светящимся пламенем. Этилен горит ярким светящимся пламенем, что доказывает наличие кратных связей. Общий вывод: на данной практической работе мы научились получать в лаборатории этилен реакцией дегидратации спиртов; изучили химические свойства этилена, а именно, действие этилена на бромную воду и подкисленный раствор перманганата калия. Какой из гомологов этена имеет плотность по воздуху 1,45? Ответ: D (возд.) = Mr ( алкена)/Mr (воздуха); Mr ( алкена) = D (возд.)* Mr (воздуха); Mr ( алкена) = 1,45*29 = 42. Какой из гомологов пропена имеет плотность по водороду 14? Ответ: D (Н2) = Mr ( алкена)/Mr (Н 2 ); Mr ( алкена) = 14*2 = 28. Курс повышения квалификации Дистанционное обучение как современный формат преподавания
Курс повышения квалификации Современные педтехнологии в деятельности учителя
Курс профессиональной переподготовки Методическая работа в онлайн-образовании
Ищем педагогов в команду «Инфоурок» Номер материала: ДБ-1175165 Международная дистанционная олимпиада Осень 2021 Не нашли то что искали? Вам будут интересны эти курсы: Оставьте свой комментарийАвторизуйтесь, чтобы задавать вопросы. Безлимитный доступ к занятиям с онлайн-репетиторамиВыгоднее, чем оплачивать каждое занятие отдельно Попова предложила изменить школьную программу по биологии Время чтения: 1 минута ЕСПЧ запретил учителям оскорблять учеников Время чтения: 3 минуты Минпросвещения будет стремиться к унификации школьных учебников в России Время чтения: 1 минута Рособрнадзор откажется от ОС Windows при проведении ЕГЭ до конца 2024 года Время чтения: 1 минута В Тюменской области продлили на неделю дистанционный режим для школьников Время чтения: 1 минута Минпросвещения разрабатывает образовательный минимум для подготовки педагогов Время чтения: 2 минуты Подарочные сертификатыОтветственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи. Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов. Источник |