КОВАЛЕНТНАЯ МОДИФИКАЦИЯ ФЕРМЕНТОВ И ЕЕ ТИПЫ
Ковалентная модификация ферментов – тип регуляции ферментативной активности под действием других ферментов, осуществляющийся за счет присоединения к белковой молекуле небольших химических групп, что вызывает конформационные изменения в молекуле белка, приводящие к изменению определенной геометрии каталитического центра. Является быстрым механизмом регуляции активности ферментов внешними сигналами. Ковалентная модификация является основным механизмом при рецептор-зависимом ответе клеток на внешние воздействия, тогда как аллостерические эффекторы изменяют активность ферментов в ответ на изменение внутриклеточных условий.
Фосфорилирование – наиболее распространенный тип ковалентной модификации, является АТФ-зависимым процессом и осуществляется с помощью ферментов протеинкиназ. В большинстве случаев фосфорилированная форма фермента более активна, чем нефосфорилированная. Фосфорилирование модифицирует белки добавлением отрицательно заряженных остатков фосфорной кислоты к гидроксильным группам остатков серина, треонина и, реже, тирозина.
Рис. 4.3.1. Фосфорилирование/дефосфорилирование.
Возвращение фермента в исходное состояние осуществляется ферментами протеинфосфатазами, которые отщепляют неорганический фосфат от молекулы белка.
В некоторых случаях фосфорилирующие и дефосфорилирующие белки сами являются модифицируемыми ферментами. Активность протеинкиназ и протеинфосфатаз находится под гормональным контролем и регулируется нервной системой.
К ковалентной модификации ферментов помимо фосфорилирования относятся также аденилирование, уридилирование, ацетилирование, АДФ-рибозилирование.
Ковалентную модификацию аденилированием и уридилированием можно рассмотреть на примере регуляции активности фермента глутаминсинтетазы. Глутаминсинтетаза выполняет одну из ключевых функций в обмене азота у бактерий E. Coli. При выращивании Е. coli на среде, в которой источником азота служит не NH4 + , а другие соединения, в клетках наблюдается высокий уровень глутаминсинтетазной активности. Добавление в ростовую среду солей NH4 + вызывает быстрое (в течение минуты) десятикратное снижение активности фермента, которое нельзя объяснить подавлением его синтеза. Попытки объяснить данное явление привели к открытию фермента, катализирующего инактивацию глутаминсинтетазы in vitro в присутствии АТФ, Mg 2+ и глутамина. Далее было установлено, что разные формы фермента содержат различные количества ковалентно связанной АМФ. Далее было установлено, что инактивирующий белок является аденилилтрансферазой, катализирующей ковалентное присоединение АМФ к определенной тирозильной группе в каждой из 12 субъединиц глутаминсинтетазы. Однако полное превращение происходит только в экстремальных условиях, например когда клетки, выращенные в условиях недостатка NH4 + , попадают в среду, богатую этим соединением. Обычно глутаминсинтетаза находится в промежуточных состояниях аденилирования, в которых аденилированными являются лишь некоторые из 12 субъединиц.
Активность отдельной субъединицы в составе олигомера зависит от состояния соседних субъединиц (аденилированы они или не аденилированы), вероятно, из-за аллостерического влияния, которое передается через межсубъединичные контакты.
При переносе Е. coli из среды, богатой NH4 + , в бедную этим соединением среду происходит быстрая реактивация глутаминсинтетазы, что указывает на обратимость процесса аденилирования. Было установлено, что активность аденилилтрансферазой регулируется с помощью уридилирования и деуридилирования. Уридилирование происходит в результате катализируемого специфичной уридилилтрансферазой ковалентного присоединения УМФ к одному или двум тирозильмым остаткам каждой субъединицы аденилилтрансферазы. Деуридилирование катализируется уридилил-отщепляющим ферментом. Уридилирующий и деуридилирующий ферменты образованы одним полипептидом, который, подобно аденилилтрансферазе, проявляет бифункциональные свойства.
Примером ковалентной модификации белков с помощью ацетилирования является модификация гистонов. Ацетилирование гистонов играет важную роль в модуляции структуры хроматина при активации транскрипции, увеличивая доступность хроматина для транскрипционного аппарата. Гистоны целенаправленно модифицируются на тех промоторах, которые требуется активировать. Ацетилированию и деацетилированию подвергаются определенные остатки лизина, что осуществляется с помощью ферментов ацетилтрансфераз и деацетилаз. Предполагается, что ацетилированные гистоны менее прочно связаны с ДНК и поэтому ацетилирование может облегчать доступ и связывание факторов транскрипции с их элементами узнавания на ДНК. Ацетилирование остатков лизина в N-концевых «хвостиках» гистонов H2A, H2B, H3 и H4 нейтрализует их положительный заряд и соответственно блокирует ассоциацию с витками нуклеосомной ДНК. Это, в свою очередь, декомпактизует структуру как самой нуклеосомы, так и хроматина в целом и освобождает внешнюю поверхность витков ДНК для взаимодействий с регуляторными факторами.
Еще одним способом химической модификации ферментов с помощью присоединения небольших химических групп является АДФ-рибозилирование. АДФ-рибоза может вызывать неэнзиматическое АДФ-рибозилирование ряда белков. К ним относятсябелки регулирующие репарацию ДНК, белки-регуляторы трансляции и агрегации тромбоцитов. Моно-АДФ-рибозилирование – посттрансляционный процесс модификации белков, ответственный за токсический эффект некоторых бактериальных токсинов. Действие коклюшного или холерного токсинов вызывает моно-АДФ-рибозилирование белков плазматической мембраны и может изменять работу сигнальных систем или активность мембранного транспорта в результате нарушения функционирования G-белков. Схематически действие холерного токсина можно описать следующим образом (Рис. 4.3.2). В норме ГТФ, связанный с Gsα быстро гидролизуется (синяя стрелочка), так, что активация аденилатциклазы и увеличение цАМФ происходит столь долго, сколько гормон связан с рецептором. В присутствии холерного токсина Gsα необратимо модифицируется АДФ- рибозилированием, так, что она может связывать ГТФ, но не может его гидролизовать (красные стрелочки). В результате постоянной активации происходит нерегулируемый рост уровня цАМФ.
Рис. 4.3.2. Механизм действия холерного токсина
При нормальных условиях АДФ-рибозилированию могут подвергаться актин, десмин, интегрин-α-7.
Рис. 4.3.3. АДФ-рибоза
Аденилатциклаза
Аденилатциклаза (АТФ -пирофосфатлиаза циклизирующая) фермент, класса лиаз, катализирует гидролиз АТФ с образованием цАМФ и пирофосфата.
Рис. 4.3.4. структура цАМФ
Аденилатциклаза обнаружена практически во всех тканях животных, а также у бактерий. В клетках животных он локализован в плазматических мембранах, у бактерий – в мембранах и цитоплазме. Наиболее существенная роль цАМФ состоит в активации цАМФ – зависимых протеинкиназ (протеинкиназы А).
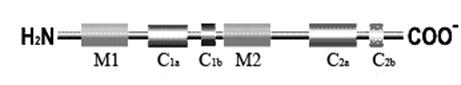
Рис. 4.3.5. Первичная структура аденилатциклазы
Рис. 4.3.6. Расположение аденилатциклазы в мембране
Фосфолипаза С
Фосфолипаза С является ключевым ферментом фосфоинозитидной мессенджерной системы. Многочисленные внеклеточные сигнальные молекулы (гормоны, нейромедиаторы, факторы роста, иммуноглобулины, антигены и др.), при взаимодействии со своими рецепторами вызывают активацию фосфолипазы С (ФЛC). При взаимодействии лиганда с рецептором активурующий ФЛC сигнал может передаваться специальным G-белком (Gq). Активированная ФЛC катализирует расщепление мембранного фосфолипида фосфатидилинозитол-4,5-дифосфата (ФИФ2) на инозитолтрифосфат (ИФ3) и диацилглицерол (ДАГ). Диацилглицерол связывается и стимулирует протеинкиназу С (ПKC), ИФ3 взаимодействует с активируемым им Са 2+ каналом (ИФ3 рецептором), в результате чего происходит выход ионов кальция из эндоплазматического ретикулума, которые участвуют в активации Са 2+ — кальмодулин-зависимых протеинкиназ, протеинкиназы С и многочисленных кальций-чувствительных белков. Таким образом, в отличие от других ферментов, катализирующих образование вторичных мессенджеров, ФЛС использует компоненты самой мембраны.
Рис. 4.3.7. Действие фосфолипазы С на фосфатидилинозитол-4,5-дифосфат
Протеинкиназы, типы
Протеинкиназами называют ферменты, катализирующие перенос фосфата от АТФ к специфическому аминокислотному остатку (серину, треонину, тирозину и т.д.). Протеинкиназы эукариот представляют собой суперсемейство гомологичных белков. Важнейшими представителями этого семейства являются серин-треониновые протеинкиназы и тирозиновые протеинкиназы.
Источник
Регуляция активности ферментов ковалентной модификацией
Регуляция активности ферментов ковалентной модификацией — это изменение активности за счет изменения конформации фермента в результате отщепления фрагмента его молекулы, а также ковалентного присоединения или отщепления определенных групп. Ковалентная модификация может быть обратимой и необратимой.
Необратимая ковалентная модификация наблюдается в тех случаях, когда происходит активация каталитически неактивного предшественника фермента. Некоторые ферменты синтезируются в клетках одной ткани или органа , а проявляют активность в другом. Для того, чтобы исключить повреждающее действие фермента на клетки, он синтезируется в виде профермента. Например, протеиназы ЖКТ, ферменты системы свертывания крови.
Обратимая ковалентная модификация может осуществляться путем ковалентного присоединения фосфатной группы
( преобладает у млекопитающих) или нуклеотида (преобладает у бактерий). Ферменты, подверженные ковалентной модификации, называют обратимой модифицируемыми ферментами. Обратимо модифицируемые ферменты могут находиться в двух состояниях, одно из которых характеризуется высокой, а другое — низкой каталитической активностью. В зависимости от конкретной ситуации более активным фермент может быть в фосфорилированной, либо в дефосфорилированной форме. Обычно фосфорилируется специфический остаток серина и образуется остаток О-фосфосерина. Хотя обратимо модифицируемый фермент может содержать много остатков серина, фосфорилирование происходит в высшей степени избирательно и затрагивает лишь небольшое число остатков. Фосфорилирование и дефосфорилирование катализируется соответственно протеинкиназами и протеинфосфатазами, которые в некоторых случаях сами являются обратимо модифицируемыми ферментами.

Источник
Ковалентная модификация ферментов
Еще одним способом изменять активность ферментов и таким образом, направленность метаболических процессов, является ковалентная или химическая модификация. Суть данного типа регуляции состоит в превращении активных форм ферментов в неактивные, и наоборот. Осуществляется такое взаимопревращение форм фермента путем ковалентного присоединения небольшой химической молекулы (фосфорной кислоты, АМР, уксусной кислоты) к определенным аминокислотным остаткам в молекуле фермента. Такими аминокислотами являются серин, треонин и тирозин. Процессы ковалентной модификации находятся под разнообразным контролем, в том числе и гормональным. Классическим примером такого рода регуляции является регуляция метаболизма гликогена в печени. Например, метаболизм гликогена определяется активностью гликогенфосфорилазы (мобилизация гликогена) и гликоген-синтазы (гликогеногенез). Активность этих ферментов регулируется координированно, т.е. если активна гликогенфосфорилаза, неактивна гликоген-синтаза. Следовательно, при определенных условиях в клетке будет превалировать либо расщепление, либо синтез гликогена (рис.28.4).
Рис.28.4. Регуляция активности гликогенфосфорилазы ковалентной модификацией (фосфорилирование-дефосфорилирование)
Ковалентная модификация регуляторных ферментов – заключительная стадия каскада реакций, передающих и усиливающих регуляторное действие некоторых гормонов непосредственно на обмен веществ в клетке.
Гормональная регуляция
Гормоны – сигнальные вещества, образующиеся в клетках эндокринных желез; поэтому гормональная регуляция свойственна только высшим организмам. Гормоны могут регулировать активность ферментов на уровне ковалентной модификации. Кроме того, они способны оказывать воздействие на скорость транскрипции (транскрипционная регуляция).
Из специализированных клеток, в которых происходит синтез гормонов, последние поступают в кровь и переносятся к клеткам-мишеням, имеющим рецепторы, способные связывать гормоны и тем самым воспринимать гормональный сигнал. Связывание гормона рецептором запускает каскад реакций с участием молекул-посредников. Этот процесс завершается клеточным ответом.
Липофильные гормоны связываются с внутриклеточным рецептором (белок) и регулируют транскрипцию определенных генов.
Гидрофильные гормоны действуют на клетки-мишени за счет связывания с рецепторами на плазматической мембране (рис.28.4).
Кроме гормонов аналогичным действием обладают другие сигнальные вещества: медиаторы, нейромедиаторы, ростовые факторы. Четкой границы, позволяющей отличать гормоны от перечисленных веществ, нет. Медиаторами называют сигнальные вещества, которые продуцируются не железами внутренней секреции, а различными типами клеток. К ним относят гистамин, простагландины, которые обладают гормоноподобным действием. Нейромедиаторами считают сигнальные вещества, продуцируемые клетками центральной нервной системы.
Посттранскрипционная и посттрансляционная модификация макромолекул
Модификация и/или процессинг первичных РНК-транскриптов осуществляются с разной скоростью, от чего зависит концентрация зрелых молекул РНК, способных транслироваться, а значит, и интенсивность белкового синтеза. В свою очередь полипептиды синтезированные на рибосомах, прежде чем превратиться в зрелый белок, также должны модифицироваться (см. лекцию31). В случае ферментов речь идет об их ковалентной модификации.
Источник
КОВАЛЕНТНАЯ МОДИФИКАЦИЯ ФЕРМЕНТОВ И ЕЕ ТИПЫ



Ковалентная модификация ферментов – тип регуляции ферментативной активности под действием других ферментов, осуществляющийся за счет присоединения к белковой молекуле небольших химических групп, что вызывает конформационные изменения в молекуле белка, приводящие к изменению определенной геометрии каталитического центра. Является быстрым механизмом регуляции активности ферментов внешними сигналами. Ковалентная модификация является основным механизмом при рецептор-зависимом ответе клеток на внешние воздействия, тогда как аллостерические эффекторы изменяют активность ферментов в ответ на изменение внутриклеточных условий.
Фосфорилирование – наиболее распространенный тип ковалентной модификации, является АТФ-зависимым процессом и осуществляется с помощью ферментов протеинкиназ. В большинстве случаев фосфорилированная форма фермента более активна, чем нефосфорилированная. Фосфорилирование модифицирует белки добавлением отрицательно заряженных остатков фосфорной кислоты к гидроксильным группам остатков серина, треонина и, реже, тирозина.
Рис. 4.3.1. Фосфорилирование/дефосфорилирование.
Возвращение фермента в исходное состояние осуществляется ферментами протеинфосфатазами, которые отщепляют неорганический фосфат от молекулы белка.
В некоторых случаях фосфорилирующие и дефосфорилирующие белки сами являются модифицируемыми ферментами. Активность протеинкиназ и протеинфосфатаз находится под гормональным контролем и регулируется нервной системой.
К ковалентной модификации ферментов помимо фосфорилирования относятся также аденилирование, уридилирование, ацетилирование, АДФ-рибозилирование.
Ковалентную модификацию аденилированием и уридилированием можно рассмотреть на примере регуляции активности фермента глутаминсинтетазы. Глутаминсинтетаза выполняет одну из ключевых функций в обмене азота у бактерий E. Coli. При выращивании Е. coli на среде, в которой источником азота служит не NH4 + , а другие соединения, в клетках наблюдается высокий уровень глутаминсинтетазной активности. Добавление в ростовую среду солей NH4 + вызывает быстрое (в течение минуты) десятикратное снижение активности фермента, которое нельзя объяснить подавлением его синтеза. Попытки объяснить данное явление привели к открытию фермента, катализирующего инактивацию глутаминсинтетазы in vitro в присутствии АТФ, Mg 2+ и глутамина. Далее было установлено, что разные формы фермента содержат различные количества ковалентно связанной АМФ. Далее было установлено, что инактивирующий белок является аденилилтрансферазой, катализирующей ковалентное присоединение АМФ к определенной тирозильной группе в каждой из 12 субъединиц глутаминсинтетазы. Однако полное превращение происходит только в экстремальных условиях, например когда клетки, выращенные в условиях недостатка NH4 + , попадают в среду, богатую этим соединением. Обычно глутаминсинтетаза находится в промежуточных состояниях аденилирования, в которых аденилированными являются лишь некоторые из 12 субъединиц.
Активность отдельной субъединицы в составе олигомера зависит от состояния соседних субъединиц (аденилированы они или не аденилированы), вероятно, из-за аллостерического влияния, которое передается через межсубъединичные контакты.
При переносе Е. coli из среды, богатой NH4 + , в бедную этим соединением среду происходит быстрая реактивация глутаминсинтетазы, что указывает на обратимость процесса аденилирования. Было установлено, что активность аденилилтрансферазой регулируется с помощью уридилирования и деуридилирования. Уридилирование происходит в результате катализируемого специфичной уридилилтрансферазой ковалентного присоединения УМФ к одному или двум тирозильмым остаткам каждой субъединицы аденилилтрансферазы. Деуридилирование катализируется уридилил-отщепляющим ферментом. Уридилирующий и деуридилирующий ферменты образованы одним полипептидом, который, подобно аденилилтрансферазе, проявляет бифункциональные свойства.
Примером ковалентной модификации белков с помощью ацетилирования является модификация гистонов. Ацетилирование гистонов играет важную роль в модуляции структуры хроматина при активации транскрипции, увеличивая доступность хроматина для транскрипционного аппарата. Гистоны целенаправленно модифицируются на тех промоторах, которые требуется активировать. Ацетилированию и деацетилированию подвергаются определенные остатки лизина, что осуществляется с помощью ферментов ацетилтрансфераз и деацетилаз. Предполагается, что ацетилированные гистоны менее прочно связаны с ДНК и поэтому ацетилирование может облегчать доступ и связывание факторов транскрипции с их элементами узнавания на ДНК. Ацетилирование остатков лизина в N-концевых «хвостиках» гистонов H2A, H2B, H3 и H4 нейтрализует их положительный заряд и соответственно блокирует ассоциацию с витками нуклеосомной ДНК. Это, в свою очередь, декомпактизует структуру как самой нуклеосомы, так и хроматина в целом и освобождает внешнюю поверхность витков ДНК для взаимодействий с регуляторными факторами.

Еще одним способом химической модификации ферментов с помощью присоединения небольших химических групп является АДФ-рибозилирование. АДФ-рибоза может вызывать неэнзиматическое АДФ-рибозилирование ряда белков. К ним относятсябелки регулирующие репарацию ДНК, белки-регуляторы трансляции и агрегации тромбоцитов. Моно-АДФ-рибозилирование – посттрансляционный процесс модификации белков, ответственный за токсический эффект некоторых бактериальных токсинов. Действие коклюшного или холерного токсинов вызывает моно-АДФ-рибозилирование белков плазматической мембраны и может изменять работу сигнальных систем или активность мембранного транспорта в результате нарушения функционирования G-белков. Схематически действие холерного токсина можно описать следующим образом (Рис. 4.3.2). В норме ГТФ, связанный с Gsα быстро гидролизуется (синяя стрелочка), так, что активация аденилатциклазы и увеличение цАМФ происходит столь долго, сколько гормон связан с рецептором. В присутствии холерного токсина Gsα необратимо модифицируется АДФ- рибозилированием, так, что она может связывать ГТФ, но не может его гидролизовать (красные стрелочки). В результате постоянной активации происходит нерегулируемый рост уровня цАМФ.
Рис. 4.3.2. Механизм действия холерного токсина
При нормальных условиях АДФ-рибозилированию могут подвергаться актин, десмин, интегрин-α-7.
Рис. 4.3.3. АДФ-рибоза
Аденилатциклаза
Аденилатциклаза (АТФ -пирофосфатлиаза циклизирующая) фермент, класса лиаз, катализирует гидролиз АТФ с образованием цАМФ и пирофосфата.
Рис. 4.3.4. структура цАМФ
Аденилатциклаза обнаружена практически во всех тканях животных, а также у бактерий. В клетках животных он локализован в плазматических мембранах, у бактерий – в мембранах и цитоплазме. Наиболее существенная роль цАМФ состоит в активации цАМФ – зависимых протеинкиназ (протеинкиназы А).
Рис. 4.3.5. Первичная структура аденилатциклазы
Рис. 4.3.6. Расположение аденилатциклазы в мембране
Фосфолипаза С
Фосфолипаза С является ключевым ферментом фосфоинозитидной мессенджерной системы. Многочисленные внеклеточные сигнальные молекулы (гормоны, нейромедиаторы, факторы роста, иммуноглобулины, антигены и др.), при взаимодействии со своими рецепторами вызывают активацию фосфолипазы С (ФЛC). При взаимодействии лиганда с рецептором активурующий ФЛC сигнал может передаваться специальным G-белком (Gq). Активированная ФЛC катализирует расщепление мембранного фосфолипида фосфатидилинозитол-4,5-дифосфата (ФИФ2) на инозитолтрифосфат (ИФ3) и диацилглицерол (ДАГ). Диацилглицерол связывается и стимулирует протеинкиназу С (ПKC), ИФ3 взаимодействует с активируемым им Са 2+ каналом (ИФ3 рецептором), в результате чего происходит выход ионов кальция из эндоплазматического ретикулума, которые участвуют в активации Са 2+ — кальмодулин-зависимых протеинкиназ, протеинкиназы С и многочисленных кальций-чувствительных белков. Таким образом, в отличие от других ферментов, катализирующих образование вторичных мессенджеров, ФЛС использует компоненты самой мембраны.
Рис. 4.3.7. Действие фосфолипазы С на фосфатидилинозитол-4,5-дифосфат
Протеинкиназы, типы
Протеинкиназами называют ферменты, катализирующие перенос фосфата от АТФ к специфическому аминокислотному остатку (серину, треонину, тирозину и т.д.). Протеинкиназы эукариот представляют собой суперсемейство гомологичных белков. Важнейшими представителями этого семейства являются серин-треониновые протеинкиназы и тирозиновые протеинкиназы.
Источник