- Урок. Получение алканов. презентация урока для интерактивной доски химии (10 класс) по теме
- Скачать:
- Предварительный просмотр:
- Содержание презентаций
- Презентация Power Point
- В последние годы термин «углеводороды» популярен не только среди химиков. Политики, экономисты, просто думающие люди понимают, какую роль эти вещества играют в судьбе нашей страны. «Нефть повсюду. Она влияет даже на те решения, о которых мы не подозреваем… История двадцать первого века будет пахнуть нефтью!» — можно прочитать на страницах всемирной паутины или услышать из уст героев телеэкрана.
- Сегодня мы не будем искать ответ на «почему такое значение имеет добыча нефти?», сегодня нас будет интересовать вопрос «как можно получить одну из главных составляющих нефти — алканы в промышленных масштабах и условиях лаборатории?» А в конце урока даже сами попытаемся получить в нашей лаборатории самый легкий из всего гомологического ряда – метан. И еще: нам сегодня особо пригодится одно важное качество: а именно – внимательность! Эта способность замечать мелочи, концентрироваться позволит многим из вас украсить свой дневник заслуженной отличной оценкой. А сейчас откройте, пожалуйста, тетради, запишите тему урока. Изучать получения алканов начнем с промышленных способов.
- Страница 1
- 2. Промышленные способы получения алканов позволяют обеспечивать потребности страны в топливе, а промышленности в сырье.
- Слайд 3,4
- Главный источник алканов – нефть. Её можно разделить на несколько фракций с помощью фракционной перегонки.
- Конспект занятия по органической химии Получение, свойства и применение алканов план-конспект занятия по химии на тему
- Скачать:
- Предварительный просмотр:
- По теме: методические разработки, презентации и конспекты
- Получение алканов
- Просмотр содержимого документа «Получение алканов»
Урок. Получение алканов.
презентация урока для интерактивной доски химии (10 класс) по теме
Органическая химия. 10 класс. Химико-биологический профиль.
Тема урока «Получение алканов»
Представленный материал содержит конспект урока и две презентации: одна в традиционном РРТ, другая – для интерактивной доски Interwrite. На уроке происходит изучение нового материала, а именно – способов получения алканов.
Кадры киноопытов, демонстрационный опыт электролиза раствора ацетата натрия, анимация химических реакций в презентации облегчает понимание учащихся сути представленных процессов, работа с интерактивной доской позволяет тут же и закрепить изученный материал.
Учащимся будет предложено, работая в парах, получить метан методом Дюма. Эксперимент очень прост, безопасен и довольно-таки нагляден.
В заключение урока – небольшая рефлексия. Одно задание на двоих. Узнать по портрету авторов изученных методов получения алканов, разделить все способы на промышленные и лабораторные, отметив те из них, с помощью которых можно получить метан.
Скачать:
| Вложение | Размер |
|---|---|
| statya_.rar | 19.27 КБ |
| prilozhenie_no1.doc | 229 КБ |
Предварительный просмотр:
232-276-856 Богуславская Н.К.МОУ Лицей г.Фрязино Московской области
Органическая химия. 10 класс. Химико-биологический профиль.
- Сформировать представления учащихся о способах получения предельных углеводородов – промышленных и лабораторных. Привлечь внимание к глобальным проблемам, стоящим перед человечеством: экологическим, энергетическим и сырьевым.
- Развивать личность обучаемого, готовить к самостоятельной деятельности в условиях информационного общества.
- Формировать умения безопасной работы с веществами при выполнении химического эксперимента.
Оборудование : спиртовка, стеклянная трубочка, стеклянная палочка, пипетка, стеклянная пластина, держатель для пробирок, ступка с пестиком, оборудование для проведения электролиза.
Реактивы: Ацетат натрия, натронная известь, раствор соляной кислоты.
Технологии: Личностно-ориентированные технологии, ИКТ.
Демонстрационный опыт : электролиз раствора ацетата натрия
Лабораторный опыт : получение метана методом Дюма
Дополнительно: презентация в PowerPoint «Получение алканов», презентация Interwrite
Содержание презентаций
Презентация Power Point
1 .Вступительное слово учителя
В последние годы термин «углеводороды» популярен не только среди химиков. Политики, экономисты, просто думающие люди понимают, какую роль эти вещества играют в судьбе нашей страны. «Нефть повсюду. Она влияет даже на те решения, о которых мы не подозреваем… История двадцать первого века будет пахнуть нефтью!» — можно прочитать на страницах всемирной паутины или услышать из уст героев телеэкрана.
Сегодня мы не будем искать ответ на «почему такое значение имеет добыча нефти?», сегодня нас будет интересовать вопрос «как можно получить одну из главных составляющих нефти — алканы в промышленных масштабах и условиях лаборатории?» А в конце урока даже сами попытаемся получить в нашей лаборатории самый легкий из всего гомологического ряда – метан. И еще: нам сегодня особо пригодится одно важное качество: а именно – внимательность! Эта способность замечать мелочи, концентрироваться позволит многим из вас украсить свой дневник заслуженной отличной оценкой. А сейчас откройте, пожалуйста, тетради, запишите тему урока. Изучать получения алканов начнем с промышленных способов.
Страница 1
2. Промышленные способы получения алканов позволяют обеспечивать потребности страны в топливе, а промышленности в сырье.
Слайд 3,4
Главный источник алканов – нефть. Её можно разделить на несколько фракций с помощью фракционной перегонки.
Источник
Конспект занятия по органической химии Получение, свойства и применение алканов
план-конспект занятия по химии на тему
В данном материале изучаются способы получения предельных углеводородов, их физические и химические свойства, а также области применения алканов на основе их свойств
Скачать:
| Вложение | Размер |
|---|---|
| konspekt_2.doc | 81 КБ |
Предварительный просмотр:
Получение, свойства и применение алканов
Техническая эксплуатация и обслуживание электрического и электромеханического
Продолжаем изучение алканов по единому для всех классов органических веществ плану.
- Получение.
- Физические и химические свойства.
- Применение.
Предельные УВ можно получать в больших количествах (промышленные способы получения) и в небольших – для проведения различных опытов (лабораторные способы получения).
Основные промышленные способы получения :
1) из природного сырья (нефти, природного и попутного нефтяного газов) с помощью ректификации.
Ректификация (фракционная перегонка) – физический способ разделения смеси компонентов с различными температурами кипения.
Газообразные алканы чаще получают из природного и попутного нефтяного газов, а твердые – из нефти.
2) газообразные и жидкие алканы находят более широкое применение в народном хозяйстве, чем твердые. Поэтому часть твердых (высших) алканов, получившихся в результате ректификации, используют для получения низших предельных УВ. Для этого их подвергают крекингу.
Крекинг – разложение молекул высших углеводородов под действием высокой температуры примерно пополам.
С 10 Н 22 С 5 Н 12 + С 5 Н 10
декан пентан пентен
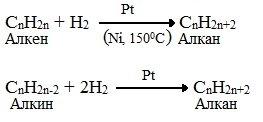
3) При крекинге высших УВ, как мы видим, кроме предельных УВ образуются непредельные УВ. Из них также можно получить алканы с помощью реакции гидрирования.
Гидрирование – присоединение водорода к молекулам непредельных УВ.
С 5 Н 10 + Н 2 С 5 Н 12
Основные лабораторные способы получения .
4) Синтез Вюрца . При взаимодействии галогеналканов с натрием образуются предельные УВ и галогенид натрия.
2СН 3 – СН 2 Br + 2Na → CH 3 – CH 2 – CH 2 – CH 3 + 2NaBr
бромэтан бутан бромид натрия
Синтез Вюрца хорошо протекает только в том случае, когда атом галогена присоединен к первичному атому углерода. В результате этой реакции цепь атомов углерода увеличивается в два раза. Если натрием подействовать на смесь галогеналканов (например, бромэтан и бромметан), то в результате образуется смесь алканов (этан, пропан и бутан).
5) Гидролиз карбидов . При обработке некоторых карбидов, например, карбида алюминия, водой образуется метан.
Al 4 C 3 + 12 H 2 O → 4 Al(OH) 3 + 3 CH 4
6. Физические и химические свойства.
С увеличением молекулярной массы в гомологическом ряду алканов их физические свойства последовательно изменяются: повышаются температуры кипения и плавления. Первые четыре члена ряда метана – газы, последующие (С 5 – С 15 ) – жидкости. Начиная с С 16 Н 34 , предельные УВ являются твердыми веществами. Газообразные и твердые алканы запаха не имеют, а жидкие — имеют характерный бензиновый запах. Отсутствие в молекулах предельных УВ полярных связей приводит к тому, что они плохо растворяются в воде, но растворяются в неполярных углеводородных растворителях (по принципу «подобное растворяется в подобном»). Кроме того, жидкие алканы сами являются органическими растворителями.
Как уже говорилось, в молекулах алканов связи малополярны и очень прочны, поэтому они не могут вступать в реакции с заряженными частицами (ионами). Неполярные связи склонны к гомолитическому разрыву, поэтому наиболее характерными для алканов являются реакции, протекающие с участием свободных радикалов — реакции свободнорадикального замещения , в ходе которых атом водорода заменяется на атом галогена или какую-либо группу атомов. Кроме реакций замещения, для алканов характерны реакции отщепления, разрыва цепи и некоторые другие.
- реакции замещения (наиболее характерны для алканов).
а) галогенирование – процесс замещения атомов водорода на атомы галогенов (хлор, бром, йод, фтор). Эти реакции проводятся под действием УФ-излучения или высокой температуры, и в их результате образуется смесь галогензамещенных алканов. Схематично хлорирование метана можно изобразить следующим образом:
СН 4 + Cl 2 CH 3 Cl + HCl
CH 3 Cl + Cl 2 CH 2 Cl 2 + HCl
CH 2 Cl 2 + Cl 2 CHCl 3 + HCl
CHCl 3 + Cl 2 CCl 4 + HCl
б) нитрование (реакция Коновалова) – процесс замещения атома водорода на нитрогруппу.
СН 4 + HNO 3 CH 3 NO 2 + H 2 O
2) реакции отщепления (также характерны для алканов)
а) дегидрирование – отщепление от молекулы алкана молекулы водорода и получение непредельного УВ.
СН 3 – СН 2 — СН 3 СН 3 – СН = СН 2 + Н 2
б) ароматизация . Алканы с шестью и более атомами углерода в цепи в присутствии катализатора циклизуются с образованием бензола и его производных СН 3
СН 3 СН 2 СН 2 СН 2 СН 2 СН 2 СН 3 + 4Н 2
а) горение (характерно для всех углеводородов)
СН 4 + 2О 2 → СО 2 ↑ + 2Н 2 О
2СН 4 + 3О 2 → 2СО↑ + 4Н 2 О при недостатке
СН 4 + О 2 → С + 2Н 2 О кислорода
б) каталитическое окисление . В зависимости от условий проведения реакции (температура, давление) и природы катализатора могут образовываться спирты, альдегиды или карбоновые кислоты.
СН 4 СН 3 ОН Н – С = О Н – С = О
метан метанол Н ОН
метаналь метановая, или
4) разрушение цепи . В результате этих реакций происходит разрыв связей между атомами углерода или между атомами углерода и водорода.
а) пиролиз – термическое разложение без доступа воздуха при пониженном давлении.
б) крекинг С 6 Н 14 → С 3 Н 8 + С 3 Н 6
в) изомеризация – процесс превращения углеводородов нормального (линейного) строения в разветвленные.
СН 3 – СН 2 – СН 2 – СН 3 СН 3 – СН – СН 3
СН 3 2-метилпропан
Предельные УВ, в особенности метан, находят очень широкое применение в народном хозяйстве. Их применение связано с их свойствами.
1) Благодаря высокой теплоте сгорания алканы используют в качестве достаточно дешевого топлива в быту, в промышленности, как моторное топливо.
2) Получение спиртов, альдегидов, органических кислот, а далее из них – каучуков, синтетических моющих средств, синтетических жиров, смазочных материалов, лаков, эмалей и т.д.
3) Метан – источник водорода для синтеза аммиака, ацетилена – для газосварки, сажи – для резины и типографской краски.
4) Получение галогенпроизводных:
— дихлорметан – используют как растворитель и в холодильной технике;
— трихлорметан (хлороформ) – как растворитель, получение фреонов, тефлона, хлорофоса;
— тетрахлорметан (четыреххлористый углерод) – как растворитель, получение фреона, гашение пламени, обезжиривающее средство;
— хлорэтан – средство местной анестезии.
По теме: методические разработки, презентации и конспекты
химические свойства и применение алканов
Изучение химических свойств алканов.Раскрыть важнейшие области практического применения алканов.
Методическая разработка урока «Химические свойства и применений алканов»
Методическая разработка урока «Химические свойства алканов и их применение».
Конспект занятия по органической химии «Предельные углеводороды, их строение, изомерия и номенклатура»
В данном материале рассматривается определение класа органических веществ Алканы, их гомологический ряд и особенности электронного и пространственного строения, а также виды изомерии и алгоритм состав.
Разработка урока по химии «Получение, свойства и применение углеводородов»
Урок повторения и закрепления знаний, умений и навыков. Устанавливаются связи между строением и свойствами органических веществ на примере углеводородов, выясняются причины многообразия органических в.
Урок по химии в 10 классе по теме «Получение, свойства и применение алкенов»
На данном уроке обучающиеся, работая в группах, рассматривают различные способы получения алкенов, знакомятся с их физическими и химическими свойствами, применением с помощью различных источников инфо.
Презентация к уроку по химии «Получение, свойства и применение алкенов». 10 класс.
Данная презентация является приложением к уроку по химии в 10 классе по теме «Получение, свойства и применение алкенов».
Источник
Получение алканов

Просмотр содержимого документа
«Получение алканов»
Тема 2. Углеводороды
Цель: изучение методы синтеза алканов и применения алканов.
Изучение нового материала.
Получение алканов
Алканы получают из природных источников – природного газа (80-90% — метан, 2-3% — этан и другие предельные углеводороды), угля, торфа, древесины, нефти и горного воска.
Выделяют лабораторные и промышленные способы получения алканов. В промышленности алканы получают:
Лабораторные спосoбы получения алканов.
1. По реакции Вюрца – действием металлического натрия на галоидные алкилы:
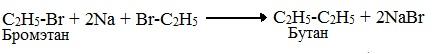
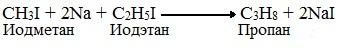
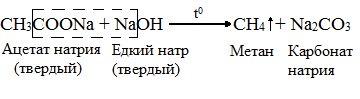
2. Сплавлением натриевых солей карбоновых кислот с едкими щелочами(Реакция Дюма):
3. Гидролиз карбида алюминия, получается метан:
АI4С3 + 12Н2О → 3СН4 + 4АI(ОН)3.
4. Гидрирование непредельных углеводородов в присутствии катализаторов.
Источник