Консервативный способ репликации днк у кого
Biology exam запись закреплена
Экзаменационный вопрос №5.Способы репликации ДНК: консервативный, полуконсервативный, дисперсионный. Опыты Мезельсон и Сталь
В 1957 г. Метью Мезелсон и Франклин Сталь поставили один из самых красивых биологических экспериментов, исследуя механизмы репликации ДНК. Для определения способа репликации ДНК необходимо четко различать материнские и дочерние молекулы. Мезелсон и Сталь выращивали бактерии кишечной палочки (Escherichia coli) на среде, содержащей в качестве источника азота его тяжелый изотоп – 15N. Молекула ДНК содержит большое количество атомов азота, при делении ДНК азот для новых цепочек берется из внешней среды. Тяжелый изотоп азота включался в состав молекулы ДНК и служил надежной меткой. Для того чтобы пометить практически всю бактериальную ДНК, необходимо было культивировать E. coli на такой среде в течение как минимум 12 поколений.
Мезелсон и Сталь длительное время культивировали E. coli на среде с 15N. После этого бактерии быстро переносили на среду, содержащую более легкий изотоп азота 14N. Благодаря тому, что клетки E. coli культивировались на двух различных средах, в состав молекул их ДНК входили оба изотопа азота: 14N и 15N. Отличить такие молекулы друг от друга можно было по плотности, поскольку масса нуклеотидов молекулы ДНК, содержащих 15N больше, по сравнению с обычной молекулой. ДНК бактериальных клеток, выращенных на среде с 15N, имела плотность 1,724 г/см3, а ДНК клеток, выращенных на среде с 14N – 1,710 г/см3.
После переноса культуры E. coli с одной среды на другую через каждое поколение Мезелсон и Сталь отбирали пробы. Контролем служила бактериальная культура, содержавшаяся на среде с 15N. Из каждой пробы бактериальных клеток путем центрифугирования извлекали ДНК. После этого ее смешивали с раствором хлористого цезия (CsCl) плотностью 1,7 г/см3, и вновь центрифугировали с очень высокой скоростью в течение нескольких дней. В результате осаждения молекул CsCl его раствор приобретал градиент плотности от 1,65 г/см3 в верхней части пробирки до 1,8 г/см3 у ее дна. В соответствии с этим, молекулы ДНК концентрировались в строго определенной области: у дна, в центре или в верхней части пробирки. Локализация ДНК устанавливалась на спектрофотометре, поскольку было известно, что она поглощает лучи с длиной волны 260 нм. Этот метод Мезелсон и Сталь разработали и опубликовали совместно с Джермом Виноградом (1913–1976) в 1957 г., непосредственно перед проведением эксперимента по репликации ДНК. пределяя плотность ДНК в каждой из проб, Мезелсон и Сталь обнаружили, что спустя одно поколение после переноса культуры E. coli со среды с 15N на среду с 14N плотность ДНК была промежуточной между 15N-ДНК и 14N-ДНК. Спустя два поколения половина бактериальных клеток содержала ДНК с легким изотопом азота (14N), а другая половина – такую же, как и в предыдущем поколении, ДНК промежуточной плотности. Через три поколения на среде с 14N в ¾ клеток содержалась легкая ДНК, а ¼ часть клеток сохраняла ДНК промежуточной плотности. Т. о., соотношение между числом генераций и распределением плотности ДНК точно соответствовало полуконсервативному типу репликации.
месте с тем, из гипотезы полуконсервативной репликации следовало, что ДНК с промежуточной плотностью между 15N-ДНК и 14N-ДНК должна быть гибридной. Это значит, что одна из ее цепей должна содержать только тяжелый изотоп азота (15N), а другая – только легкий (14N). Проверяя это предположение, Мезелсон и Сталь нагревали полученную ими ДНК промежуточной плотности в течение 30 минут при температуре 100 °С на водяной бане. При таких условиях двойная спираль молекулы ДНК денатурирует, образуя две отдельных цепочки, однако ковалентные связи между нуклеотидами в каждой из них не разрушаются. Проведя центрифугирование денатурировавшей ДНК в градиенте плотности хлористого цезия, Мезелсон и Сталь обнаружили, что в результате образовалось две фракции различной плотности. Плотность одной из них совпадала с плотностью молекул ДНК, содержащих тяжелый изотоп азота (15N), тогда как плотность другой была идентична плотности молекул ДНК с легким изотопом азота (14N). Из этого следовало, что молекула ДНК промежуточной плотности, образовавшаяся в первом поколении после переноса со среды с тяжелым изотопом азота на среду с легким изотопом, представляет собой гибридную молекулу. В ее состав входят две цепи – материнская, содержащая исключительно 15N и вновь синтезированная дочерняя, содержащая только 14N. Эти данные также подтвердили верность модели Уотсона–Крика и полуконсервативный характер репликации ДНК.
— Консервативная репликация:
Молекула ДНК служит матрицей для образования совершенно новой молекулы ДНК. В результате одна из образующихся клеток получает исходную молекулу ДНК, а другая – вновь синтезированную.
— Полуконсервативная репликация:
Две цепи исходной молекулы ДНК расходятся вследствие разрыва слабых водородных связей между азотистыми основаниями. Каждая из них служит матрицей для образования новой цепи, а возникающие между азотистыми основаниями водородные связи соединяют старую и новую цепи, восстанавливая целостность молекулы. В результате каждая новая клетка получает гибридную молекулу ДНК, состоящую из одной старой и одной новой цепи.
— Дисперсная репликация:
ДНК распадается на короткие фрагменты, используемые в качестве матриц для построения фрагментов двух новых молекул ДНК, которые затем каким-то образом соединяются между собой.
Источник
Биология. 11 класс
§ 16. Клеточный цикл. Репликация ДНК
Клеточный цикл . Все новые клетки образуются путем деления уже существующих. Этот принцип, как уже отмечалось, сформулировал Р. Вирхов еще в середине XIX в. Деление клеток обеспечивает непрерывность существования жизни на нашей планете. Именно благодаря ему осуществляются различные способы бесполого и полового размножения организмов. В основе процессов роста, регенерации и индивидуального развития многоклеточных организмов также лежит деление клеток.
Период существования клетки от момента ее образования из материнской клетки до собственного деления (включая это деление) или гибели называется клеточным циклом.
Продолжительность клеточного цикла у разных организмов и различных клеток в составе одного организма варьирует. Так, у бактерий в благоприятных условиях он длится примерно 20 мин. Короткие клеточные циклы (30—60 мин) характерны для бластомеров рыб и земноводных на этапе дробления, в то время как у млекопитающих промежуток времени между делениями бластомеров может достигать 10 ч и более. У взрослых мышей клетки кишечного эпителия делятся каждые 11—22 ч, а роговицы глаза — приблизительно один раз в трое суток. Для регулярно делящихся клеток многоклеточных организмов длительность клеточного цикла обычно составляет 12—36 ч.
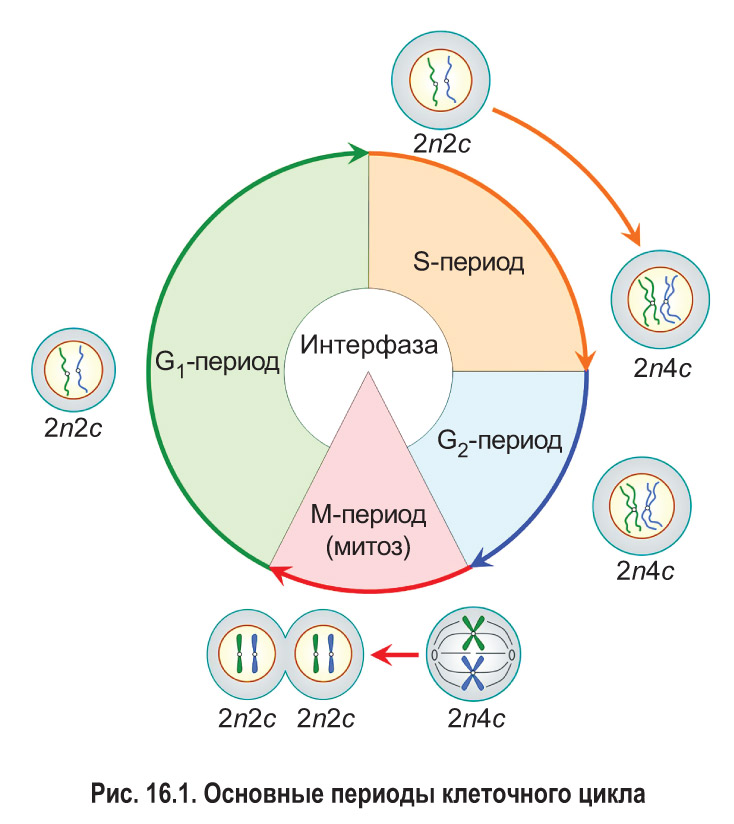
Пресинтетический, или G1-пе риод (от англ. gap — промежуток), начинается с момента образования новой клетки в результате деления материнской. Обычно это самый длительный период интерфазы и клеточного цикла в целом. В течение G1-периода молодая клетка интенсивно растет, в ней увеличивается количество органоидов и синтезируются различные соединения, необходимые для протекания процессов жизнедеятельности. В том числе образуются вещества, которые будут нужны для последующего удвоения молекул ДНК.
Вы уже знаете, что набор хромосом обозначают как n: например, 1n — гаплоидный набор, 2n — диплоидный. Набор молекул ДНК в клетках принято записывать с помощью буквы с. Из § 14 вам известно, что каждая хроматида содержит одну молекулу ДНК, т. е. количество молекул ДНК и хроматид в составе хромосом всегда совпадает. Таким образом, записи типа 1с, 2с, 4с отражают содержание в клетках не только молекул ДНК, но и соответствующих хроматид.
В пресинтетическом периоде каждая хромосома состоит из одной хроматиды. Следовательно, в G1-периоде число хромосом (n) и хроматид (с) в клетке одинаковое. Набор хромосом и хроматид диплоидной клетки в G1-периоде клеточного цикла можно выразить записью 2n2c.
В синтетическом, или S-периоде (от англ. synthesis — синтез), происходит удвоение молекул ДНК — репликация, а также удвоение центриолей клеточного центра (в тех клетках, где он имеется). После завершения репликации каждая хромосома состоит уже из двух идентичных сестринских хроматид, которые соединены друг с другом в области центромеры. Количество хроматид в каждой паре гомологичных хромосом становится равным четырем. Таким образом, набор хромосом и хроматид диплоидной клетки в конце S-периода (т. е. после репликации) выражается записью 2n4c.
Постсинтетический, или G2-период, продолжается от окончания синтеза ДНК (репликации) до начала деления клетки. В это время клетка активно запасает энергию и синтезирует белки для предстоящего деления (например, белок тубулин для построения микротрубочек, образующих впоследствии веретено деления). В течение всего G2-периода набор хромосом и хроматид в клетке остается неизменным — 2n4c.
Итак, интерфаза обычно включает три периода: пресинтетический (G1), синтетический (S) и постсинтетический (G2). На протяжении всей интерфазы хромосомы не спирализованы. Они располагаются в ядре клетки в виде хроматина .
После завершения интерфазы начинается деление клетки. Основным способом деления клеток эукариот является митоз, поэтому данный этап клеточного цикла обозначают как М-период. При митозе происходит спирализация хроматина . Это приводит к формированию компактных двухроматидных хромосом. После этого сестринские хроматиды каждой хромосомы отделяются друг от друга и затем попадают в разные дочерние клетки. Значит, дочерние клетки, образовавшиеся в результате митоза и вступающие в новый клеточный цикл, имеют набор 2n2c.
Обобщенная информация об основных периодах клеточного цикла представлена в таблице 16.1.
Таблица 16.1. Основные периоды клеточного цикла
Период
Содержание наследственного материала в диплоидной клетке
Источник
Способы репликации днк: консервативный, полуконсервативный, дисперсионный. Опыты Мезельсон и Сталь.
Для того чтобы объяснить каким образом может самокопироваться стабильная двойная спираль ДНК Уотсон и Крик предположили, что ее цепи способны к раскручиванию с последующим разделением цепей за счет разрыва водородных связей. Образовавшиеся одноцепочные молекулы могут служить матрицей, к которой на основании комплементарности присоединяются соответствующие нуклеотиды. В результате образуется 2 цепи ДНК идентичные родительской -полуконсервативный способ. Консервативный способ — материнская ДНК соединяется с материнской, а дочерняя с дочерней. Дисперсный способ — материнская с дочерней. Экспериментально гипотезу Уотсона и Крика подтвердили опыт Мезельсона и Сталя. Они работали с кишечной палочкой, помещенной в среду с тяжелым азотом (N15). Азот включал пурины и пиримидины и образовавшееся ДНК имела большую плотность, чем ДНК клеток выращенных на легком азоте. Затем выращенные на тяжелом азоте клетки переносили в среду содержащую легкий азот. Новое поколение клеток поместили в хлористый цезии и получили, что 1 поколение осели ниже, чем 2и 3 поколение. Таким образом, подтвердился полуконсервативный способ репликации ДНК.
Направление репликации днк. Образование репликативной вилки. Точка ori.
Сделанный Мезельсоном и Сталем вывод был полностью подтвержден и для других объектов, включая животных и высшие растения. Вместе с тем ,оставалось неясным,в каком направлении происходит репликация ДНК и какие ферменты обеспечивют этот процесс. Ответ на первый вопрос удалось получить Дж. Кэрнсу (1963) в опытах на E. Coli. Он поставил своей задачей сделать процесс репликации ДНк видимым, для чего использовал метод авторадиографии. Этот метод позволяет обнаруживать и локализовывать радиоактивную метку, включающуюся в молекулы ДНК,РНК, либо белка путем их помещения на чувствительную к радиации фотоэмульсию. Днк можно специфично метить если выращивать клетки с тимидином, являющимся дезоксирибонуклеозидом тимина. Тимидин изибрательно включается в ДНк, поэтому выращивание клеток E. Coli в среде с меченым по тритию тимидином позволяет следить за распределением метки по мере ее включения во вновь сентизирующуюся ДНК. Поскольку крупные молекулы ДНК лагко разрываются при механически повреждениях, Кэрнс разработал такую технику при которой клетки разрушались ферментом лизоцимом, а ДНК из лизированных клеток собирали на мембранных фильтрах, помещаемых стекла, покрытые фотоэмульсией, чувствительной к B-частицам, выделяющимся при распаде трития. Радиоавтографы, полученные после проявления таких фотографических стекол, выдерживавшихся предварительно в темноте до образования зерен металлического серебра, показали, что хромосома E. Coli имеет кольцевидную форму и во время своей репликации образует cтруктуры в форме греческой буквы 0. Обнаружение подобных структур, являющихся формами молекул ДНК в процессе их репликации, показывало, что раскручивание двух
комплементарных цепей родительской ДНК и их полуконсервативная репликация происходят практически одновременно и начинаются в общей точке начала репликации, обозначаемой как локус ori. Последующий анализ результатов опыта Кэрнса и данные других экспериментаторов, нацеленных на изучение механизма репликации ДНК у различных бактерий, фагов, плазмид, показали, что в большинстве случаев она происходит двунаправлено и начинается, как правило, от одного уникального локуса оri. В этом месте в одной из цепей ДНК разрывается фосфодиэфирная связь, обеспечивающая последующее раскручивание дуплекса и образование особых структур — репликативных вилок, движущихся в противоположных направлениях по кольцевой ДНК. Следует, однако, отметить, что в ДНК эукариот, как правило, обнаруживается не один, а множество локусов оri, что, по-видимому, служит необходимым условием для того, чтобы громадные молекулы ДНК в хромосомах эукариот успели полностью отреплицироваться за время одного клеточного цикла.
Эксперименты, проведенные на прокариотах (Е.Coli, Т7, некоторые плазмиды), также выявили в их ДНК (скорость репликации которых составляет около 20 мкм/мин, что в 20-30 раз выше, чем у эукариот) не по одному, а по два или даже более локусов оri. Среди этих локусов наблюдается подчиненность: когда активен главный оri, остальные могут не функционировать, и, напротив, в случае выключения главного оri запасные оri обеспечивают репликацию ДНК. Очевидно, такая зависимость обеспечивает стабильность важнейшей функции ДНК — ее способности к репликации.
Источник





