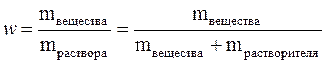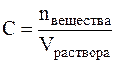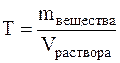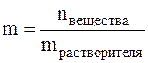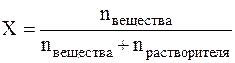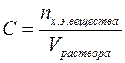Способы выражения количественного состава растворов
Массовая доля – ω%, равна отношению массы растворенного вещества к массе раствора, выраженная в процентах: ω % = (m(x) / mр-ра) • 100%, массу раствора можно выразить через объем и плотность mр-ра = Vр-ра• ρ р-ра, тогда ω % = (m(x) / Vр-ра • ρ р-ра) • 100%. Массовая доля показывает количество грамм растворенного вещества, содержащегося в 100 г раствора.
0,9% раствор натрия хлорида означает, что в 100 граммах данного раствора содержится 0,9 г NaCl и 99,1 г воды. В медицине и фармации используется выражение – процентная концентрация – как синоним массовой доли.
Молярная концентрация – С(х), равна отношению количества вещества к объему раствора: С(х) = n(x) / Vр-ра, моль/л. Молярная концентрация показывает количество молей растворенного вещества в 1литре раствора. Зная, что n(x) = m(x) / М(х), формулу для расчета молярной концентрации можно представить следующим образом: С(х) = m(x) / М(х)•Vр-ра. Если использовать выражение массовой доли, тоС(х) = ω % • 10 • ρ р-ра / М(х).
С(NaCl) = 0,5 моль/л говорит о том, что в 1 литре раствора содержится 0,5 молей или 0,5 моль•58,5 г/моль = 29,25 г хлорида натрия. Молярную концентрацию раствора также называют молярностью, обозначают – М. Для раствора С(NaCl) = 0,5 моль/л обозначение молярности – 0,5 М.
Молярная концентрация эквивалента– С(1/z x), равна отношению количества вещества эквивалента к объему раствора: С(1/z х) = n(1/z x) / Vр-ра, моль/л.
Под эквивалентом (z) понимается некая реальная (молекула, атом, ион) или условная частица (УЧ) вещества, которая может присоединять, отдавать или быть каким-либо образом эквивалентна одному протону водорода в кислотно-основной реакции или одному электрону в окислительно-восстановительной реакции.
Например, молекула H2SO4 содержит два эквивалента вещества, z(H2SO4) = 2; молекула NaOH – один эквивалент, z(NaOH) = 1. Смысл понятия эквивалент заключается в том, что в реакции участвует равное число эквивалентов веществ. Так, в реакции: H2SO4 + 2NaOH = Na2SO4 + 2H2O с двумя эквивалентами серной кислоты будут взаимодействовать два эквивалента гидроксида натрия. Для расчетов чаще используют понятие фактора эквивалентности.
Фактор эквивалентности – fэкв(х) = 1/z, – число, обозначающее какая часть реальной частицы вещества х эквивалентна одному протону водорода в кислотно-основной реакции или одному электрону в окислительно-восстановительной реакции.
Расчет факторов эквивалентности:
По формуле вещества
fэкв(кислоты) = 1 / основность кислоты
fэкв(основания) = 1 / кислотность основания
fэкв(соли) = 1 / (количество атомов металла • степень окисления металла)
fэкв(оксида) = 1 / (количество атомов элемента • валентность элемента)
По уравнениям реакции
Для кислотно-основных реакций:
fэкв(H2SO4) = 1/2, так как в реакции участвовали два протона водорода, следовательно одному протону водорода эквивалентна ½ часть молекулы H2SO4; fэкв(NaOH) = 1, потому что одна молекула гидроксида натрия взаимодействует с одним протоном водорода или с одним эквивалентом кислоты.
Исходя из аналогичных рассуждений, значения факторов эквивалентности для реакций: H2SO4 + NaOH → NaHSO4 + H2O и Na2B4O7 + 2HCl + 5H2O → 4H3BO3 + 2NaCl будут следующими: fэкв(H2SO4) = 1; fэкв(NaOH) = 1; fэкв(Na2B4O7) = 1/2; fэкв(HCl) = 1
Для окислительно-восстановительных реакций:
fэкв(окислителя) = 1 / количество принятых электронов
fэкв(восстановителя) = 1 / количество отданных электронов
Зная способы расчета факторов эквивалентности, можно рассчитать количество вещества эквивалента n(1/z x) = z • n(x).Масса количества вещества эквивалента выражается молярной массой эквивалента вещества М(1/z х) = 1/z • М(х), г/моль.
Поскольку, С(1/z х) = n(1/z x) / Vр-ра, данную формулу можно представить следующим образом: С(1/z х) = n(x) • z / Vр-ра или С(1/z х) = m(x) • z / М(х) • Vр-ра.
Так как m(x) / М(х) • Vр-ра = С(х), то можно проследить взаимосвязь между молярной концентрацией эквивалента и молярной концентрацией:С(1/z х) = С(х) • z; С(х) = С(1/z х) / z.
Молярная концентрация эквивалента показывает количество вещества эквивалента в 1 литре раствора. Раствор серной кислоты с молярной концентрацией эквивалента 0,1 моль/л подразумевает, что в 1 л данного раствора содержится 0,1 моль эквивалента серной кислоты или m(H2SO4) = С(1/2 H2SO4) • М(H2SO4) • Vр-ра / 2 = 0,1 • 98 • 1/2 = 4,9 г.
Молярную концентрацию эквивалента называют нормальной или эквивалентной концентрацией. Обозначают буквами – н или N. Для раствора С(1/2 H2SO4) = 0,1 моль/л обозначение нормальной или эквивалентной концентрацией – 0,1 н или 0,1 N.
Моляльная концентрация вещества, или моляльность b(x), — величина, измеряемая отношением количества вещества к массе растворителя. b(x) = n(x) / mрастворителя, моль/кг.
Молярная доля вещества — χ,показывает отношение количества этого вещества к суммарному количеству вещества всех компонентов раствора.χi = ni / Σni. Для раствора, состоящего из трех компонентов А, В, С молярную долю, например, компонента А рассчитывают по формулеχ(А) = n(A) / (n(A)+n(B)+n(C)).
Титр – Т(x),величина, равная отношению массы растворенного вещества к 1 мл раствора. Единица измерения — г/мл. Значение титра можно рассчитать по формулам: Т(x) = m(x) / Vр-ра; Т(x) = С(x) • М(х) / 1000; Т(x) = С(1/z х) • М (1/z х) / 1000.
Т(НСl) = 0,00365 г/мл говорит о том, что в 1мл данного раствора содержится 0,00365 г НСl.
Массовая концентрация – γ(х) – отношение массы растворенного вещества, содержащегося в растворе к объему раствора.γ(х) = m(x) / Vр-ра, г/л, г/мл.
Миллиграмм процент – мг % —показывает количество миллиграммов растворенного вещества в 100 мл раствора.
Промиле – 0 /00 –показывает количество миллиграммов растворенного вещества в 1000 мл раствора.
Закон эквивалентов:Вещества, растворы которых имеют одинаковую молярную концентрацию эквивалента, реагируют в равных объемах, то есть в равных количествах вещества эквивалента.
Формула для расчета объема раствора для приготовления методом разбавления
Источник
Способы выражения состава растворов



Состав любого раствора может быть выражен как качественно, так и количественно. Обычно, при качественной оценке раствора применяют такие понятия как, насыщенный, ненасыщенный, пересыщенный (или перенасыщенный), концентрированный и разбавленный раствор.
Насыщенным называется раствор, в котором содержится максимально возможное при данных условиях (t, р) количество растворённого вещества. Насыщенный раствор часто находится в состоянии динамического равновесия с избытком растворённого вещества, при котором процесс растворения и процесс кристаллизации (выпадения вещества из раствора) протекают с одинаковой скоростью.
Для приготовления насыщенного раствора растворение вещества необходимо вести до образования осадка, не исчезающего при длительном хранении.
Ненасыщенным называется раствор, который содержит вещества меньше, чем его может раствориться при данных условиях.
Перенасыщенные растворы содержат в себе по массе больше растворённого вещества, чем его может раствориться в данных условиях. Образуются перенасыщенные растворы при быстром охлаждении насыщенных растворов. Они неустойчивы и могут существовать ограниченное время. Очень быстро лишнее растворённое вещество выпадает в осадок, а раствор превращается в насыщенный.
Следует отметить, что при изменении температуры насыщенный и ненасыщенный растворы могут легко обратимо превращаться друг в друга. Процесс выделения твёрдого вещества из насыщенного раствора при понижении температуры называется кристаллизацией. Кристаллизация и растворение играют огромную роль в природе: приводят к образованию минералов, имеют большое значение в атмосферных и почвенных явлениях. На основе кристаллизации в химии распространён метод очистки веществ, который называется перекристаллизацией.
Для приблизительного количественного выражения состава раствора используют понятия концентрированный и разбавленный растворы.
Концентрированным называется раствор, в котором масса растворённого вещества соизмерима с массой растворителя, т.е. не отличается от него более чем в 10 раз.
Если же масса растворённого вещества более чем в десять раз меньше массы растворителя, то такие растворы называются разбавленными.
Однако следует помнить, что деление растворов на концентрированные и разбавленные условно, и чёткой границы между ними нет.
Точный количественный состав растворов выражают при помощи массовой доли растворённого вещества, его молярной концентрации, а также некоторыми другими способами.
Массовая доля растворённого вещества (w) – это безразмерная физическая величина, равная отношению массы растворённого вещества к общей массе раствора,т.е.
Обычно выражается в долях единицы или в процентах. Массовая доля, выраженная в %, называется процентной концентрацией. Она показывает, какая масса вещества растворена в 100 г раствора.
Молярная концентрация (С) или молярность – это величина, равная отношению количества растворённого вещества к объему раствора (в литрах), т.е.
Молярность измеряется в моль/л и показывает сколько моль вещества растворено в одном литре раствора. Молярность обозначается обычно буквой М. Если в одном литре раствора содержится 1 моль вещества, то такой раствор называется одномолярным (1М), если 0,1 моль вещества – децимолярным (0,1М), если 0,01 моль вещества – сантимолярным (0,01М), если 0,001 моль вещества – миллимолярным (0,001М).
Титром (Т) называется отношение массы вещества в граммах к объёму раствора в мл, т.е.
Титр имеет размерность г/мл, он показывает, сколько грамм вещества растворено в 1 мл раствора.
Моляльная концентрация или моляльность (m) – это величина, равная отношению количества растворённого вещества к массе растворителя, выраженной в кг, т.е.
Моляльность имеет размерность моль/кг и показывает, какое количество вещества растворено в 1 кг растворителя.
Мольная доля (Х) – это величина, равная отношению количества растворённого вещества к общему количеству вещества в растворе:
Мольная доля – это безразмерная величина и измеряется в долях единицы или в %.
Молярная концентрация химического эквивалента вещества (С) или нормальная концентрация – это величина, равная отношению количества химического эквивалента растворённого вещества к объему раствора (в литрах), т.е.

Молярная концентрация химического эквивалента вещества измеряется в моль/л и показывает сколько моль эквивалента вещества растворено в одном литре раствора. Она обозначается обычно буквой н. Если в одном литре раствора содержится 1 моль химического эквивалентавещества, то такой раствор называется однонормальным (1н), если 0,1 моль вещества – децинормальным (0,1н), если 0,01 моль вещества – сантинормальным (0,01н), если 0,001 моль вещества – миллинормальным (0,001н).
Источник
Концентрация растворов. Способы выражения концентрации растворов.
Концентрация раствора может выражаться как в безразмерных единицах (долях, процентах), так и в размерных величинах (массовых долях, молярности, титрах, мольных долях).
Концентрация – это количественный состав растворенного вещества (в конкретных единицах) в единице объема или массы. Обозначили растворенное вещество — Х, а растворитель — S. Чаще всего использую понятие молярности (молярная концентрация) и мольной доли.
Способы выражения концентрации растворов.
1. Массовая доля (или процентная концентрация вещества) – это отношение массы растворенного вещества m к общей массе раствора. Для бинарного раствора, состоящего из растворённого вещества и растворителя:

ω – массовая доля растворенного вещества;
mв-ва – масса растворённого вещества;
Массовую долю выражают в долях от единицы или в процентах.
2. Молярная концентрация или молярность – это количество молей растворённого вещества в одном литре раствора V:

C – молярная концентрация растворённого вещества, моль/л (возможно также обозначение М, например, 0,2 М HCl);
n – количество растворенного вещества, моль;
V – объём раствора, л.
Раствор называют молярным или одномолярным, если в 1 литре раствора растворено 1 моль вещества, децимолярным – растворено 0,1 моля вещества, сантимолярным – растворено 0,01 моля вещества, миллимолярным – растворено 0,001 моля вещества.
3. Моляльная концентрация (моляльность) раствора С(x) показывает количество молей n растворенного вещества в 1 кг растворителя m:

С (x) – моляльность, моль/кг;
n – количество растворенного вещества, моль;
4. Титр – содержание вещества в граммах в 1 мл раствора:

T – титр растворённого вещества, г/мл;
mв-ва – масса растворенного вещества, г;
5. Мольная доля растворённого вещества – безразмерная величина, равная отношению количества растворенного вещества n к общему количеству веществ в растворе:

N – мольная доля растворённого вещества;
n – количество растворённого вещества, моль;
nр-ля – количество вещества растворителя, моль.
Сумма мольных долей должна равняться 1:
Иногда при решении задач необходимо переходить от одних единиц выражения к другим:
ω(X) — массовая доля растворенного вещества, в %;
М(Х) – молярная масса растворенного вещества;
ρ= m/(1000V) – плотность раствора. 6. Нормальная концентрация растворов (нормальность или молярная концентрация эквивалента) – число грамм-эквивалентов данного вещества в одном литре раствора.
Грамм-эквивалент вещества – количество граммов вещества, численно равное его эквиваленту.
Эквивалент – это условная единица, равноценная одному иону водорода в кислотоно-основных реакциях или одному электрону в окислительно – восстановительных реакциях.
Для записи концентрации таких растворов используют сокращения н или N. Например, раствор, содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н.

СН – нормальная концентрация, моль-экв/л;
z – число эквивалентности;
Растворимость вещества S — максимальная масса вещества, которая может раствориться в 100 г растворителя:
Коэффициент растворимости – отношение массы вещества, образующего насыщенный раствор при конкретной температуре, к массе растворителя:
Источник