- Классификация рецепторов по способу передачи сигнала фармакология
- Классификация рецепторов по способу передачи сигнала фармакология
- Виды рецепторов фармакологических препаратов
- Содержание
- Типы рецепторов [ править | править код ]
- Рецепторы фармакологических препаратов [ править | править код ]
- Рецепторы, связанные с ферментами [ править | править код ]
Классификация рецепторов по способу передачи сигнала фармакология
Рецепторы — макромолекулы, функция которых заключается в связывании веществ-посредников и в преобразовании этой связи в действие, т, е. изменение клеточной функции. Рецепторы отличаются по своей структуре и способу преобразования контакта с лигандом в клеточный ответ (преобразование сигнала).
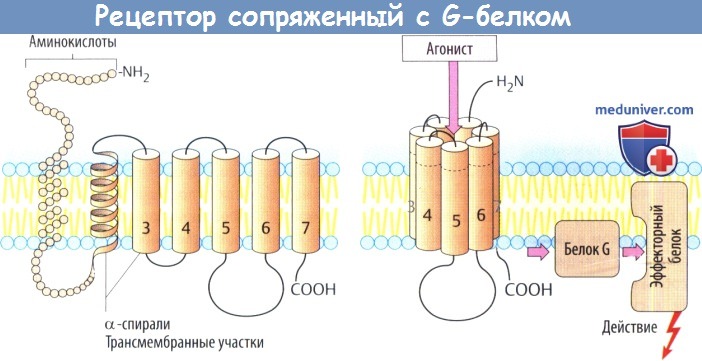
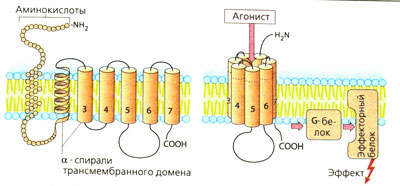
а) Рецепторы, сопряженные с белком G, состоят из цепи аминокислот, которая направлена в сторону мембраны и от нее в виде серпантина. С вне-мембранными петлевыми участками молекулы связаны углеводные остатки через различные точки N-гликозилирования.
Семь а-спиральных, охватывающих мембрану участков образуют окружность возле центральной ниши, которая несет участки для связывания медиаторных веществ. Связывание молекулы медиатора или структурно связанной молекулы агониста вызывает изменение конформации белка, в результате чего он вступает во взаимодействие с белком G (белок, связывающий нуклеотид гуанил).
Белки G располагаются в нижнем слое плазмолеммы и состоят из трех субъединиц, обозначаемых а, β и γ. Существует несколько белков G, которые отличаются в основном своей a-единицей. Контакте рецептором активирует белок G, что, в свою очередь, приводит к активации другого белка (фермента, ионного канала). Многие медиаторы действуют через рецепторы, сопряженные с белком G.
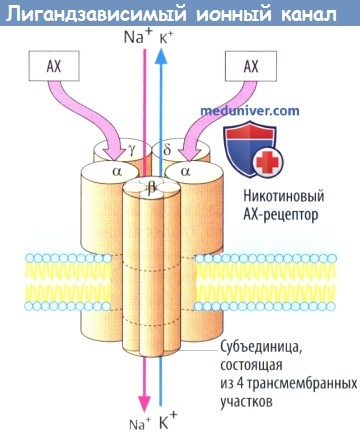
б) Примером лигандзависимого ионного канала является никотиновый холинорецептор на концевой пластинке двигательного нерва. Рецепторный комплекс образован пятью субъединицами, каждая из которых содержит четыре трансмембранных участка.
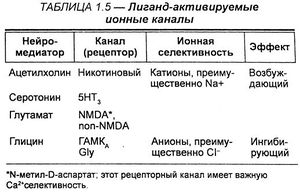
Одновременное связывание двух молекул АХ двумя а-субъединицами приводит к открытию ионного канала со входом Na + (и выходом некоторого количества К + ), деполяризации мембраны и активации потенциала действия. Нейронные N-холинорецепторы, очевидно, состоят лишь изо- и β-субъединиц.
Ряд рецепторов медиатора γ-аминомасляной кислоты (ГАМК) принадлежат к данной группе: подтип ГАМКA связан с хлорными каналами (и с участком связывания бензодиазепинов). Глутамат и глицин оба действуют через лигандзависимые ионные каналы.
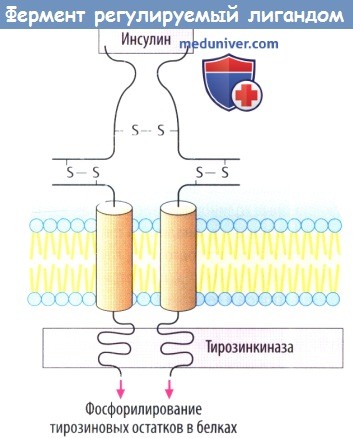
в) Белок инсулинового рецептора представляет собой управляемый лигандом фермент, каталитический рецептор. При связывании инсулина с внеклеточным участком «отключается» активность тирозинкиназы внутри клетки. Фосфорилирование белка приводит к изменению клеточной функции в результате образования других сигнальных белков. Рецепторы гормонов роста тоже принадлежат к классу каталитических рецепторов.
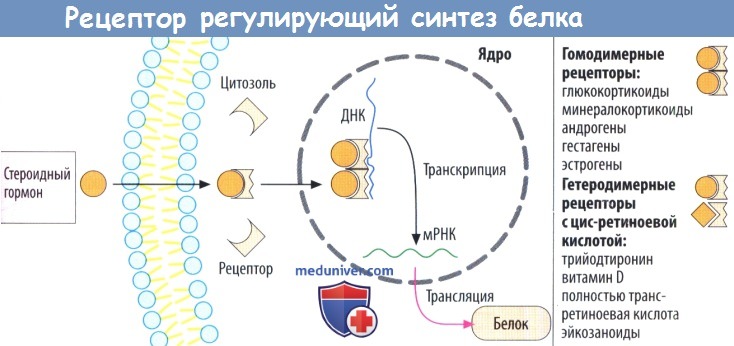
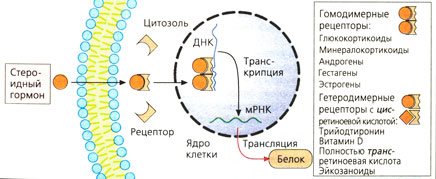
г) Рецепторы, регулирующие синтез белка, стероидов и гормонов щитовидной железы, находятся в цитозоле и в клеточном ядре соответственно. Белки рецепторов также расположены внутриклеточно, в зависимости от гормона — в цитозоле (глюкокортикоиды, минералокортикоиды, андрогены и гестагены) или в клеточном ядре (эстрогены, гормоны щитовидной железы).
При связывании гормона открывается скрытый в норме участок белка рецептора, что дает возможность последнему связаться с особой последовательностью нуклеотидов ДНК в гене и регулировать его транскрипцию. Из этого следует, что комплексы лиганд-рецептор работают как факторы, регулирующие транскрипцию. Обычно происходит активация или усиление и, редко, блокада транскрипции.
Комплексы гормон-рецептор взаимодействуют парно с ДНК. Эти пары (димеры) могут состоять из двух идентичных комплексов гормон-рецептор (гомодимерная форма, например, с гормонами надпочечников или половыми гормонами). Комплекс тиреоидный гормон-рецептор встречается в гетеродимерной форме и сочетается с комплексом цис-ретиноевая кислота-рецептор.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Источник
Классификация рецепторов по способу передачи сигнала фармакология
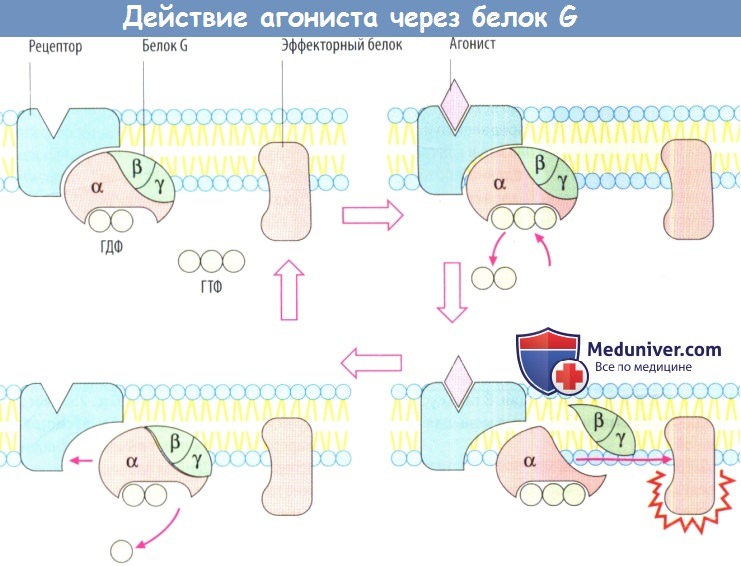
При передаче сигнала на рецепторы, сопряженные с белком G, участвует фактически такой же основной механизм. Связывание агониста рецептором приводит к изменению конформации белка рецептора. Это изменение передается на белок G: а-субъединица изменяет гуанозиндифосфат (ГДФ) на гуанозинтрифосфат (ГТФ), затем диссоциирует от двух других субъединиц, связывается с эффекторным белком и изменяет его функциональное состояние.
В принципе, β- и γ-субъединицы тоже способны взаимодействовать с эффекторными белками, а-субъединица медленно гидролизует связанный ГТФ до ГДФ. Ga-ГДФ не обладает аффинитетом к эффекторному белку и вновь связывается с β- и γ-субъединицами. Белки G могут диффундировать вдоль мембраны; они не прикреплены к отдельным белкам рецепторов. Тем не менее существует связь между типами рецепторов и типами белка G.
Более того, α-субъединицы отдельных белков G различаются аффинитетом к разным эффекторным белкам, а также характером воздействия на них. Ga-ГТФ белка Gs стимулирует аденилатциклазу, в то время как Ga-ГТФ белка Gi является ее ингибитором.
Группа сопряженных с G-белком рецепторов включает мускариновые холинорецепторы, адренорецепторы норадреналина и адреналина, а также рецепторы дофамина, гистамина, серотонина, глутамата, ГАМК, морфина, простагландинов, лейкотриенов и многих других медиаторов и гормонов.
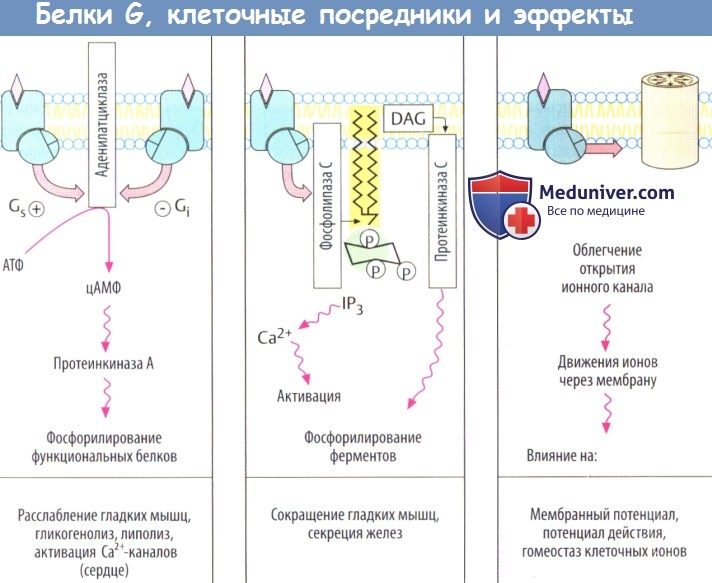
К основным эффекторным белкам у сопряженных с G-белком рецепторов относятся аденилатциклаза (АТФ => внутриклеточный посредник цАМФ), фосфолипаза С (фосфатидилинозитол => внутриклеточные посредники инозитолтрифосфата и диацилглицерола), а также белки ионного канала. Множество клеточных функций регулируется концентрацией клеточного циклического аденозинмонофосфата (цАМФ), поскольку цАМФ увеличивает активность протеинкиназы А, которая катализирует превращение фосфатных групп в функциональные белки.
Повышение уровня цАМФ приводит к снижению тонуса гладких мышц, увеличению сократимости сердечной мышцы, а также повышению гликогенолиза и липолиза. Фосфорилирование белков сердечных Са 2+ -каналов повышает вероятность открытия каналов во время деполяризации мембраны. Следует отметить, что цАМФ инактивируется фосфодиэстеразой. Ингибиторы данного фермента повышают внутриклеточную концентрацию цАМФ и действуют как адреналин.
Белок рецептора самостоятельно фосфорилируется с потерей свойства активировать связанный белок G. Это один из механизмов, который способствует снижению чувствительность клетки во время длительной стимуляции рецептора агонистом (десенситизация).
Активация фосфолипазы С приводит к гидролизу мембранного фосфолипида фосфатидилинозитол-4,5-дифосфата до инозитолтрифосфата (IР3) и диацил-глицерола (DAG). Инозитолтрифосфат стимулирует высвобождение Са 2+ из органелл-депо, что приводит к сокращению гладкомышечных клеток, распаду гликогена или к активации экзоцитоза. Диацилглицерол стимулирует протеинкиназу С, которая фосфорилирует ряд ферментов, содержащих серин или треонин.
Некоторые белки G вызывают открытие белков каналов. Таким образом активируются К + -каналы (действие АХ на синусовый узел, действие опиоидов на передачу нервного импульса).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Источник
Виды рецепторов фармакологических препаратов
Содержание
Типы рецепторов [ править | править код ]
Рецепторы — это макромолекулы, которые способны присоединять биологически активные вещества-переносчики, в результате чего происходит изменение клеточной функции. Рецепторы различаются по строению и типу передачи сигнала (трансдукция сигнала).
Рецепторы, связанные с G-белком (А), состоят из аминокислотной цепи, которая многократно пронизывает мембрану в форме а-спиралей. Вне мембраны рецепторы связаны с остатками сахара (гликозилированы). Предполагают, что семь трансмембранных доменов расположены по кругу, а в центре находится углубление со специальными участками связывания переносчика. Присоединение переносчика или схожего агониста приводит к изменению конформации рецепторных белков, благодаря чему открывается доступ к G-белку (гуанин-нуклеотид-связывающий белок). G-Белок расположен на внутренней стороне мембраны и состоит из трех субъединиц: а, β и у. Разные G-белки отличаются строением а-субъединиц. Контакт с рецептором приводит к активации G-белка, что в свою очередь влияет на другие белки (ферменты, ионные каналы). Очень многие вещества-переносчики действуют через рецепторы, связанные с G-белком.
Примером лиганд-зависимого ионного канала (Б) является никотиновый холинорецептор мотонейрона. Рецепторный комплекс состоит из пяти субъединиц; каждая содержит по четыре трансмембранных домена. Одновременное присоединение двух молекул ацетилхолина (ACh) к обеим а-субъединицам приводит к открытию ионных каналов для входа Na+ (и выхода К+), деполяризации мембраны и возникновению потенциала действия. N-Xoлинорецепторы ганглиев состоят только из а- и β-субъединиц (а2рз). Часть ГАМ К-рецепторов (лигандом для которых является у-аминомасляная кислота) также относится к этому типу рецепторов: ГАМКд-рецептор содержит один хлорный канал (и, кроме того, участок связывания бензодиазепина).
К лиганд-зависимым ферментам (В) относится инсулиновый рецептор, который представляет собой каталитический рецептор. Если инсулин присоединяется к внеклеточному центру связывания, то во внутриклеточной части «включается» тирозинки-назная активность. Фосфорилирование белков приводит к изменениям функции клетки. Рецепторы гормонов роста тоже относятся к каталитическому типу.
Рецепторы, регулирующие синтез белка (Г), характерны для стероидных гормонов и гормонов щитовидной железы. Рецепторные белки расположены в цитозоле клетки (например, глюкокортикоиды, минералокортикоиды, андрогены, гестагены) или в ядре (например, экстрогены, гормоны щитовидной железы). После присоединения переносчика высвобождается скрытый домен рецепторного белка и становится возможным присоединение нуклеотидов к цепи ДНК и транскрипция определенных генов. Комплекс лиганд-рецептор является регулятором транскрипции, которая чаще всего активируется, реже блокируется.
Гормонорецепторный комплекс в виде димеров взаимодействует с ДНК. Димеры могут состоять из двух идентичных гормонорецепторных комплексов (гомодимеры, например у гормонов надпочечников или половых гормонов). Комплекс гормона щитовидной железы с рецептором образует гетеродимер с комплексом цис-ретиноевой кислоты и рецептора.

Рецепторы фармакологических препаратов [ править | править код ]
Рецепторная теория действия лекарств начала развитие с конца XIX в., когда П. Эрилих выдвинул концепцию о лекарстве как «волшебной пуле», направленной на «поражаемый рецептор». Многие годы рецепторы характеризовали по эффектам различных эндо- и экзогенных соединений, названия которых определяли номенклатуру рецепторов.
Прямая идентификация рецепторов лекарств, гормонов, нейромедиаторов стала возможной в 60-х годах XX в. благодаря разработке методов радиолигандного анализа. Более глубокое понимание структуры и функции рецепторов в последние два десятилетия достигнуто на основе молекулярно-генетических исследований. Большинство рецепторов выделено, определена их аминокислотная последовательность, клонированы сотни кодирующих рецепторы генов.
Большинство современных исследователей отличают рецепторное связывание от неспецифического, прежде всего, поскольку последнее не ведет к специфическому эффекту.
Не все лекарства влияют на рецепторы, имеющие эндогенные лиганды: фармакологическое действие может опосредоваться ферментами, небелковыми элементами — липидами, изменением содержания ионов и состава воды, другими процессами.
Взаимодействие лекарственных средств со специфическими рецепторами обеспечивается различными типами химических связей. Иногда имеет место ковалентное связывание, однако для фармакологических препаратов характерно обратимое связывание за счет комбинации электростатического взаимодействия, водородных связей, ван-дер-ваальсовых связей при высокой комплементарности лиганда к рецептору. Рецептор также должен быть стереоселективен в отношении оптических изомеров лекарств.
Сигнальные механизмы. На сегодняшний день выделяют четыре основных механизма, по которым экстраклеточный лиганд регулирует внутриклеточные процессы. Молекулярные основы сигнальных систем трансдукции значительно различаются.
Первой, наиболее сложной, является рецепторная система, связанная с G-белками. Она состоит из трансмембранного рецептора, к которому лиганд присоединяется на поверхности клетки, этот рецептор сопрягается с расположенным на внутренней поверхности мембраны гуаниннуклеотидсвязывающим белком (G-белком). Этот белок в свою очередь регулирует эффекторный фермент, генерирующий внутриклеточный вторичный мессенджер.
Второй тип рецепторной системы — рецепторы, связанные с тирозинкиназой и гуанилилциклазой. Они состоят из трансмембранных рецепторов, в которых внутриклеточная часть обладает ферментативной активностью, аллостерически регулируемой лигандным связыванием на внешнем по отношению к мембране участке рецептора.
Третий тип — более простая система рецептора, это регулируемый лигандом трансмембранный ионный канал. Его открытое состояние определяется прямым связыванием лиганда с экстраклеточным участком каналообразующих белков.
Четвертый тип — характерен для жирорастворимых лигандов. В этом случае проникший через мембрану лиганд связывается с внутриклеточным рецептором, далее этот комплекс присоединяется к специфическому участку ДНК в ядре и регулирует транскрипцию.
Для понимания фармакогенетического значения лиганд-рецепторного взаимодействия механизмы трансдукции следует рассмотреть более подробно.
Рецепторы, связанные с ферментами [ править | править код ]
Гуанилатциклазные рецепторы. Известен только один класс таких рецепторов для семейства пептидных гормонов, называемых предсердными натрийуретическими пептидами (atrial natriuretic peptides, ANP). Они секретируются мышечными клетками в ответ на повышение артериального давления и связываются с рецепторами в почках, где индуцируют увеличение экскреции натрия и воды, и в гладких мышцах сосудов, вызывая их релаксацию. ANP-рецептор является одиночным полипептидом, содержащим экстрацеллюлярный ANP-связывающий домен, одиночный трансмембранный домен и внутриклеточный каталитический домен с гуанилатциклазой. Активация рецептора ведет к увеличению продукции цГМФ, который в свою очередь активирует серин-треонинкиназы, цГМФ-зависимую протеинкиназу (протеинкиназу G). Белки-мишени для протеинкиназы G и сигнальные каскады, ведущие к ответу на AN Р, недостаточно изучены.
Ионные каналы, контролируемые лигандным связыванием. Синаптические нейромедиаторы связываются с группой рецепторов на постсинаптических мембранах, известных как лиганд-контролируемые ионные каналы. Среди них ацетилхолин, γ-аминомасляная кислота, глицин, глутамат. Лигандконтролируемые ионные каналы — важнейшая мишень для действия лекарственных средств, особенно психотропных. Различные ионные каналы сходны по структуре, они состоят из нескольких субъединиц, формирующих в мембране ионный канал. Каждая субъединица канала — полипептид, содержащий четыре перекрывающих мембрану домена. В то же время для них характерна специфичность связывания нейромедиаторов и селективность транспорта ионов.
В данном классе наиболее полно охарактеризован Н-ацетилхолиновый рецептор. Этот ионный канал состоит из 5 субъединиц (2а, 5, Цу), которые совместно формируют пору, проходящую через плазматическую мембрану. Закрытая позиция двух а-субъединиц внутри мембраны формирует «ворота», препятствующие прохождению ионов через канал. Ацетилхолин, присоединяясь к экстрацеллюлярным участкам двух а-субъединиц, вызывает в них конформационные изменения, ведущие к открытию канала для ионов, особенно для Na+, которые соответственно химическому градиенту идут внутрь клетки.
Источник