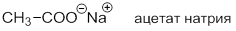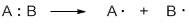Классификация ковалентной химической связи по способу перекрывания электронных орбиталей
- Главная
- Обучение
- Предварительный просмотр
- Мероприятия / ВИШР
- Обучение
- Тренажер ЕГЭ
- Учебные пособия
- Игры
- 120 лет ТПУ. Викторина онлайн
- Университетские субботы
- Высшая инженерная школа России
Химия
3.2. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа
Химические связи в молекулах органических соединений
Химическая связь – это силы взаимодействия между атомами или группами атомов, приводящие к образованию молекул, ионов, и т.д. По своей природе химическая связь – это электростатические силы. Главную роль при образовании химической связи между атомами играют их валентные электроны, т. е. электроны внешнего уровня, наименее прочно связанные с ядром. Из курса общей химии вы знаете о существовании ковалентной и ионной связи.
Ионная связь – это химическая связь, основанная на электростатическом притяжении ионов. Она возникает при большой разнице электроотрицательностей связываемых атомов. В органических соединениях ионные связи встречаются довольно редко, например, в солях карбоновых кислот:
Для органических соединений наиболее характерна ковалентная связь.
Ковалентная связь – это химическая связь, образованная за счет обобществления электронов двумя и более ядрами. Существуют два способа обобществления электронной пары: обменный и донорно-акцепторный.
По обменному механизму в образовании связи участвуют по одному электрону от каждого атома:
Н· + Cl· → H : Сl
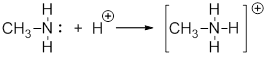
По донорно-акцепторному механизму ковалентная связь образуется за счет объединения электронной пары одного атома и свободной орбитали другого. Примером может служить взаимодействие молекулы амина с протоном с образованием метиламмоний катиона:
Классификация ковалентной связи по способам перекрывания атомных орбиталей
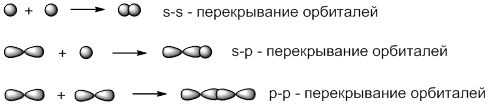
В зависимости от способа перекрывания атомных орбиталей различают σ- и π-связи. σ –связи образуются в результате перекрывания орбиталей вдоль линии, соединяющей центры ядер двух атомов:
π –связи образуются в результате бокового p-p-перекрывания орбиталей, в результате которого образуются две области повышенной электронной плотности:
Типы разрыва ковалентной связи
Разрыв ковалентной связи может происходить по гомолитическому или гетеролитическому механизмам.
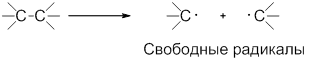
Гомолитические реакции – реакции, в которых разрыв связи происходит симметрично, так что каждому из образующихся фрагментов отходит по одному электрону:
Гомолиз от греческого homos – одинаковый, lysis – разрыв.
В ходе гомолитических реакций в качестве интермедиатов образуются свободные радикалы – частицы, содержащие неспаренный электрон, например:
Радикал – атом или группа атомов, имеющие неспаренный электрон.
Гетеролитические реакции – реакции, в которых разрыв связи происходит несимметрично, так что пара электронов связи остается у одного из образующихся фрагментов:
Гетеролиз – это несимметричный разрыв ковалентной связи, в результате которого образуются разные по природе частицы: катион и анион.
Если заряды в таких частицах находятся на атоме углерода, их называют – карбокатионы и карбанионы, например:
Электронная пара остается у более электроотрицательного атома.
Источник
Урок №64. Ковалентная связь. Полярная и неполярная ковалентные связи
Сущность и виды химической связи
Химическая связь — это взаимодействие атомов, осуществляемое путем обмена электронами .
Атомы стремятся завершить свой внешний уровень (до 8 электронов, исключение водород, гелий до 2 электронов)
В образовании химической связи участвуют валентные электроны. Число валентных электронов определяется по номеру группы, в которой находится атом, образующий химическую связь. Число неспаренных валентных электронов Nе — =8-N группы
Классификация химических связей
1. По способу достижения завершенной электронной оболочки
2. По механизму образования химической связи
3. По способу перекрывания электронных орбиталей
I. По способу достижения завершенной электронной оболочки
КОВАЛЕНТНАЯ СВЯЗЬ
КОВАЛЕНТНАЯ СВЯЗЬ — это связь, возникающая между атомами за счет образования общих электронных пар: H 2 , HCl, H 2 O, O 2
ИОННАЯ СВЯЗЬ
ИОННАЯ СВЯЗЬ – образуется между атомами металлов и неметаллов, т.е. между атомами, резко отличающимися друг от друга по значениям электроотрицательности: NaCl, K 2 O, LiF.
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ — связь в металлах и сплавах, которую выполняют относительно свободные электроны между ионами металлов в металлической кристаллической решетке.
II. По механизму образования химической связи (только для ковалентной связи)
III. По способу перекрывания электронных орбиталей (только для ковалентной связи)
КОВАЛЕНТНАЯ СВЯЗЬ — это связь, возникающая между атомами за счет образования общих электронных пар (Например, H 2 , HCl, H 2 O, O 2 ).
По степени смещения общих электронных пар к одному из связанных ими атомов ковалентная связь может быть полярной и неполярной.
А) КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ СВЯЗЬ (КНС) — образуют атомы одного и того же химического элемента — неметалла (Например, H 2 , O 2 , О 3 ).
Каждый атом неметалла отдает в общее пользование другому атому наружные не спаренные электроны. Образуются общие электронные пары. Электронная пара принадлежит в равной мере обоим атомам.
Б) КОВАЛЕНТНАЯ ПОЛЯРНАЯ СВЯЗЬ (КПС) — образуют атомы разных неметаллов, отличающихся по значениям электроотрицательности (Например, HCl, H 2 O) .
Образующиеся общие электронные пары смещены в сторону более электроотрицательного элемента согласно ряду электроотрицательности элементов, предложенному американским химиком Л. Полингом.
В результате на более электроотрицательном элементе образуется избыток электронной плотности ( частичный отрицательный заряд δ- ), а на менее электроотрицательном элементе образуется недостаток электронной плотности ( частичный положительный заряд δ+ ).
Электроотрицательность (ЭО) — это свойство атомов одного элемента притягивать к себе электроны от атомов других элементов.
Самый электроотрицательный элемент – фтор F.
Встречаются исключения, когда ковалентную связь образуют атом неметалла и металла!
AlCl 3 , разница в электроотрицательности ∆ Э.О.
Рассмотрим механизм образования молекул с ковалентной полярной и неполярной связями: Cl 2 , O 2 , HCl.
Источник
Лекция по химии №3
Лекция по общей химии №3
Конспект лекции по общей химии составлен в соответствии с программой учебной дисциплины Химия, которая является частью программы среднего (полного) общего образования, реализуемого в рамках СПО с учетом профиля получаемого профессионального образования.
Конспект лекций по органической химии предназначен для использования учащимися с целью самостоятельного изучения предмета, коррекции знаний, при повторении и подготовке к итоговой контрольной работе.
Тема: Химическая связь – ионная и ковалентная.
Под химической связью понимают такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы.
Различают четыре типа химических связей: ионную, ковалентную, металлическую и водородную.
1.Ионная химическая связь
Ионная химическая связь – это связь, образовавшаяся за счет электростатического притяжения катионов к анионам .
Атомы, присоединившие «чужие» электроны, превращаются в отрицательные ионы, или анионы . Атомы, отдавшие свои электроны, превращаются в положительные ионы, или катионы . Понятно, что между анионами и катионами возникают силы электростатического притяжения, которые и будут удерживать их друг около друга, осуществляя тем самым ионную химическую связь.
Так как катионы образуют в основном атомы металлов, а анионы – атомы неметаллов, логично сделать вывод, что этот тип связи характерен для соединений типичных металлов (элементы главных подгрупп I и II групп, кроме магния Mg и бериллия Be ) с типичными неметаллами (элементы главной подгруппы VII группы). Классическим примером является образование галогенидов щелочных металлов (фторидов, хлоридов и др.). Например, рассмотрим схему образования ионной связи в хлориде натрия:
Два разноименно заряженных иона, связанные силами притяжения, не теряют способности взаимодействовать с противоположно заряженными ионами, вследствие чего образуются соединения с ионной кристаллической решеткой. Ионные соединения представляют собой твердые, прочные, тугоплавкие вещества с высокой температурой плавления.
Растворы и расплавы большинства ионных соединений – электролиты. Такой тип связи характерен для гидроксидов типичных металлов и многих солей кислородсодержащих кислот. Однако при образовании ионной связи не происходит идеального (полного) перехода электронов. Ионная связь является крайним случаем ковалентной полярной связи
Кристаллическая решетка хлорида натрия, состоящая из противоположно заряженных ионов натрия и хлорид-ионов
В ионном соединении ионы представлены как бы в виде электрических зарядов со сферической симметрией электрического поля, одинаково убывающего с увеличением расстояния от центра заряда (иона) в любом направлении (рис. 1). Поэтому взаимодействие ионов не зависит от направления, то есть ионная связь, в отличие от ковалентной, будет ненаправленной.
Ионная связь существует также в солях аммония, где нет атомов металлов (их роль играет катион аммония 
2. Ковалентная химическая связь
Ковалентная химическая связь – это связь, возникающая между атомами за счет образования общих электронных пар.
Механизм образования такой связи может быть обменный или донорно-акцепторный.
Обменный механизм действует, когда атомы образуют общие электронные пары за счет объединения неспаренных электронов.
Связь возникает благодаря образованию общей электронной пары s -электронами атомов водорода (перекрыванию s -орбиталей):
Связь возникает за счет образования общей электронной пары из s — и p -электронов (перекрывания s – p -орбиталей):
Cl 2 – в молекуле хлора ковалентная связь образуется за счет непарных p -электронов (перекрывания p – p -орбиталей):
N 2 – в молекуле азота между атомами образуются три общие электронные пары:
По способу перекрывания электронных орбиталей различают σ- и π-ковалентные связи (сигма- и пи-) .
В молекуле азота одна общая электронная пара образуется за счет σ-связи (электронная плотность находится в одной области, расположенной на линии, соединяющей ядра атомов; связь прочная).
Две другие общие электронные пары образуются за счет π-связей, то есть бокового перекрывания p -орбиталей в двух областях; π-связь менее прочна, чем σ-связь.
В молекуле азота между атомами существует одна σ-связь и две π-связи, которые находятся во взаимно перпендикулярных плоскостях (так как взаимодействуют 3 неспаренных p -электрона каждого атома).
Следовательно, σ-связи могут образовываться за счет перекрывания электронных орбиталей:
а также за счет перекрывания «чистых» и гибридных орбиталей .
По числу общих электронных пар, связывающих атомы, то есть по кратности , различают ковалентные связи:
По степени смещенности общих электронных пар к одному из связанных ими атомов ковалентная связь может быть неполярной и полярной. При неполярной ковалентной связи общие электронные пары не смещены ни к одному из атомов, так как эти атомы имеют одинаковую электроотрицательность (ЭО) – свойство оттягивать к себе валентные электроны от других атомов.
Ковалентную химическую связь, образующуюся между атомами с одинаковой электроотрицательностью , называют неполярной .
то есть посредством ковалентной неполярной связи образованы молекулы простых веществ-неметаллов.
Значения относительной электроотрицательности фосфора и водорода практически одинаковы: ЭО ( Н ) = 2,1; ЭО ( Р ) = 2,1, поэтому в молекуле фосфина PH 3 связи между атомом фосфора и атомами водорода ковалентные неполярные.
Ковалентную химическую связь между атомами элементов, электроотрицательности которых различаются, называют полярной .
Азот – более электроотрицательный элемент, чем водород, поэтому общие электронные пары смещаются к его атому.
Источник