- Кислоты определение классификация способы получения химические свойства
- Виды кислот и способы их получения
- Что такое кислота — определение в химии
- Виды кислот и их классификация, какие бывают (примеры)
- По содержанию кислорода
- По растворимости в воде
- По летучести
- По силе (степени диссоциации)
- Характерные химические и физические свойства
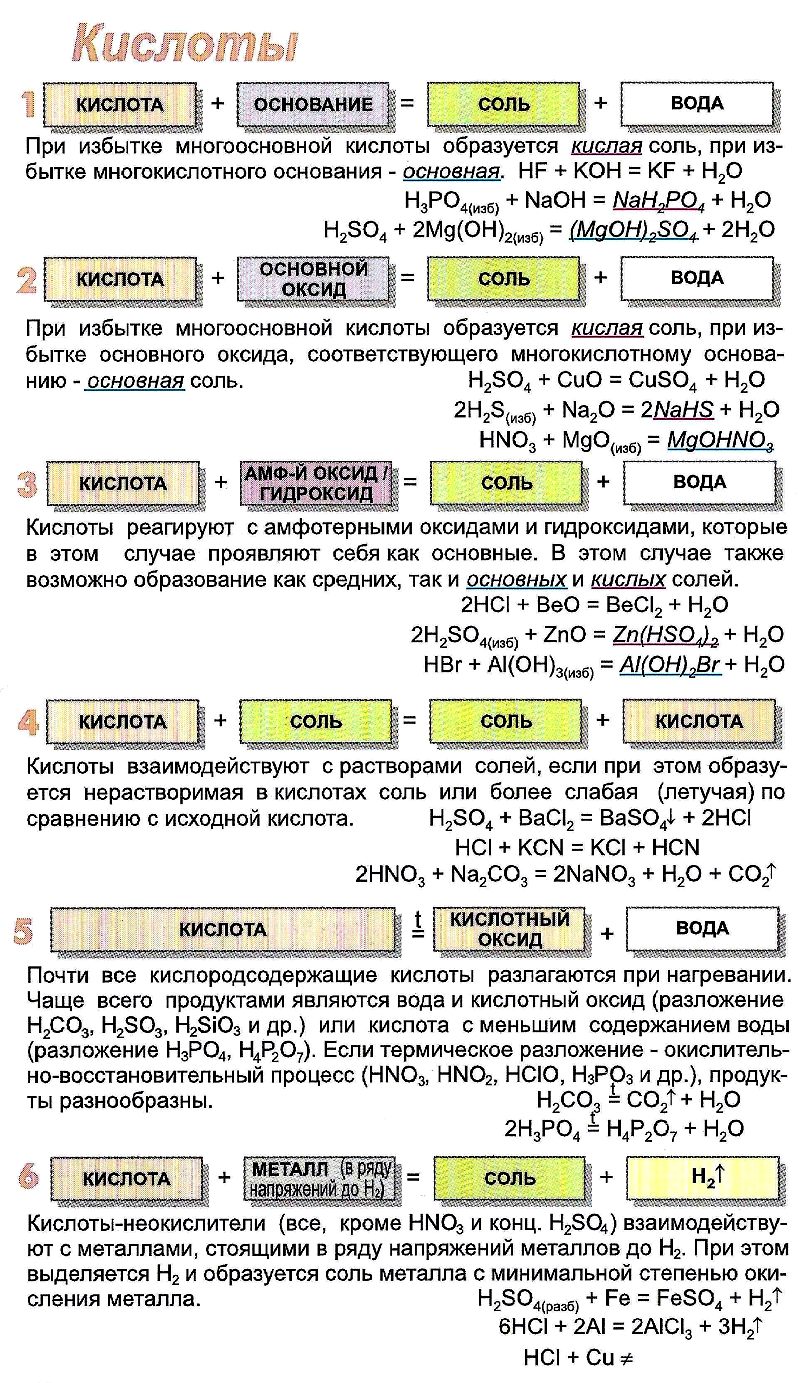
- Химические свойства
- Физические свойства
- Получение и применение кислот
- Кислоты определение классификация способы получения химические свойства
- Химические свойства кислот.
- Дополнительные материалы (таблицы )
Кислоты определение классификация способы получения химические свойства
3.2. Классификация, получение и свойства кислот
Кислотами (кислотными гидроксидами) с позиции теории электролитической диссоциации называются вещества, диссоциирующие в растворах с образованием ионов водорода.
Кислоты классифицируются по их силе, по основности и по наличию или отсутствию кислорода в составе кислоты.
По силе кислоты делятся на сильные и слабые. Важнейшие сильные кислоты – азотная HNO 3 , серная H 2 SO 4 , и соляная HCl .
По наличию кислорода различают кислородсодержащие кислоты ( HNO 3 , H 3 PO 4 и т.п.) и бескислородные кислоты ( HCl , H 2 S , HCN и т.п.).
По основности , т.е. по числу атомов водорода в молекуле кислоты, способных замещаться атомами металла с образованием соли, кислоты подразделяются на одноосновные (например, HNO 3 , HCl ), двухосновные ( H 2 S , H 2 SO 4 ), трехосновные ( H 3 PO 4 ) и т. д.
Названия бескислородных кислот производятся от названия неметалла с прибавлением окончания –водородная: HCl – хлороводородная кислота, H 2 S е – селеноводородная кислота, HCN – циановодородная кислота.
Названия кислородсодержащих кислот также образуются от русского названия соответствующего элемента с добавлением слова «кислота». При этом название кислоты, в которой элемент находится в высшей степени окисления, оканчивается на «ная» или «овая», например, H 2 SO 4 – серная кислота, HClO 4 – хлорная кислота, H 3 AsO 4 – мышьяковая кислота. С понижением степени окисления кислотообразующего элемента окончания изменяются в следующей последовательности: «оватая» ( HClO 3 – хлорноватая кислота), «истая» ( HClO 2 – хлористая кислота), «оватистая» ( H О Cl – хлорноватистая кислота). Если элемент образует кислоты, находясь только в двух степенях окисления, то название кислоты, отвечающее низшей степени окисления элемента, получает окончание «истая» ( HNO 3 – азотная кислота, HNO 2 – азотистая кислота).
Источник
Виды кислот и способы их получения
В химии неорганические соединения делятся на простые и сложные вещества. Простые состоят из атомов одного химического элемента, сложные — из нескольких. Сложные неорганические вещества делятся на пять основных классов: кислоты, основания, амфотерные гидроксиды, оксиды, соли.
Разберёмся с первым классом из списка — кислотами.
Что такое кислота — определение в химии
Кислоты — это сложные вещества, которые состоят из атомов водорода и кислотных остатков.
Общая формула: H x ( A c ) — n , где
A c — кислотный остаток;
x — число атомов водорода;
n — степень окисления кислотного остатка.
В химических реакциях активный атом водорода может замещаться на атом металла, в результате чего получается соль. Кислотный остаток — это часть молекулы кислоты без атомов водорода. Валентность кислотного остатка равна числу связанных с ним атомов водорода.
Виды кислот и их классификация, какие бывают (примеры)
Существуют несколько классификаций кислот. Разберёмся с основной классификацией, созданной по формальным признакам: содержанию кислорода, растворимости и так далее.
По содержанию кислорода
Кислоты могут делиться на кислородосодержащие и бескислородные.
Кислородсодержащие получаются при воздействии воды на кислотные оксиды — ангидриды.
Их название в корне содержит название элемента, входящего в состав ангидрида. Примеры:
- H 2 S O 4 — серная (сера — ангидрид);
- H N O 3 — азотная (азот — ангидрид);
- H 3 P O 4 — фосфорная (фосфор — ангидрид).
Номенклатура выглядит следующим образом. В случае, если элементу соответствуют несколько кислот, для названия кислоты с большей валентностью такого элемента употребляют суффикс «Н» или «В». Для кислот с меньшей валентностью элемента в названиях добавляют еще один суффикс «ИСТ». Например, серная ( H 2 S O 4 ) и сернистая кислота ( H 2 S O 3 ).
Бескислородные представляют собой растворы некоторых газов в воде. Названия бескислородных кислот составляют по принципу: элемент + водородная кислота.
- H2S — сероводородная;
- НСl — хлороводородная (соляная);
- НF — фтороводородная (плавиковая).
Важно, что газ и раствор газа имеют различные свойства. Например, хлороводород и соляная кислота.
Газ хлороводород можно получить из водорода и хлора. Уравнение:
H 2 + C l 2 → 2 H C l
В сухом состоянии такой газ не проявляет кислотных свойств. При перевозке в тех же металлических ёмкостях не происходит никаких реакций. Но, если хлороводород растворить в воде, получается раствор, который называют соляной кислотой. Она обладает сильными кислотными свойствами и опасна при реагировании с металлом.
По растворимости в воде
Кислоты делят на растворимые и нерастворимые. Большинство кислот растворимы. Нерастворимые — кремниевая H 2 S i O 3 и все органические карбоновые кислоты, содержащие десять атомов углерода и больше.
По летучести
Летучие кислоты — это химические соединения, которые быстро испаряются при нормальных условиях, то есть молекулы легко переходят в газовую фазу. В их список входят, к примеру, органические соединения, которые образуются в человеческом организме в результате процесса пищеварения, болезней или метаболизма.
Список летучих кислот:
- H N O 3 — азотная;
- H C l — хлороводородная;
- H B r — бромоводородная;
- H F — фтороводородная;
- H I — иодоводородная;
- H 2 S — сероводородная;
- H 2 S e — селеноводородная.
Нелетучими являются все остальные. Они стабильны в водных растворах.
По силе (степени диссоциации)
Кислоты также можно разделить на сильные и слабые. Если в водном растворе кислота полностью распадается на ионы (диссоциирует), то она является сильной. Слабые кислоты не распадаются на ионы полностью, обычно их диссоциация протекает в незначительной степени.
Как определить силу кислоты, то есть степень диссоциации? Можно использовать лёгкий приём: вычесть из числа атомов O число атомов H. Если в ответе получается число меньше 2 — слабая. Больше или равно — сильная.
- H 2 SO 4 = 4 — 2 = 2 — сильная;
- H 3 P O 4 = 4 — 3 = 1 — слабая.
Степень диссициации можно также установить экспериментальным путем посредством измерения проводимости растворов. Разбавленные растворы сильных кислот хорошо проводят электрический ток, растворы слабых кислот — плохо.
Характерные химические и физические свойства
Химические свойства
Взаимодействие с основными оксидами. Образуются соль и вода:
C a O + 2 H C l → C a C l 2 + H 2 O
Взаимодействие с амфотерными оксидами. Образуются соль и вода:
Z n O + 2 H N O 3 → Z n ( N O 3 ) 2 + H 2 O
Взаимодействие со щелочами. Образуются соль и вода (реакция нейтрализации):
N a O H + H C l → N a C l + H 2 O
Взаимодействие с солями. Реакция протекает, если выпадает осадок или выделяется газ:
B a C l 2 + H 2 S O 4 → B a S O 4 ↓ + H C l ↑
Сильные кислоты вытесняют более слабые из их солей:
K 3 P O 4 + 3 H C l → 3 K C l + H 3 P O 4
Также металлы, стоящие в ряду активности до водорода, вытесняют его из раствора кислоты (если соль, которая образуется в итоге, растворима):
M g + 2 H C l → M g C l 2 + H 2 ↑
Однако! С азотной и концентрированной серной кислотами реакция идёт иначе:
M g + 2 H 2 S O 4 → M g S O 4 + S O 2 ↑ + 2 H 2
Физические свойства
При нормальных условиях большинство неорганических кислот существуют в жидком состоянии, некоторые являются твердыми веществами ( H 3 P O 4 , H 2 S i O 3 ) . Большинство бескислородных кислот в безводном состоянии являются газами ( Н С l , H 2 S ) . Практически все неорганические кислоты хорошо растворимы в воде, кроме кремниевой ( H 2 S i O 3 ) , сероводородной ( H 2 S ) .
Получение и применение кислот
Кислоты можно получить несколькими методами.
Взаимодействие кислотного оксида с водой:
H 2 O + S O 3 → H 2 S O 4
Взаимодействие водорода и неметалла:
H 2 + C l 2 → 2 H C l
Вытеснение слабой кислоты из солей более сильной кислотой:
3 H 2 S O 4 + 2 K 3 P O 4 → 3 K 2 S O 4 + H 3 P O 4
Кислоты находят широкое применение в различных сферах. К примеру, серная используется для производства лакокрасочных материалов и минеральных удобрений. Борная является медицинским антисептиком. Уксусную и лимонную добавляют при приготовлении выпечки, а аскорбиновую применяют при лечении простудных заболеваний.
Источник
Кислоты определение классификация способы получения химические свойства
Вспомним определение кислот в свете атомно-молекулярного учения. Кислоты — это сложные вещества, состоящие из атомов водорода, способного замещаться на металл, и кислотного остатка.
Почему в определении есть уточнение: «способного замещаться на металл»? Зная состав органических кислот, нетрудно объяснить это уточнение. Например, уксусная кислота содержит только один такой атом, хотя в её составе четыре атома водорода:
Mg + 2СН3СООН –> (CH3COO)2Mg + H2↑
Mg + 2CH3COOH = 2СН3СОO – + Mg 2+ + H2↑
Дадим определение кислотам в свете теории электролитической диссоциации. Кислоты — это электролиты, которые диссоциируют с образованием катионов водорода и анионов кислотного остатка.
Газообразные аммиак и хлороводород взаимодействуют друг с другом с образованием твёрдых микроскопических частиц хлорида аммония, воспринимаемых наблюдателем как частички дыма: NH3 + НСl = NH4Cl
Этот эксперимент плохо объясняется с точки зрения теории электролитической диссоциации. Аналогичное явление наблюдается и при взаимодействии аммиака с газообразным метиламином с образованием хлорида метиламмония: CH3NH2 + НСl —> [CH3NH3]Cl
Мы подошли к рассмотрению кислот в свете протонной теории. Она получила такое название, поскольку, когда атом водорода теряет свой единственный электрон и превращается в катион водорода, остаётся ядро, состоящее из протона. Дадим определение кислотам с точки зрения протонной теории. Кислоты — это доноры катионов водорода.
Вспомним донорно-акцепторный механизм образования ковалентной связи при формировании катиона аммония:
Катионы водорода обусловливают изменение окраски индикаторов — фиолетового лакмуса и метилового оранжевого на красный, а также общие химические свойства кислот.
Химические свойства кислот.
- Органические и неорганические кислоты взаимодействуют с металлами при соблюдении определённых условий (вспомните их) с образованием соли и водорода:
2Аl + 6НСl = 2АlСl3 + 3H2↑
2Аl 0 + 6Н + = 2Аl 3+ + 3Н2
2СH3СООН +Mg —> (CH3COO)2Mg +H2↑ - Кислоты взаимодействуют с основными и амфотерными оксидами, образуя соль и воду:
CuO +H2SO4 =CuSO4 + Н2O
CuO + 2H + =Cu 2+ + Н2O
ZnO + 2CH3COOH —> (CH3COO)2Zn + Н2O
ZnO + 2CH3COOH —> 2CH3COO – +Zn 2+ + Н2O - Кислоты взаимодействуют с основаниями, образуя соль и воду:
LiOH + HNO3 = LiNO3 + Н2O
ОН – + Н + = Н2O
Fe(OH)2 + 2НСl = FeCl2 + 2Н2O
Fe(OH)2 + 2Н + = Fe 2+ + 2Н2O
Са(ОН)2 + 2СН3СООН —> (СН3СОО)2Са + 2Н2O
ОН – + СН3СООН —> СН3СОО – + Н2O
- Кислоты взаимодействуют с солями, если в результате реакции образуется осадок, газ или малодиссоциирующее вещество:
K2SiO3 + 2HNO3 =H2SiO3↓ + 2KNO3
SiO3 2– + 2Н + =H2SiO3↓
2СН3СООН +Na2CO3 —> 2CH3COONa + Н2O +CO2↑
2CH3COOH +CO3 2– —> 2CH3COO – + Н2O +CO 2
NaNO2 +HCl =NaCl +HNO2
NO2 – +H + =HNO2 - Вступая в реакции этерификации, кислоты образуют сложные эфиры:
- Окислительные свойства кислот проявляются следующим образом: катионы водорода являются окислителем в реакциях кислот с металлами, однако окислителями могут быть и анионы кислотного остатка.
Например, нитрат-анион NO3 – обладает сильными окислительными свойствами. Поэтому азотная кислота, несмотря на присутствие в растворе катионов водорода, совсем по-другому реагирует с металлами. Независимо от положения металла в электрохимическом ряду напряжений водород в таких реакциях не выделяется. Продуктами восстановления азотной кислоты могут быть оксиды азота, азот и даже аммиак (соли аммония):
Сu + 4НNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2Н2O
3Сu + 8HNO3(paзб.) = 3Cu(NO3)2 + 2NO↑ + 4Н2O
Взаимодействие концентрированной серной кислоты с металлами протекает с участием сульфат-аниона, и, как в случае с азотной кислотой, водород в таких реакциях не образуется:
Сu + 2Н2SO4(конц.) = CuSO4 + SO2↑ + 2Н2O
Окислительные свойства проявляют и органические кислоты. Например, муравьиная кислота, будучи веществом с двойственной природой — альдегидокислотой, даёт реакцию серебряного зеркала:
НСООН + Ag2O —> СO2 + Н2O + 2Ag↓
Дополнительные материалы (таблицы )
Конспект урока по химии «Неорганические и органические кислоты». В учебных целях использованы цитаты из пособия «Химия. 11 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие:
Источник