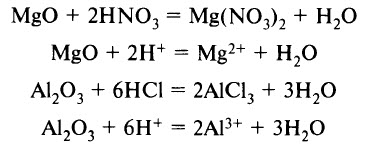- Кислоты — классификация, получение и свойства
- Классификация кислот
- Сила кислот убывает в ряду:
- Кислородосодержащие кислоты и соответствующие кислотные оксиды
- Физические свойства кислот
- Получение кислот
- Химические свойства кислот
- Виды кислот и способы их получения
- Что такое кислота — определение в химии
- Виды кислот и их классификация, какие бывают (примеры)
- По содержанию кислорода
- По растворимости в воде
- По летучести
- По силе (степени диссоциации)
- Характерные химические и физические свойства
- Химические свойства
- Физические свойства
- Получение и применение кислот
- Урок №47. Кислоты. Состав. Классификация. Номенклатура. Получение кислот
- Кислоты классификация кислот способы получения кислот
- ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
- ПОЛУЧЕНИЕ КИСЛОТ
- Дополнительные материалы (схемы, таблицы)
Кислоты — классификация, получение и свойства
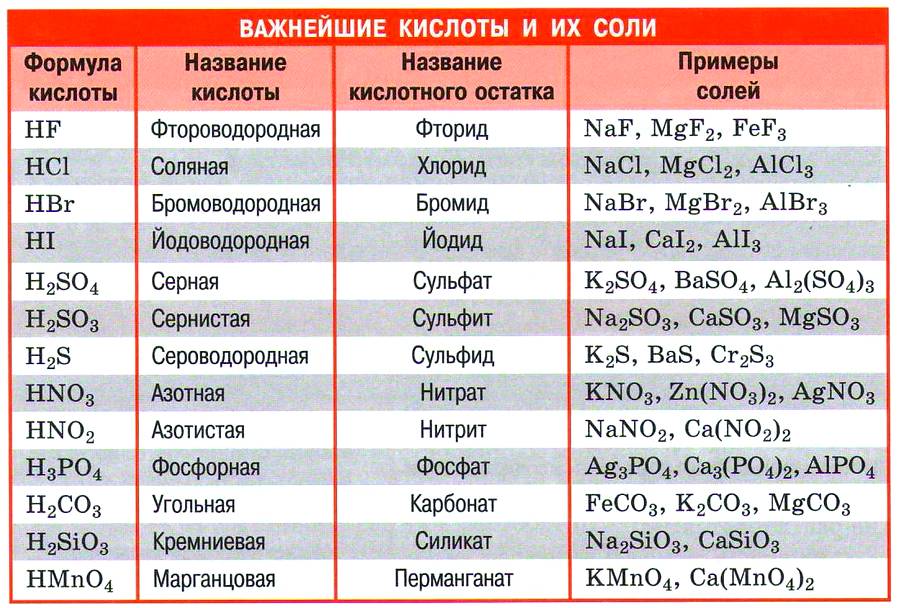
Общая формула кислот HnAc, где n – число атомов водорода, равное заряду иона кислотного остатка, Ac — кислотный остаток.
Классификация кислот
Сила кислот убывает в ряду:
Кислородосодержащие кислоты и соответствующие кислотные оксиды
Физические свойства кислот
Многие кислоты, например серная, азотная, соляная – это бесцветные жидкости. известны также твёрдые кислоты: ортофосфорная, метафосфорная HPO3, борная H3BO3. Почти все кислоты растворимы в воде. Пример нерастворимой кислоты – кремниевая H2SiO3.
Получение кислот
1) Взаимодействие простых веществ
(получают бескислородные кислоты)
H2 + Cl2 = 2HCl,
2) Взаимодействие кислотных оксидов с водой
(получают кислородсодержащие кислоты)
SO3 + H2O = H2SO4,
3) Взаимодействие солей с растворами сильных кислот
(получают слабые кислоты)
Na2SiO3 + 2HCl = H2SiO3 + 2NaCl,
4) Электролиз водных растворов солей
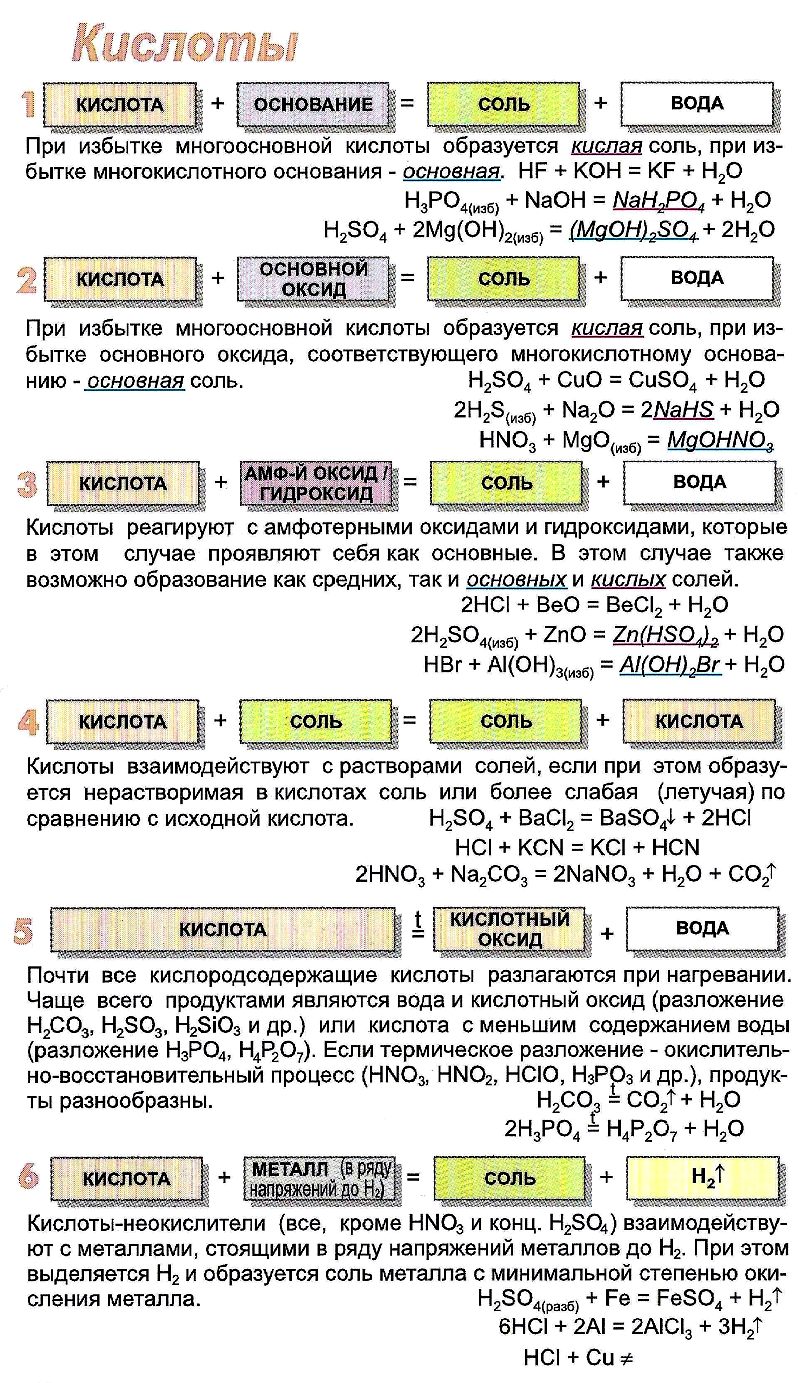
Химические свойства кислот

лакмуса в красный цвет, метилового оранжевого – в розовый, цвет фенолфталеина не изменяется.
В водном растворе растворимые кислоты диссоциируют, образуя ион водорода, и кислотный остаток:
Многоосновные кислоты диссоциируют ступенчато:
2) Взаимодействие с металлами
Водород из кислот-неокислителей могут вытеснять только металлы, стоящие в электрохимическом ряду напряжений металлов до водорода.
Кислоты-окислители — азотная и серная конц., реагируют с металлами по-другому, потому что в качестве окислителя выступает элемент кислотного остатка, а не водород!
3) Взаимодействие с основными оксидами
(если образуется растворимая соль)
4) Взаимодействие с основаниями (реакция нейтрализации)
Многоосновные кислоты образуют кислые и средние соли:
5) Взаимодействие с солями
Реакции с солями происходят только в том случае, если в результате химического превращения образуется малодиссоциирующее вещество, выделяется газ или выпадает осадок.
В этом случае выделяется углекислый газ и образуется малодиссоциирующее вещество – вода.
Реакция происходит, так как образуется осадок.
6) Специфические свойства кислот
Связаны с окислительно-восстановительными реакциями, бескислородные кислоты в растворе могут только окисляться (проявлять восстановительные свойства):
2KMn +7 O4 + 16HCl — = Cl2 0 + 2KCl + 2Mn +2 Cl2 + 8H2O,
Кислородсодержащие кислоты могут окисляться (проявлять восстановительные свойства), только когда центральный атом в них находится в промежуточной степени окисления, как, например, в сернистой кислоте:
Если центральный атом находится в максимальной степени окисления, то кислоты проявляют окислительные свойства, например, взаимодействие с металлами и неметаллами:
Источник
Виды кислот и способы их получения
В химии неорганические соединения делятся на простые и сложные вещества. Простые состоят из атомов одного химического элемента, сложные — из нескольких. Сложные неорганические вещества делятся на пять основных классов: кислоты, основания, амфотерные гидроксиды, оксиды, соли.
Разберёмся с первым классом из списка — кислотами.
Что такое кислота — определение в химии
Кислоты — это сложные вещества, которые состоят из атомов водорода и кислотных остатков.
Общая формула: H x ( A c ) — n , где
A c — кислотный остаток;
x — число атомов водорода;
n — степень окисления кислотного остатка.
В химических реакциях активный атом водорода может замещаться на атом металла, в результате чего получается соль. Кислотный остаток — это часть молекулы кислоты без атомов водорода. Валентность кислотного остатка равна числу связанных с ним атомов водорода.
Виды кислот и их классификация, какие бывают (примеры)
Существуют несколько классификаций кислот. Разберёмся с основной классификацией, созданной по формальным признакам: содержанию кислорода, растворимости и так далее.
По содержанию кислорода
Кислоты могут делиться на кислородосодержащие и бескислородные.
Кислородсодержащие получаются при воздействии воды на кислотные оксиды — ангидриды.
Их название в корне содержит название элемента, входящего в состав ангидрида. Примеры:
- H 2 S O 4 — серная (сера — ангидрид);
- H N O 3 — азотная (азот — ангидрид);
- H 3 P O 4 — фосфорная (фосфор — ангидрид).
Номенклатура выглядит следующим образом. В случае, если элементу соответствуют несколько кислот, для названия кислоты с большей валентностью такого элемента употребляют суффикс «Н» или «В». Для кислот с меньшей валентностью элемента в названиях добавляют еще один суффикс «ИСТ». Например, серная ( H 2 S O 4 ) и сернистая кислота ( H 2 S O 3 ).
Бескислородные представляют собой растворы некоторых газов в воде. Названия бескислородных кислот составляют по принципу: элемент + водородная кислота.
- H2S — сероводородная;
- НСl — хлороводородная (соляная);
- НF — фтороводородная (плавиковая).
Важно, что газ и раствор газа имеют различные свойства. Например, хлороводород и соляная кислота.
Газ хлороводород можно получить из водорода и хлора. Уравнение:
H 2 + C l 2 → 2 H C l
В сухом состоянии такой газ не проявляет кислотных свойств. При перевозке в тех же металлических ёмкостях не происходит никаких реакций. Но, если хлороводород растворить в воде, получается раствор, который называют соляной кислотой. Она обладает сильными кислотными свойствами и опасна при реагировании с металлом.
По растворимости в воде
Кислоты делят на растворимые и нерастворимые. Большинство кислот растворимы. Нерастворимые — кремниевая H 2 S i O 3 и все органические карбоновые кислоты, содержащие десять атомов углерода и больше.
По летучести
Летучие кислоты — это химические соединения, которые быстро испаряются при нормальных условиях, то есть молекулы легко переходят в газовую фазу. В их список входят, к примеру, органические соединения, которые образуются в человеческом организме в результате процесса пищеварения, болезней или метаболизма.
Список летучих кислот:
- H N O 3 — азотная;
- H C l — хлороводородная;
- H B r — бромоводородная;
- H F — фтороводородная;
- H I — иодоводородная;
- H 2 S — сероводородная;
- H 2 S e — селеноводородная.
Нелетучими являются все остальные. Они стабильны в водных растворах.
По силе (степени диссоциации)
Кислоты также можно разделить на сильные и слабые. Если в водном растворе кислота полностью распадается на ионы (диссоциирует), то она является сильной. Слабые кислоты не распадаются на ионы полностью, обычно их диссоциация протекает в незначительной степени.
Как определить силу кислоты, то есть степень диссоциации? Можно использовать лёгкий приём: вычесть из числа атомов O число атомов H. Если в ответе получается число меньше 2 — слабая. Больше или равно — сильная.
- H 2 SO 4 = 4 — 2 = 2 — сильная;
- H 3 P O 4 = 4 — 3 = 1 — слабая.
Степень диссициации можно также установить экспериментальным путем посредством измерения проводимости растворов. Разбавленные растворы сильных кислот хорошо проводят электрический ток, растворы слабых кислот — плохо.
Характерные химические и физические свойства
Химические свойства
Взаимодействие с основными оксидами. Образуются соль и вода:
C a O + 2 H C l → C a C l 2 + H 2 O
Взаимодействие с амфотерными оксидами. Образуются соль и вода:
Z n O + 2 H N O 3 → Z n ( N O 3 ) 2 + H 2 O
Взаимодействие со щелочами. Образуются соль и вода (реакция нейтрализации):
N a O H + H C l → N a C l + H 2 O
Взаимодействие с солями. Реакция протекает, если выпадает осадок или выделяется газ:
B a C l 2 + H 2 S O 4 → B a S O 4 ↓ + H C l ↑
Сильные кислоты вытесняют более слабые из их солей:
K 3 P O 4 + 3 H C l → 3 K C l + H 3 P O 4
Также металлы, стоящие в ряду активности до водорода, вытесняют его из раствора кислоты (если соль, которая образуется в итоге, растворима):
M g + 2 H C l → M g C l 2 + H 2 ↑
Однако! С азотной и концентрированной серной кислотами реакция идёт иначе:
M g + 2 H 2 S O 4 → M g S O 4 + S O 2 ↑ + 2 H 2
Физические свойства
При нормальных условиях большинство неорганических кислот существуют в жидком состоянии, некоторые являются твердыми веществами ( H 3 P O 4 , H 2 S i O 3 ) . Большинство бескислородных кислот в безводном состоянии являются газами ( Н С l , H 2 S ) . Практически все неорганические кислоты хорошо растворимы в воде, кроме кремниевой ( H 2 S i O 3 ) , сероводородной ( H 2 S ) .
Получение и применение кислот
Кислоты можно получить несколькими методами.
Взаимодействие кислотного оксида с водой:
H 2 O + S O 3 → H 2 S O 4
Взаимодействие водорода и неметалла:
H 2 + C l 2 → 2 H C l
Вытеснение слабой кислоты из солей более сильной кислотой:
3 H 2 S O 4 + 2 K 3 P O 4 → 3 K 2 S O 4 + H 3 P O 4
Кислоты находят широкое применение в различных сферах. К примеру, серная используется для производства лакокрасочных материалов и минеральных удобрений. Борная является медицинским антисептиком. Уксусную и лимонную добавляют при приготовлении выпечки, а аскорбиновую применяют при лечении простудных заболеваний.
Источник
Урок №47. Кислоты. Состав. Классификация. Номенклатура. Получение кислот
Кислоты — сложные вещества, состоящие из одного или нескольких атомов водорода, способных замещаться на атома металлов, и кислотных остатков.
Классификация кислот
1. По числу атомов водорода: число атомов водорода (n) определяет основность кислот:
n = 1 одноосновная
n = 2 двухосновная
n = 3 трехосновная
2. По составу:
а) Таблица кислородсодержащих кислот, кислотных остатков и соответствующих кислотных оксидов:
Кислотный остаток (А)
Соответствующий кислотный оксид
SO 3 оксид серы ( VI )
HMnO 4 марганцевая
MnO 4 (I) перманганат
Mn 2 O 7 оксид марганца ( VII )
SO 2 оксид серы ( IV )
PO 4 (III) ортофосфат
P 2 O 5 оксид фосфора ( V )
N 2 O 3 оксид азота ( III )
CO 2 оксид углерода ( IV )
SiO 2 оксид кремния (IV)
СlO (I) гипохлорит
С l 2 O оксид хлора ( I)
НСlO 2 хлористая
С l 2 O 3 оксид хлора ( III)
НСlO 3 хлорноватая
С l 2 O 5 оксид хлора ( V)
СlO 4 (I) перхлорат
С l 2 O 7 оксид хлора ( VII)
» jsaction=»rcuQ6b:WYd;»>
б) Таблица бескислородных кислот
Кислотный остаток (А)
HCl соляная, хлороводородная
H 2 S сероводородная
» jsaction=»rcuQ6b:WYd;»>
Физические свойства кислот
Многие кислоты, например серная, азотная, соляная – это бесцветные жидкости. известны также твёрдые кислоты: ортофосфорная, метафосфорная HPO 3 , борная H 3 BO 3 . Почти все кислоты растворимы в воде. Пример нерастворимой кислоты – кремниевая H 2 SiO 3 . Растворы кислот имеют кислый вкус. Так, например, многим плодам придают кислый вкус содержащиеся в них кислоты. Отсюда названия кислот: лимонная, яблочная и т.д.
Способы получения кислот
HCl, HBr, HI, HF, H 2 S
1. Прямое взаимодействие неметаллов
1. Кислотный оксид + вода = кислота
2. Реакция обмена между солью и менее летучей кислотой
2 NaCl ( тв .) + H 2 SO 4 ( конц .) = Na 2 SO 4 + 2HCl
Источник
Кислоты классификация кислот способы получения кислот
Кислоты – это электролиты, в результате диссоциации которых в водных растворах образуется только один вид катионов – катионы водорода Н + (точнее – катионы гидроксония H3O + ):
НCl = Н + + Cl – (НCl + H2O = H3O + + Cl – )
HNO3 = Н + + NO3 – (HNO3 + H2O = H3O + + NO3 – )
Кислоты – вещества молекулярного строения. Атомы в молекулах кислот связаны ковалентными полярными химическими связями. Чем более поляризована связь между атомом водорода, способным отщепляться в виде катиона водорода, и атомом какого–либо другого элемента, тем легче происходит её распад с образованием ионов, тем сильнее кислота.
Классифицировать кислоты можно по разным признакам.
- По содержанию кислорода кислоты могут быть бескислородными (например, НCl, НВг, HI, H2S, HCN) и кислородсодержащими (например, H2SO4, HNO3, H3PO4).
- По числу атомов водорода в молекуле кислоты, способных замещаться атомами металлов (по основности), кислоты могут быть одноосновными (НCl, НВг, HI, HNO3), двухосновными (H2SO4, H2SO3, H2СО3, H2S), трёхосновными (H3PO4, H3AsO4) и т. д. Существуют и кислоты большей основности, например пирофосфорная Н4Р2O7 – четырёхосновная.
- По степени диссоциации кислоты могут быть сильными (НCl, НВг, HI, HNO3, H2SO4) и слабыми (H2S, H2SiO3, H2CO3, СH3СООН).
- По растворимости кислоты могут быть растворимыми в воде (H2SO4, HNO3, НCl, СH3СООН) и нерастворимыми в воде (H2SiO3, C17H35СООН).
- По стабильности кислоты могут быть стабильными (H2SO4, НCl, H3РO4) и нестабильными (H2CO3, H2SO3, HNO2). Нестабильные кислоты, как правило, невозможно выделить в свободном состоянии, они существуют только в растворах.
- По летучести кислоты могут быть летучими (НCl, HNO3, СH3СООН) и нелетучими (H2SO4, H3PO4, H2SiO3).
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
- Кислоты реагируют с металлами. Металлы, расположенные в электрохимическом ряду напряжений металлов до водорода H2, вытесняют водород из растворов кислот. Происходит реакция замещения, образуется соль и водород:
Металлы, расположенные в ряду напряжений после водорода, с кислотами не реагируют.
Важное примечание: с серной концентрированной кислотой и с азотной кислотой любой концентрации реакции идут за счёт аниона кислотного остатка, водород в этих случаях не выделяется:
Cu+ 4HNO3 (конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
Cu+ 2H2SO4 (конц.) = CuSO4 + SO2↑ + 2H2O
- Киcлоты реагируют с основными и амфотерными оксидами с образованием соли и воды:
- Кислoты реагируют с основаниями и с амфотерными гидроксидами с образованием соли и воды:
(Взаимодействие сильных кислот с сильными основаниями – реакция нейтрализации.)
Al(ОН)3 + 3НCl = AlCl3 + 3H2O
Al(ОН)3 + 3Н + = Al 3+ + 3H2O
(Реакция амфотерного гидроксида с сильной кислотой.)
- Сильные кислоты реагируют с солями слабых кислот. Слабые кислоты при этом могут быть вытеснены из солей. Например, сильная соляная кислота НCl вытесняет слабую сероводородную кислоту H2S:
FeS + 2НCl = FeCl2 + H2S↑
FeS + 2Н + = H2S↑ + Fe 2+
Нелетучие кислоты могут вытеснить летучую из её соли. Например, нелетучая серная кислота H2SO4 вытесняет более летучую азотную HNO3. Обе кислоты – сильные. В растворе такая реакция не происходит. Она осуществима, если соль находится в кристаллическом виде (не в растворе), а серная кислота концентрированная:
Аналогично можно получить газообразный хлороводород, раствор которого – соляная кислота.
- Кислoты можно обнаружить индикаторами. Индикаторы реагируют на наличие в растворе ионов Н + (H3O + ). Лакмус в кислой среде приобретает красный цвет, метиловый оранжевый – красный, фенолфталеин – бесцветный. Для обнаружения кислот удобно использовать лакмус.
ПОЛУЧЕНИЕ КИСЛОТ
Бескислородные кислоты, состоящие из двух элементов, могут быть получены синтезом простых веществ:
Кислородсодержащие кислоты могут быть получены в результате взаимодействия с водой соответствующих кислотных оксидов:
Р2O5 + 3H2O = 2H3РO4
SO3 + H2O = H2SO4
Слабые или летучие киcлoты могут быть вытеснены из солей более сильными или менее летучими кислотами. Например, сильная соляная кислота НCl вытесняет слабую уксусную кислоту СH3СООН:
CH3COONa + НCl = СH3СООН + NaCl
СH3СОО – + Н + = СH3СООН
Летучие киcлoты могут быть вытеснены из солей менее летучими кислотами. Например, нелетучая серная кислота H2SO4 может вытеснить более летучую соляную НCl. Но в растворе такая реакция не пойдёт (обе киcлoты сильные). Она осуществима, если соль в кристаллическом состоянии (не в растворе) обработать серной концентрированной кислотой:
В результате этой реакции образуется газообразный хлороводород, при растворении которого в воде образуется соляная кислота.
Для получения слабых нелетучих кислот (например, ортофосфорной киcлоты или сернистой кислoты) лучше воспользоваться концентрированной серной кислотой, причём образующаяся сернистая кислота H2SO3 разлагается на сернистый газ SO2 и воду:
Са3(РO4)2 (тв.) + 3H2SO4 (конц.) = 3CaSO4 + 2H3РO4
Na2SO3 (тв.) + H2SO4 (конц.) = Na2SO4 + SO2↑ + H2O
Дополнительные материалы (схемы, таблицы)
Конспект урока по химии в 8 классе «Кислоты: классификация, свойства, получение». Выберите дальнейшее действие:
- Вернуться к Списку конспектов по химии
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
- Смотреть конспект по химии в 11 классе «Неорганические и органические кислоты«
Источник