II. Гидрометаллургический способ получения металлов.
Общие способы получения металлов.
Способы получения металлов обычно разделяют на:
- пирометаллургические (восстановление при высоких температурах);
- гидрометаллургические (восстановление из солей в растворах);
- электрометаллургические (электролиз раствора или расплава);
- биометаллургические.
I. Пирометаллургический способ получения металлов.
1. Карботермический способ получения металлов − восстановление металлов из оксидов углем или угарным газом
MеxOy + C = CO + Me,
2. Обжиг сульфидов с последующим восстановлением(если металл находится в руде в виде соли или основания, то последние предварительно переводят в оксид)
3. Металлотермический способ (способ получения металлов, в котором в качестве восстановителя применяют металлы)
В этом способе в качестве восстановителя используют активные металлы. Примеры металлотермических реакций:
А) Алюмотермия (в тех случаях, когда нельзя восстановить углём или угарным газом из-за образования карбида или гидрида)
3BaO + 2Al = 3Ba + Al2O3 (получают барий высокой чистоты)
Б) Магниетермия:
MеxOy + Mg = MgO + Me
Металлотермические опыты получения металлов впервые осуществил русский ученый Н. Н. Бекетов в XIX в.
4. Водородотермия −для получения металлов особой чистоты
II. Гидрометаллургический способ получения металлов.
Гидрометаллургический способ основан на растворении природного соединения с целью получения раствора соли этого металла и вытеснением данного металла более активным. Например, руда содержит оксид меди и ее растворяют в серной кислоте:
затем проводят реакцию замещения:
Таким способом получают серебро, цинк, молибден, золото, ванадий.
Если для восстановления требуется оксид металла, то в процессе переработки сначала получают оксид:
а) из сульфида – обжигом в кислороде:
б) из карбоната – разложением при нагревании:
СаСО3 = СаО + СО2
III. Электрометаллургический способ получения металлов − восстановление металлов электрическим током (электролиз).
1. Щелочные и щелочноземельные металлы получают в промышленности электролизом расплавов солей (чаще всего хлоридов):
2NaCl – расплав, электр. ток → 2Na + Cl2↑
CaCl2 – расплав, электр. ток. → Ca + Cl2↑
4NaOH – расплав, электр. ток. → 4Na + O2↑ + 2H2O (. используют изредка для Na)
2. Алюминий в промышленности получают в результате электролиза расплава оксида алюминия в криолите Na3AlF6 (из бокситов):
2Al2O3 – расплав в криолите, электр. ток. → 4Al + 3O2↑
3. Электролиз водных растворов солей используют для получения металлов средней активности и неактивных:
Металлы в природе.
Металлы в природе встречаются в трёх формах.
1) В свободном виде встречаются золото и платина; золото бывает в распыленном состоянии, а иногда собирается в большие массы самородки. Так в Австралии в 1869 году нашли глыбу золота в сто килограммов весом. Через три года обнаружили там же еще большую глыбу весом около двухсот пятидесяти килограммов. Наши русские самородки много меньше, и самый знаменитый, найденный в 1837 году на Южном Урале, весил всего около тридцати шести килограммов. В середине XVII века в Колумбии испанцы, промывая золото, находили вместе с ним тяжелый серебристый металл. Этот металл казался таким же тяжелым, как и золото, и его нельзя было отделить от золота промывкою. Хотя он и напоминал серебро, но был почти нерастворим и упорно не поддавался выплавке; его считали случайной вредной примесью или преднамеренной подделкой драгоценного золота. Поэтому испанское правительство приказывало в начале XVIII столетия выбрасывать этот вредный металл при свидетелях обратно в реку. Месторождения платины находятся и на Урале. Оно представляет собой массив дунита (изверженная горная порода, состоящая из силикатов железа и магния с примесью железняка). В нем содержатся включения самородной платины в виде зерен. В самородном виде и в форме соединений могут находиться в природе серебро, медь, ртуть и олово.
2) Все металлы. Металлы средней и малой активности, которые в ряду напряжений находятся до олова, в природных условиях встречаются только в виде соединений − образуют оксиды и сульфиды. Реже их можно встретить в составе сложных кислотно-металлических соединений.
3) Химически активные элементы встречаются либо в виде простых солей, либо в виде полиэлементных соединений, которые имеют очень сложное химическое строение, но в основном достаточно просто разлагаются на составляющие при определенном воздействии.
Чаще всего металлы в природе встречаются в виде солей неорганических кислот:
хлоридов сильвинит КСl • NaCl, каменная соль NaCl;
нитратов – чилийская селитра NaNO3;
карбонатов – мел, мрамор, известняк СаСО3, магнезит MgCO3, доломит CaCO3•MgCO3;
сульфидов серный колчедан FeS2, киноварь HgS, цинковая обманка ZnS;
оксидов – магнитный железняк Fe3O4, красный железняк Fe2O3, бурый железняк, содержащий различные гидроксиды железа (III) Fe2O3•Н2О.
Ещё в середине II тысячелетия до н. э. в Египте было освоено получение железа из железных руд. Это положило начало железному веку в истории человечества, который пришёл на смену каменному и бронзовому векам. На территории нашей страны начало железного века относят к рубежу II и I тысячелетий до н. э.
Минералы и горные породы, содержащие металлы и их соединения и пригодные для промышленного получения металлов, называются рудами.
Отрасль промышленности, которая занимается получением металлов из руд, называется металлургией. Так же называется и наука о промышленных способах получения металлов из руд.
Металлургию подразделяют на черную (производство железа и его сплавов) и цветную (производство остальных металлов).
Большинство металлов встречаются в природе в составе соединений, в которых металлы находятся в положительной степени окисления, значит для того, чтобы их получить, в виде простого вещества, необходимо провести процесс восстановления.
Но прежде чем восстановить природное соединение металла, необходимо перевести его в форму, доступную для переработки, например, оксидную форму с последующим восстановлением металла.
3. Промышленные способы получения металлов.
При разработке технологии получения химических веществ используются законы термодинамики, кинетики, теплотехники, физико-химического анализа и др. Учитываются, естественно, и экономические условия. В случае, если реакция обратима, применяется принцип Ле Шателье:
Если на систему, находящуюся в равновесии, воздействовать извне, то равновесие в системе сместится в сторону той реакции (прямой или обратной), которая приводит к частичной компенсации этого воздействия.
Химические методы применяются и при очистке выбросов, а также сточных вод химических производств.
Существует несколько способов получения металлов в промышленности. Их применение зависит от химической активности получаемого элемента и используемого сырья. Некоторые металлы встречаются в природе в чистом виде, другие же требуют сложных технологических процедур для их выделения. Добыча одних элементов занимает несколько часов, другие же требуют многолетней обработки в особых условиях. Общие способы получения металлов можно разделить на следующие категории: восстановление, обжиг, электролиз, разложение.
Есть также специальные методы получения редчайших элементов, которые подразумевают создание специальных условий в среде обработки. Сюда может входить ионная декристаллизация структурной решетки или же наоборот, проведение контролируемого процесса поликристаллизации, которые позволяют получать определенный изотоп, радиоактивное облучение и другие нестандартные процедуры воздействия. Они используются довольно редко ввиду высокой дороговизны и отсутствия практического применения выделенных элементов. Поэтому остановимся подробнее на основных промышленных способах получения металлов. Они довольно разнообразны, но все основаны на использовании химических или физических свойств определенных веществ.
Дата добавления: 2017-06-02 ; просмотров: 9856 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Источник
Лекция № 20. Карботермическое восстановление металлов
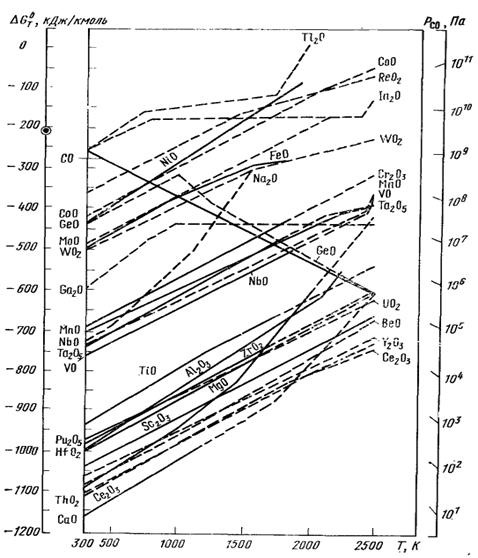
1. Прогнозирование карботермического восстановления металлов по диаграмме ∆G = f (T)
2. Восстановление в жидкой фазе.
3. Восстановление в газовой фазе.
Сродство углерода к кислороду при повышении температуры возрастает, поэтому плазменные процессы позволяют восстанавливать по существу — все металлы из их окислов. На рис. 57, где приведена зависимость ∆G 0 T — Т при восстановлении окислов углеродом, показаны температуры, при которых можно восстанавливать отдельные окислы. Значения, приведенные на диаграмме ∆G 0 T — Т или рассчитанные по закону Гесса, справедливы при условии, что исходные продукты берутся в стехиометрическом молярном соотношении и стандартном состоянии. Величина ∆G 0 T связана с константой равновесия выражением (64). Это выражение дает возможность при известном значении ∆G 0 T определить равновесное состояние реакции при данной температуре, так как константа равновесия К зависит от равновесного состояния:
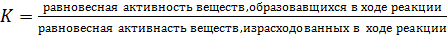
Для карботермической реакции
МeO + С → ← Ме+СО (125)
где а — активность компонента.
Активность чистых веществ в твердом состоянии равна 1, а активность газообразной окиси углерода можно ввести в виде парциального давления. Тогда для карботермической реакции справедливо
где K =pCO — парциальное давление окиси углерода.
где ∆GT, Дж/моль, а — температура Т, К.
Рисунок 57. Температурная зависимость ∆G 0 T при восстановлении
Уравнения показывают, что в соответствии со значением ∆GT реакция будет протекать вплоть до достижения равновесного парциального давления окиси углерода. Равновесное состояние можно сместить посредством изменения температуры (поскольку от нее зависит величина ∆G) или путем изменения равновесной активности реагентов. Эта альтернатива подходит в том случае, если в реакции участвуют не твердые или жидкие вещества в чистом виде, а смеси, или если изменены стехиометрически равновесные соотношения соответствующих газов.
Удаление восстановительной атмосферы может привести к полному протеканию заданной карботермической реакции; для полного протекания реакции необходимо, чтобы давление окиси углерода в газовой фазе было ниже равновесного. С помощью номограммы необходимое для протекания реакции парциальное давление окиси углерода можно определить следующим образом: соединив основную точку СО в левой части диаграммы на рис. 57 с точкой, соответствующей данной температуре на линии изменения ∆Gt восстанавливаемого окисла, получим линию, соответствующую равновесном парциальному давлению окиси углерода. Тогда точка пересечения линии рCO со шкалой в правой части диаграммы дает величину равновесного парциального давления окиси углерода для восстановления окисла при данной температуре.
В плазменной металлургии можно использовать вакуум до 10 -2 Па. Низкие давления можно использовать для достижения очень быстрого и по существу полного восстановления окислов металлов.
При одном из опубликованных способов карботермического восстановления с применением низкотемпературной плазмы, разработанных фирмой Vitro, исходят из установленного факта, что дугу высокой напряженности можно сохранить и без выпаривания всего материала анода. Путем регулирования тока в дуге можно поддерживать температуру на уровне непосредственно ниже температуры кипения пленки расплавленного металла, карбида или другого продукта реакции, который образуется на поверхности оплавляющегося электрода, состоящего из углерода и восстановимого соединения. При таких условиях расплавляемый металл равномерно стекает в виде шаровидных капель, которые затвердевают прежде, чем упадут на дно камеры плазменного реактора. Из этой расплавленной пленки можно удалить летучие примеси еще лучше, чем в обычной вакуумной лечи. Если уменьшить давление Пламени и — направить его вниз, чтобы оно попадало на поверхность расплавленного металла, то теоретически возможно обеспечить конденсацию паров металла с образованием капель, которые бы сразу сливались с поверхностью жидкой ванны металла. Окись углерода можно было бы отводить в другом направлении, а потом откачивать из рабочего пространства печи. Второй проект, который является по существу модификацией указанного способа, заключается о погружении столба плазменной дуги и плазменного пламени в ванну с расплавом соли либо в слой шлака, плавающий на поверхности металла.
Карботермическое восстановление в газовой фазе. Углерод является наиболее дешевым, доступным и широко употребляемым восстановителем. Путем введения углерода в плазменное пламя можно предотвратить вторичное окисление металла. В истории металлургии переработка обычных металлсодержащих руд осуществлялась путем восстановления окислов металлов углеродом при довольно высоких температурах. При этом температуру выбирали столь высокой, чтобы преимущественная часть примесей могла перейти в жидкий шлак.
Однако существует ряд полезных металлов, окислы которых нельзя обрабатывать с помощью обычных пирометаллургических процессов. Окислы алюминия, магния, бериллия, бора, кремния, марганца, титана, циркония и ряда более редких металлов требуют для карботермического восстановления таких температур, которые на обычных пирометаллургических установках недостижимы. Однако плазматроны не имеют таких температурных ограничений, поэтому они способны восстанавливать любой из этих металлов, причем в ходе последующего регулируемого охлаждения потока паров кислород больше склонен к образованию окиси углерода, чем окислов указанных металлов.
Уже доказано, что плазменное пламя, полученное с помощью электрической дуги высокой напряженности, питаемой через сгорающий электрод, который представляет собой стехиометрическую смесь окисла металла и углерода, действительно состоит из паров металла и окиси углерода. Отсутствие определимых количеств паров окислов металлов в пламени было подтверждено спектроскопическим исследованием при проведении опытных плазменных плавок для получения алюминия, магния, бериллия,
Основной принцип этой технологии почти такой же, как и процесса Хансгирг, испытания которого без особого успеха были проведены в Калифорнии во время второй мировой войны. Фирме Vitro удалось извлечь 40— 70% содержащегося металла в чистом виде такими простыми средствами, как направление плазменного пламени на водоохлаждаемую плиту или инжектирование холодного газообразного водорода. Хотя эти результаты и лучше результатов, опубликованных после испытания процесса Хансгирг, достигаемый выход годного является неудовлетворительным. Теоретически степень извлечения можно было бы повысить путем эффективного резкого охлаждения, однако о кинетике охлаждения этих систем известно еще настолько мало, что, пока не будет достаточное количество экспериментальных данных, нельзя разработать надежную гипотезу. Несомненно, что сравнительно длинное и узкое плазменное пламя, обладающее высокой скоростью истечения, обеспечиваемой на плазменных установках, создает гораздо более выгодные условия для быстрого охлаждения; кроме того, в каждый данный момент в процессе участвует лишь очень малое количество материала, благодаря чему, очевидно, устраняется опасность ‘взрыва, что сильно затрудняло работу при испытаниях процесса Хансгирг.
В ряде лабораторий уже используются плазматроны для получения карбидов металлов и некоторых иных соединений, для которых мало вероятна реакция с окисью углерода, «как это наблюдается в случае активных металлов. Ведутся работы над процессами, которые позволят получать чистые металлы, однако эту задачу выполнить не так легко. Так, например, предлагается улавливать металл, образующийся в результате карботермического восстановления в расплаве совместно с окисью углерода, в вихревом следе дуги. Фирма Vitro вела работы над вариантом этого процесса, три «котором с помощью углерода селективно восстанавливали силикатные руды в жидкой фазе. Проведенные термодинамические расчеты (которые три этих сравнительно (низких температурах являются более надежными, чем при температурах обычного плазменного пламени) показали, что родонит, например, можно перерабатывать таким образом, чтобы пламя в вихревом следе дуги состояло из газообразного марганца и окиси углерода, а не путем полного выпаривания родонита, как это осуществлялось до сих тор в лабораторных и полупромышленных опытах. При этом расплавляемая двуокись кремния вместе с небольшими примесями щелочных металлов стекала бы в виде жидкого шлака с пренебрежимо малым давлением ларов. Этот способ имеет серьезные преимущества по сравнению с первоначальной технологией разделения этой породы, но не приближает к решению проблемы получения чистого марганца из образующихся паров марганца.
Контрольные вопросы
1. Основные принципы карботермического восстановления металлов в жидкой и газовой фазах.
2. Получение карбидов урана углетермическим восстановлением.
Литература
1. Дембовский В. Плазменная металлургия.- М.: Металлургия. 1981. -280с.
2. Краснов А.Н., Шаривкер С.Ю., Зильберберг В.Г. Низкотемпературная плазма в металлургии. М., «Металлургия», 1970. – 242с.
Источник