Применение карбоновых кислот
В первой статье рассказывалось о классификации, свойствах, группах карбоновых кислот. Сегодня речь пойдет о том, где, в основном, применяются карбоновые кислоты.
- В химпроме — сырье для органического синтеза.
Используются в производстве мыл, моющих средств, сложных эфиров, смазочных масел, эмульгаторов, инсектицидов, катализаторов, растворителей, пластификаторов, лаков, смол и клеев, гликолей, пластиков, реактивов для флотации, ПАВ и многих других нужных для промышленности и быта веществ.
- В пищепроме — в качестве консервантов, стабилизаторов, антиоксидантов, ароматизаторов.
- В фармацевтике используются для синтеза лекарственных препаратов и дезинфицирующих средств.
- В косметической индустрии — для получения ароматических веществ, парфюмов, изготовления кремов и мазей.
- В металлургии, текстильной отрасли, кожевенном и бумажном производстве, сельском хозяйстве, в аналитической химии.
В магазине «ПраймКемикалсГрупп» можно купить многие карбоновые кислоты, и мы регулярно пополняем ими наш ассортимент. Расскажем подробнее о применении самых популярных, имеющихся у нас, карбоновых кислот.
Муравьиная кислота — одноосновная предельная карбоновая кислота, бесцветная жидкость с резким запахом. Применяется в медицине в качестве антисептика. Пищевая добавка E236, консервант при заготовке кормов в сельском хозяйстве. Используется в качестве растворителя, для уничтожения паразитов в пчеловодстве, реактив для протравы в текстильной индустрии.
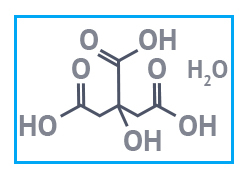 | 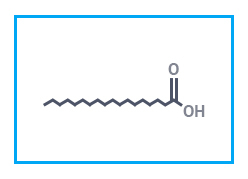 | 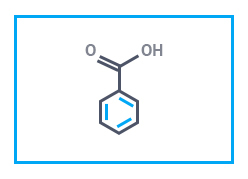 |
| Лимонная кислота | Стеариновая кислота | Бензойная кислота |
Лимонная кислота — многоосновная (трехосновная) карбоновая кислота. Твердое вещество с бесцветными кристаллами. Хорошо растворяется в воде. Считается слабой кислотой. Востребована в пищепроме как регулятор кислотности, вкусовая добавка, консервант (Е330). Используется в медицине, производстве косметических продуктов и препаратов бытовой химии; для травления печатных плат. В нефте- и газодобыче входит в состав буровых растворов; в строительстве ее добавляют в цементные и гипсовые смеси для замедления схватывания.
Стеариновая кислота — высшая одноосновная алифатическая кислота. Белые, нерастворимые в воде кристаллы. Широко используется для производства мыл, синтетических ПАВ, резины, густых смазок, клеящих паст; эфиров для пищепрома (стабилизаторы, антиоксиданты); входит в состав свечей, косметических продуктов. Применяется в текстильном и кожевенном производстве.
Бензойная кислота — одноосновная ароматическая кислота. Твердое кристаллическое вещество без цвета. Сильное антисептическое средство в пищепроме (добавка Е210) и медицине; сырье в органических синтезах для получения фенола, бензоилхлорида, пластификаторов (гликолей). Применяется в парфюмерии. В химпроме используется для изготовления красителей.
Салициловая кислота — двухосновная ароматическая кислота. Бесцветное твердое вещество, плохо растворяется в воде. Проявляет слабые кислотные свойства, а также свойства фенола. Используется в качестве антисептика в медицине, при производстве фармпрепаратов (наружных мазей и растворов, аспирина, противотуберкулезных средств и др.). Востребована в пищепроме как консервант. Применяется в орг. синтезе для изготовления красителей и ароматических веществ; реактив в колориметрии.
Щавелевая кислота — двухосновная предельная кислота. 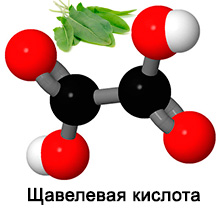
Источник
Карбоновые кислоты. Свойства и применение карбоновых кислот
Все началось с уксуса, по крайней мере, открытие карбоновых кислот. Название объединяет органические соединения, содержащие карбоксильную группу COOH.
Важно расположение атомов именно в таком порядке, поскольку есть и другие кислородосодержащие соединения.
Уксусную кислоту из карбоновых открыли первой, но ее строение многие века оставалось тайной. Вещество знали, как продукт скисания вин.
Как соединение 2-ух атомов углерода , 4-ех водорода и 2-ух кислорода кислота стала известна миру лишь в 18-ом столетии.
После, открыли целый ряд карбоновых кислот . Ознакомимся с их классификацией, общими свойствами и областями применения.
Свойства карбоновых кислот
Отличаясь от другой органики наличием карбоксильных групп, карбоновые кислоты классифицируются по их числу.
Есть одно-, двух-, и многоосновные соединения. Одноосновные карбоновые кислоты выделяются связью между карбоксильной группой и углеводородным радикалом.
Соответственно, общая формула веществ группы: — CnH2n+1COOH. Уксусная кислота – одноосновная. Ее химическая запись: — CH3COOH. Еще проще строение муравьиного соединения: — COCOOH.
К простейшим отнесена и пропионовая кислота с формулой C2H5COOH. У остальных соединений одноосновного ряда есть изомеры, то есть, разные варианты строения.
У муравьиной же, уксусной и пропионовой кислот есть лишь один план строения.
Если у карбоновой кислоты формула с двумя карбоксильными группами, она может называться диосновной.
Общая запись веществ категории: — COOH-R-COOH. Как видно, карбоксильные группы располагаются по разные стороны линейной молекулы.
В многоосновных кислотах карбоксильных радикалов, как минимум три. Два стоят по краям молекулы, а остальные крепятся к центральным атомам углерода. Такова, к примеру, лимонная кислота . Пространственная запись ее формулы: —
Подразделяют карбоновые соединения и по характеру углеводородного радикала. Химические связи между его атомами могут быть одинарными.
В этом случае перед нами предельные карбоновые кислоты. Наличие двойных связей указывает на непредельные вещества.
Формула непредельных карбоновых кислот может одновременно являться записью высших представителей класса.
Высшими называют соединения, в которых боле 6-ти атомов углерода. Соответственно, от 1-го до 5-ти атомов углерода – признак низших веществ.
Высшие карбоновые кислоты – это, к примеру, стеариновая , линолевая , линоленовая, пальмитиновая и арихидоновая. В полследней 21 атом углерода, в остальных по 18.
Имея органическое происхождение, большинство карбоновых кислот пахнут, хотя бы слегка. Однако, есть группа особенно ароматных.
В их состав входит бензольное ядро. То есть, кислоты группы являются производными бензола. Его формула: — C6H6.
У вещества сладковатый запах. Поэтому, карбоновые кислоты с бензольным ядром именуют ароматическими. Причем, обязательна прямая связь ядра и карбоксильных групп.
По физическому состоянию карбоновые кислоты бывают, как жидкими, так кристаллическими. Имеется в виду агрегатность веществ при обычных условиях.
Часть соединений растворима в воде, другая часть смешивается лишь с органикой. Нюансы химического поведения зависят от количества в молекулах карбоксильных групп.
Так, типичная реакция карбоновых кислот одноосновной категории– окрашивание лакмусовой бумаги в красный цвет.
Классикой, так же, считается взаимодействие с галогенами, тогда как дикарбоновые соединения могут образовывать эфиры карбоновых кислот. Они «рождаются» во взаимодействии со спиртами.
Карбоновая кислота с двумя основаниями всегда содержит метиленовую группу, то есть, двухвалентную CH2.
Ее наличие между карбоксильными группами повышает кислотность атомов водорода. Поэтому, возможна конденсация производных кислот . Это еще одно объяснение появления эфиров.
Двухосновные соединения образуют, так же, соли карбоновых кислот. Они используются на производстве моющих средств, в частности, мыла.
Впрочем, о том, где пригождаются карбоновые кислоты и их соединения, поговорим отдельно.
Применение карбоновых кислот
В производстве мыла особенно важны стеариновая и пальмитиновая кислоты. То есть, используются высшие соединения.
Они делают мыльные брикеты твердыми и позволяют смешать фракции, расслаивающие без присутствия кислот.
Способность делать массы однородными пригождается и на производстве лекарств. Большинство связующих элементов в них – карбоновые кислоты.
Содержат их и живые организмы. Все соединения класса биогенны. Это значит, что карбоновые кислоты вырабатываются растениями и тканями животных .
Соответственно, применение реагентов внутрь, как и наружно, безопасно. Главное, знать предельную дозировку.
Превышение дозы, или концентрации кислот, ведет к разрушительным последствиям. Возможны химические ожоги, отравления.
Зато, едкость соединений наруку металлургам, мебельщикам, рестовраторам. Им карбоновые кислоты и смеси с ними помогают полировать и очищать неровные, заржавевшие поверхности.
Растворяя верхний слой металла, реагенты улучшают его внешний вид и эксплуатационные характеристики.
Химические карбоновые кислоты могут быть очищенными, или же, техническими. Для работы с металлами подойдут и последние.
Но, в качестве косметических и лекарственных средств применяют лишь высокоочищенные соединения. Такие нужны и в пищевой промышленности.
Около трети карбоновых кислот – официально зарегистрированные добавки, известные простым обывателям, как ешки.
На упаковках они отмечаются букврй Е и порядковым номером рядом с ней. Уксусная кислота, к примеру, пишется, как Е260.
Пищей карбоновые кислоты могут служить и для растений, входя в состав удобрений. Одновременно, можно создавать яды для вредоносных насекомых и сорняков.
Идея заимствована из природы. Ряд растений самостоятельно вырабатывают карбоновые кислоты, дабы близ них не было других трав, конкурирующих за почву и ее ресурсы. При этом, вырабатывающие яд растения, сами имеют к нему иммунитет.
Около трети карбоновых соединений используют в качестве протрав для тканей. Обработка необходима, чтобы материи равномерно окрашивались. С этой же целью реактивы применяют в кожевенной промышленности.
Добыча карбоновых кислот
Поскольку карбоновые кислоты биогенны, около 35% из них получают из природных продуктов. Но, химический синтез выгоднее.
Поэтому, при возможности переходят на него. Так, гиалуроновую кислоту, используемую для омоложения, долгое время добывали из пуповин младенцев и глаз крупного рогатого скота.
Теперь же, соединение получают биохимическим способом, выращивая на пшеничном субстрате бактерий, беспрерывно дающих кислоту.
Получение карбоновых кислот чисто химическим путем – это окисление спиртов и альдегидов.
Под последним понятием скрываются спирты, лишенные водорода. Реакция протекает так: — СН3 – СН2ОН → СН3 – СОН → СН3 – СООН.
Ряд карбоновых кислот получают гидролизом сложных эфиров. Получая в свой состав воду, они преобразуются в героинь статьи .
Сформировать их можно и из моногалогенпроизводных. Кислоты из них получаются под действием цианида калия . Полупродукт реакции необходимо разложить водой.
От схемы производства, количества его ступеней, расходных материалов, во многом зависит стоимость конечных продуктов. Узнаем, каков ценник на карбоновые кислоты в их чистом виде.
Цена карбоновых кислот
Большинство карбоновых кислот продают большими объемами. Фасуют, обычно, по 25-35 килограммов. Жидкости разливают в канистры.
Порошки засыпают в полиэтиленовые пакеты, а стеариновую кислоту, вообще, заворачивают в бумагу . Ценник, обычно, выставляется за кило.
Так, 1000 граммов лимонной кислоты стоит в районе 80-ти рублей. Столько же берут за муравьиную и щавелевую.
Стоимость олеиновой – около 130-ти рублей за килограмм. Салициловая кислота оценивается уже в 300. Стеариновая кислота на 50-70 рублей дешевле.
Ряд карбоновых кислот оценивается в долларах, поскольку основные поставки ведутся из США и стран Евросоюза.
Оттуда поступает, к примеру, гиалуроновая кислота. За килограмм отдают уже не пару сотен рублей, а несколько сот баксов.
Отечественный продукт присутствует, но ему не доверяют, в первую очередь, клиенты салонов красоты.
Они знают, что омоложение с помощью гиалуроновой кислоты – придумка американцев, практикуемая ими полвека.
Соответственно, велика практика производства препарата, который должен быть качественным, ведь попадает в кожу и организм.
Источник

 Используются в производстве мыл, моющих средств, сложных эфиров, смазочных масел, эмульгаторов, инсектицидов, катализаторов, растворителей, пластификаторов, лаков, смол и клеев, гликолей, пластиков, реактивов для флотации, ПАВ и многих других нужных для промышленности и быта веществ.
Используются в производстве мыл, моющих средств, сложных эфиров, смазочных масел, эмульгаторов, инсектицидов, катализаторов, растворителей, пластификаторов, лаков, смол и клеев, гликолей, пластиков, реактивов для флотации, ПАВ и многих других нужных для промышленности и быта веществ.







