- Что такое калориметр в физике? Определение, использование
- Введение
- Современный механизм
- Распределение по типам
- Измерение теплоты
- Измерения калориметрических систем
- Наличие побочных эффектов
- Изотермические наблюдения
- Массивный тип
- Поток
- Средство для измерения мощности
- Название и классификация
- Окончательные результаты
- Калориметр
Что такое калориметр в физике? Определение, использование
В этой статье мы ответим на вопрос: «Что такое калориметр?». Определим общую характеристику данного механизма, его принцип работы и области применения, функциональные возможности и измерительные величины. А также уделим внимание классификации и описанию некоторых конкретных видов.
Введение
Отвечая на вопрос о том, что такое калориметр, в общих чертах его можно охарактеризовать как прибор, посредством которого производится измерение количества тепла, что выделяется или поглощается в ходе протекания физических, химических или биологических процессов.
Ввести новую терминологическую единицу «калориметр» предложили в 1780 году П. Лаплас и А. Лавуазье. Подобное устройство также используется в ядерном разделе физики, изучающем элементарные частицы, а называется оно ионизационным калориметром. Однако функция этого прибора заключается в измерении энергетического потенциала частиц.
Современный механизм
Определение теплоемкости калориметром современного производства позволяет зафиксировать исследуемую величину с точностью от десяти и до одной сотой процента. Диапазон, в котором этот прибор может работать, колеблется от 0,1 до 3500 Кельвинов. Тип устройства калориметров очень разнообразен. Он может определяться характером процесса, который изучают, а также его длительностью. Еще одним важным параметром определения типа механизма является область температур, в которых происходят измерения, а также количество измеряемой величины теплоты.
Определение энергетического эквивалента калориметром может показать субъекту количество тела, что выделяется в ходе сгорания топливного ресурса. Сделать это можно благодаря выражению Q = C∆T, в котором С – показатель теплового (энергетического) эквивалента. Задать параметры определения путем калибровки прибора. Другая величина ∆T – функция известного выходящего сигнала калориметра.
Распределение по типам
Нельзя ответить на вопрос о том, что такое калориметр, не ознакомившись с его типами.
Одним из наиболее распространенных представителей таких аппаратов является калориметр-интегратор. Он предназначается для определения общей суммы количества тепла Q, которое выделяется в начале реакции и ее конце.
Еще одним широко известным калориметром является прибор для измерения мощности тепла, то есть скорости, с которой выделяется тепло – L. А также они могут делиться по конструкции механизма и измерительной методологии, подходу. Еще выделяют калориметры жидкостного и массивного типа. Также встречаются одинарные и дифференциальные устройства.
Измерение теплоты
Что такое калориметр в физике? Определение гласит, что это прибор для измерения количества выделяемой теплоты. При этом теплоту, выделяемую в процессе химической реакции, можно узнать только благодаря жидкостному калориметру-интегратору.
Конструкция представлена в виде сосуда, наполненного жидкостью (как правило, водой). В нем располагают камеру для проведения эксперимента («калориметрическую бомбу»), мешалку, термометр и прибор для нагревания.
Измерения калориметрических систем
Внесение корректив в естественный ход выделения тепла системы можно обнаружить при изменении какого-либо из ее состояний. Они же, в свою очередь, определяются с помощью анализа величины теплоты, которая вводится в устройство. Определение постоянной калориметра происходит до начала проведения измерительных работ и сравнивается с заданной и откорректированной величиной. Приборы подвергаются градуировке, благодаря которой определяется коэффициент. Его необходимо перемножить с измеренным термометром изменением температуры прибора.
Наличие побочных эффектов
По факту калориметрические данные показывают непосредственно только суммарное число теплот, что исследуются в процессе. Еще можно узнать на наличии побочного процесса (или процессов), который мог вызвать явление перемешивания, испарения жидкости, а также разбивания ампулы с веществами и т. п. Определение константы калориметра позволяет человеку получить доступ к сравнению показателей изменений на фоне чего-либо. Именно с его помощью происходит анализ информации.
Теплота побочного ряда процессов определяться должна при помощи опыта или расчета, исключающегося из результатов исследований. Примером побочного явления может послужить неизбежный теплообмен между калориметром и окружающим пространством и материей.
Изотермические наблюдения
Существует калориметр-интегратор изотермического типа, позволяющий вводить изменения в агрегатные состояния тел, которые образуют основную часть системы. Примером может послужить таяние массы льда в ледяной камере калориметра Бунзена. Узнать изменение теплоты, которое влияет на агрегатное состояние, но не вызывает перемены температуры, можно, если рассчитать массу вещества и количество теплоты, которое для этого потребовалось бы затратить.
Для определения удельной теплоемкости калориметра необходимо знать, что она является численно равной количеству теплоты, которое затрачивается для нагревания единицы массы материи. Ее единицей является Дж/кг▪К.
Важно помнить, что показатель удельной теплоемкости – это неоднозначная характеристика. Существует зависимость между условиями осуществления теплопередачи и значением работы, которая сопровождает данный процесс.
Массивный тип
Для определения значения энтальпии вещества в условиях температуры до 2500 градусов по Цельсию используют массивные интеграторы. Масса калориметра такого типа может варьироваться в зависимости от величины веса измеряемого вещества, так как конструкция состоит из металлов. Фактически это блок с некоторым количеством выемок для сосудов. В них протекают реакции, предназначенные для нагревательного прибора и/или термометра. Произведение значения тепла, измеренного калориметром, и разности температурных подъемов в блоке показывает нам энтальпию веществ(а).
Поток
Можно определить показатель теплоемкости какого-либо газа или жидкости с помощью проточного лабиринтного калориметра. Он фиксирует разность температуры, которая входит и выходит из стационарных потоков исследуемого вещества. Также он определяет мощность такого потока и силу теплоты, которая выделяется электрообогревателем, в джоулях.
Средство для измерения мощности
Отвечая на вопрос о том, что такое калориметр, важно будет упомянуть о предназначении этого прибора для определения мощности. Такой аппарат, в отличие от интегратора, должен быть наделен значительной способностью к теплообмену. Это необходимо для того, чтобы он смог удалять то количество теплоты, которое в него вводят. Из этого следует, что состояние калориметра находится в мгновенном измерении.
Тепловую величину мощи процесса находят посредством использования калориметров с оболочкой. Изобретение было сделано ученым-физиком из Франции, Э. Кальве. Изначально механизм был представлен в виде металлического блока, оснащенного каналами. На них разложили специальные цилиндрические ячейки, предназначенные для проведения исследуемого процесса. Металл, который используют в конструкции камеры, является оболочкой. Ее температуру следует держать на постоянной отметке с точностью до пяти-шести Кельвинов.
Измерение разности между температурой ячейки и блока происходит при помощи термобатареи, имеющей до тысячи спаек. Показатели ее ЭДС и теплообмена ячейки являются величинами, пропорциональными малому различию в температуре, возникшей между такими компонентами, как блок и ячейка. При этом в самой ячейке должна выделяться или поглощаться теплота. Очень часто в подобных блоках располагают пару ячеек, которые будут работать дифференциально.
Название и классификация
Обычными названиями для калориметров являются:
- для химических реакций;
- бомбовый;
- изотермического типа;
- низкотемпературного типа;
- ледяного типа.
Все они имеют данные об историческом происхождении. Своим названием они, как правило, обязаны, области, в которой их будут использовать. Однако эти наименования не относятся к сравнительной или полной характеристике.
Общий вид классификации калориметров строится, используя в качестве основы, рассмотрение одной из трех главных величин, по отдельности или вместе. Именно подход к анализу показателей определяет методику измерений температуры, которой обладает:
- калориметрическая система Тс;
- оболочка То;
- количество выделившейся теплоты L в течение единицы времени (тепловая мощность).
Калориметры, с постоянным значением Тс и То, относятся к изотермическому типу, а приборы, в которых Тс=То, называют адиабатическими. Если устройство работает в условиях с постоянной разностью между температурами, то его называют калориметром с постоянным течением теплообмена. Изопериболический механизм обладает постоянной То, а Тс – это тепловая функция мощности L.
Окончательные результаты
Существует ряд факторов, способных повлиять на конечный результат измерений. Одним из них является наличие внесения изменений, влияющее на их окончательный результат. Оно обусловлено надежностью работы автоматического набора регуляторов температуры изотермической или адиабатической оболочки. В последней из них температурная величина определяется ее близостью к изменяющимся условиям всей калориметрической системы. Такая конструкция обладает легкостью металлической ширмы и снабжена прибором для нагревания, который уменьшает протекание и значение теплообмена до определенного уровня, при котором температура калориметра будет изменяться лишь на десятичные части градуса в минуту. Это может позволить снизить теплообмен, протекающий в течение калориметрического эксперимента, до предельно низких значений, которыми можно пренебречь.
Рассматриваемые в статье приборы играют огромную роль в жизни человека и являются одним из очень значимых достижений науки. Главная функция калориметра заключена в исследовании данных изменения температуры и определении наличия дефектов в процессе теплообмена. Существует различные способы классификации данных приборов, связанные с конкретными параметрами, резко различающимися между собой. Материалом для изготовления могут служить самые разнообразные металлы, например, есть медные калориметры, свинцовые, стальные и другие. Кроме чистых веществ, также могут использоваться и сплавы.
Источник
Калориметр
Калор и метр (от лат. calor — тепло и . метр), прибор для измерения количества теплоты, выделяющейся или поглощающейся в каком-либо физическом, химическом или биологическом процессе. Термин «калориметр» был предложен А. Лавуазье и П. Лапласом (1780).
Современные калориметры работают в диапазоне температур от 0,1 до 3500 К и позволяют измерять количество теплоты с точностью до 10 -2 %. Устройство калориметров весьма разнообразно и определяется характером и продолжительностью изучаемого процесса, областью температур, при которых производятся измерения, количеством измеряемой теплоты и требуемой точностью.
Калориметр, предназначенный для измерения суммарного количества теплоты Q, выделяющейся в процессе от его начала до завершения, называют калориметром-интегратором; калориметр для измерения тепловой мощности L и её изменения на разных стадиях процесса — измерителем мощности или калориметром-осциллографом. По конструкции калориметрической системы и методу измерения различают жидкостные и массивные калориметры, одинарные и двойные (дифференциальные).
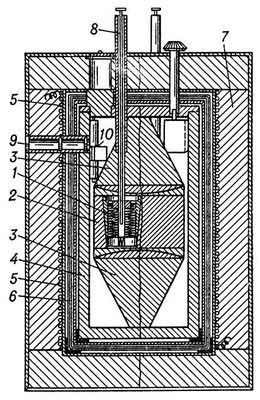
Жидкостный калориметр-интегратор переменной температуры (рис. 1) с изотермической оболочкой применяют для измерений теплот растворения и теплот химических реакций. Он состоит из сосуда с жидкостью (обычно водой), в котором находятся: камера для проведения исследуемого процесса («калориметрическая бомба»), мешалка, нагреватель и термометр. Теплота, выделившаяся в камере, распределяется затем между камерой, жидкостью и др. частями калориметра, совокупность которых называют калориметрической системой прибора. Изменение состояния (например, температуры) калориметрической системы позволяет измерить количество теплоты, введённое в калориметр. Нагрев калориметрической системы фиксируется термометром. Перед проведением измерений калориметр градуируют — определяют изменение температуры калориметрической системы при сообщении ей известного количества теплоты (нагревателем калориметра или в результате проведения в камере химической реакции с известным количеством стандартного вещества). В результате градуировки получают тепловое значение калориметра, т. е. коэффициент, на который следует умножить измеренное термометром изменение температуры калориметра для определения количества введённой в него теплоты. Тепловое значение такого калориметра представляет собой теплоёмкость (с) калориметрической системы. Определение неизвестной теплоты сгорания или др. химической реакции Q сводится к измерению изменения температуры D t калориметрической системы, вызванного исследуемым процессом: Q = c × D t. Обычно значение Q относят к массе вещества, находящегося в камере калориметра.
Калориметрические измерения позволяют непосредственно определить лишь сумму теплот исследуемого процесса и различных побочных процессов, таких как перемешивание, испарение воды, разбивание ампулы с веществом и т.п. Теплота побочных процессов должна быть определена опытным путём или расчётом и исключена из окончательного результата. Одним из неизбежных побочных процессов является теплообмен калориметра с окружающей средой посредством излучения и теплопроводности. В целях учёта побочных процессов и прежде всего теплообмена калориметрическую систему окружают оболочкой, температуру которой регулируют.
У жидкостных калориметров температуру оболочки поддерживают постоянной. При определении теплоты химической реакции наибольшие затруднения часто связаны не с учётом побочных процессов, а с определением полноты протекания реакции и с необходимостью учитывать несколько реакций.
В калориметре-интеграторе другого вида — изотермическом (постоянной температуры) введённая теплота не изменяет температуры калориметрической системы, а вызывает изменение агрегатного состояния тела, составляющего часть этой системы (например, таяние льда в ледяном калориметре Бунзена). Количество введённой теплоты рассчитывается в этом случае по массе вещества, изменившего агрегатное состояние (например, массе растаявшего льда, которую можно измерить по изменению объёма смеси льда и воды), и теплоте фазового перехода.
Массивный калориметр-интегратор чаще всего применяют для определения энтальпии веществ при высоких температурах (до 2500 °С). Калориметрическая система у калориметров этого типа представляет собой блок из металла (обычно из меди или алюминия) с выемками для сосуда, в котором происходит реакция, для термометра и нагревателя. Энтальпию вещества рассчитывают как произведение теплового значения калориметра на разность подъёмов температуры блока, измеряемых после сбрасывания в его гнездо ампулы с определённым количеством вещества, а затем пустой ампулы, нагретой до той же температуры.
Теплоёмкость газов, а иногда и жидкостей, определяют в т. н. проточных лабиринтных калориметрах — по разности температур на входе и выходе стационарного потока жидкости или газа, мощности этого потока и джоулевой теплоте, выделенной электрическим нагревателем калориметра.
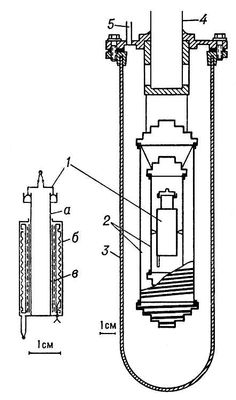
Калориметр, работающий как измеритель мощности, в противоположность калориметру-интегратору должен обладать значительным теплообменом, чтобы вводимые в него количества теплоты быстро удалялись и состояние калориметра определялось мгновенным значением мощности теплового процесса. Тепловая мощность процесса находится из теплообмена калориметра с оболочкой. Такие калориметры (рис. 2), разработанные французским физиком Э. Кальве (Е. Calvet, 1895—1966), представляют собой металлический блок с каналами, в которые помещают цилиндрические ячейки. В ячейке проводится исследуемый процесс; металлический блок играет роль оболочки (температура его поддерживается постоянной с точностью до 10 -5 —10 -6 К). Разность температур ячейки и блока измеряется термобатареей, имеющей до 1000 спаев. Теплообмен ячейки и эдс термобатареи пропорциональны малой разности температур, возникающей между блоком и ячейкой, когда в ней выделяется или поглощается теплота. В блок помещают чаще всего две ячейки, работающие как дифференциальный калориметр: термобатареи каждой ячейки имеют одинаковое число спаев и поэтому разность их эдс позволяет непосредственно определить разность мощности потоков теплоты, поступающей в ячейки. Этот метод измерений позволяет исключить искажения измеряемой величины случайными колебаниями температуры блока. На каждой ячейке монтируют обычно две термобатареи: одна позволяет скомпенсировать тепловую мощность исследуемого процесса на основе Пельтье эффекта, а другая (индикаторная) служит для измерения нескомпенсированной части теплового потока. В этом случае прибор работает как дифференциальный компенсационный калориметр. При комнатной температуре такими калориметрами измеряют тепловую мощность процессов с точностью до 1 мквт.
Обычные названия калориметров — «для химической реакции», «бомбовый», «изотермический», «ледяной», «низкотемпературный» — имеют историческое происхождение и указывают главным образом на способ и область использования калориметра, не являясь ни полной, ни сравнительной их характеристикой.
Общую классификацию калориметров можно построить на основе рассмотрения трёх главных переменных, определяющих методику измерений: температуры калориметрической системы Tc; температуры оболочки To, окружающей калориметрическую систему количества теплоты L, выделяемой в калориметре в единицу времени (тепловой мощности).
Калориметр с постоянными Tc и To называют изотермическим; с Tc = To — адиабатическим; калориметр, работающий при постоянной разности температур Tc — To, называют калориметром с постоянным теплообменом; у изопериболического калориметра (его ещё называют калориметром с изотермической оболочкой) постоянна To, а Tc является функцией тепловой мощности L.
Важным фактором, влияющим на окончательный результат измерений, является надёжная работа автоматических регуляторов температуры изотермических или адиабатических оболочек. В адиабатическом калориметре температура оболочки регулируется так, чтобы она была всегда близка к меняющейся температуре калориметрической системы. Адиабатическая оболочка — лёгкая металлическая ширма, снабженная нагревателем, — уменьшает теплообмен настолько, что температура калориметра меняется лишь на несколько десятитысячных град/мин. Часто это позволяет снизить теплообмен за время калориметрического опыта до незначительной величины, которой можно пренебречь. В случае необходимости в результаты непосредственных измерений вводится поправка на теплообмен, метод расчёта которой основан на законе теплообмена Ньютона — пропорциональности теплового потока между калориметром и оболочкой разности их температур, если эта разность невелика (до 3—4 ° С).
Для калориметра с изотермической оболочкой теплоты химической реакции могут быть определены с погрешностью до 0,01%. Если размеры калориметра малы, температура его изменяется более чем на 2—3 °С и исследуемый процесс продолжителен, то при изотермической оболочке поправка на теплообмен может составить 15—20% от измеряемой величины и существенно ограничить точность измерений. В этих случаях целесообразнее применять адиабатическую оболочку.
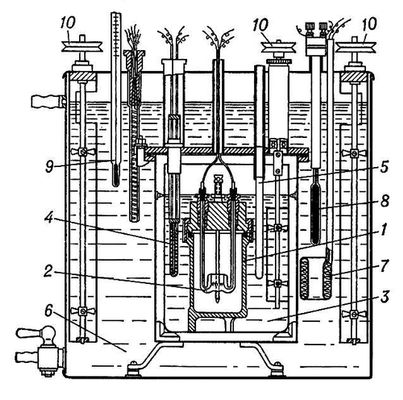
При помощи адиабатического калориметра определяют теплоёмкость твёрдых и жидких веществ в области от 0,1 до 1000 К. При комнатных и более низких температурах адиабатический калориметр, защищенный вакуумной рубашкой, погружают в Дьюара сосуд, заполненный жидким гелием, водородом или азотом (рис. 3). При повышенных температурах (выше 100 °С) калориметр помещают в термостатированную электрическую печь.
Лит.: Попов М. М., Термометрия и калориметрия, 2 изд., М., 1954; Скуратов С. М., Колосов В. П., Воробьев А. Ф., Термохимия, ч. 1—2, М., 1964—66; Кальве Э., Прат А., Микро-калориметрия, пер. с франц., М., 1963; Experimental thermochemistry, v. 1—2 N. Y. — L., 1956-62.
Рис. 2. Калориметр Э. Кальве для измерения тепловой мощности процессов (схема): 1 — калориметрическая ячейка с термопарами; 2 — блок калориметра; 3 — металлические конусы для создания однородного поля температур в блоке; 4 — оболочка; 5 — нагреватель для термостатирования прибора; 6 — тепловые экраны; 7 — тепловая изоляция; 8 — трубка для введения вещества в калориметр; 9 — окно для отсчётов показаний гальванометра 10.
Рис. 3. Адиабатический калориметр для определения теплоёмкости при низких температурах (схема): 1 — калориметр (а — сосуд для вещества, б — термометр сопротивления, в — нагреватель); 2 — адиабатические оболочки (ширмы); 3 — вакуумная рубашка; 4 — труба для откачки; 5 — трубка для электрических проводов.
Рис. 1. Жидкостный калориметр-интегратор с изотермической оболочкой (схема): 1 — «калориметрическая бомба»; 2 — нагреватель для возбуждения реакции; 3 — собственно калориметр (сосуд, заполненный водой); 4 — термометр сопротивления; 5 — холодильник (трубка, через которую можно пропускать холодный воздух); 6 — изотермическая оболочка калориметра, заполненная водой; 7 — нагреватель оболочки; 8 — контактный термометр для регулировки температуры оболочки; 9 — контрольный термометр; 10 — мешалки с приводом.
Источник