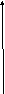4.2.3 Коагуляция лиофобных коллоидов
Как было показано выше, лиофобные коллоиды являются термодинамически неустойчивыми системами, существующими благодаря стабилизации за счет возникновения двойного электрического слоя. Изменение состояния ДЭС может, следовательно, привести к потере агрегативной устойчивости – слипанию частиц в более крупные агрегаты, т.е. коагуляции золя. Коагуляция золей может быть вызвана различными факторами: прибавлением электролитов, нагреванием или замораживанием, механическим воздействием и т.д. Наиболее важным и изученным фактором коагуляции гидрофобных коллоидов является воздействие на них растворов электролитов.
Для коагуляции золей электролитами установлен ряд эмпирических закономерностей.
1. Для начала коагуляции золя необходима некоторая минимальная концентрация электролита, называемая порогом коагуляции γ.
2. Коагулирующим действием обладает тот из ионов электролита, заряд которого противоположен заряду коллоидных частиц, причем коагулирующее действие иона тем сильнее, чем больше его заряд (правило Шульце – Гарди или правило значности). Величины порогов коагуляции двухзарядных ионов примерно на порядок, а трехзарядных – на два порядка меньше, чем для однозарядных ионов. Правило значности имеет приближенный характер и справедливо только для неорганических ионов; некоторые однозарядные органические ионы обладают более сильным коагулирующим действием, чем двухзарядные неорганические ионы, что обусловлено их сильной специфической адсорбируемостью.
3. В рядах неорганических ионов с одинаковыми зарядами коагулирующее действие возрастает с уменьшением гидратируемости ионов; например, в ряду однозарядных катионов щелочных металлов коагулирующее действие возрастает от лития к рубидию:
γ (Li + ) > γ (Na + ) > γ (К + ) > γ (Rb + )
Ряды, в которые сгруппированы по возрастанию либо по убыванию коагулирующего действия ионы с одинаковым зарядом, называют лиотропными рядами.
4. В осадках, получаемых при коагуляции золей электролитами, всегда присутствуют ионы, вызвавшие коагуляцию.
5. При коагуляции золей смесями электролитов сравнительно редко наблюдается их независимое (аддитивное) действие; обычно имеет место взаимное усиление либо ослабление коагулирующего действия (синергизм либо антагонизм ионов).
Механизм и кинетика коагуляции золей электролитами
Необходимому для коагуляции сближению частиц дисперсной фазы препятствует, как было показано выше, электростатическое отталкивание имеющих одноименный заряд коллоидных частиц и противоионов и взаимодействие сольватных оболочек противоионов диффузного слоя. При добавлении к золю раствора электролита имеющееся равновесие адсорбции – десорбции между противоионами адсорбционного и диффузного слоев смещается в сторону адсорбции вследствие увеличения в дисперсионной среде концентрации ионов, имеющих заряд, противоположный заряду ядра (ионы с одноименным зарядом в равновесии адсорбции – десорбции не участвуют). Адсорбция дополнительного числа противоионов приводит к уменьшению заряда коллоидных частиц, уменьшению числа противоионов диффузного слоя (уменьшению толщины ДЭС) и, следовательно, к снижению агрегативной устойчивости золя. При достижении некоторого предельного значения заряда коллоидные частицы получают возможность сближения и объединения в более крупные агрегаты за счет ван-дер-ваальсовых сил; иными словами, происходит коагуляция золя.
Очевидно, что, поскольку при адсорбции многозарядных противоионов заряд коллоидной частицы уменьшается быстрее, чем при адсорбции того же числа однозарядных противоионов; адсорбируемость неорганических ионов с увеличением их заряда также возрастает. Следствием этого и является тот факт, что величина порога коагуляции для неорганических ионов будет тем меньше, чем больше заряд иона-коагулянта (величина порога коагуляции γ обратно пропорциональна заряду иона-коагулянта в шестой степени z 6 ).
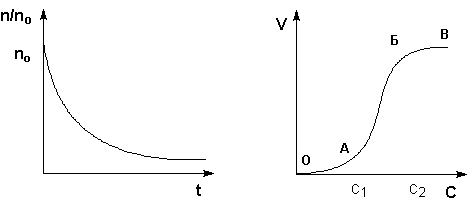
Процесс коагуляции золя характеризуется определенной величиной скорости коагуляции, которую можно определить как изменение числа коллоидных частиц в единице объема за единицу времени. Скорость коагуляции золя электролитами зависит как от концентрации самого золя, так и от концентрации электролитов. Типичный вид коагуляционной кривой (зависимости отношения концентрации коллоидных частиц n к их начальной концентрации nо от времени t) и кривой зависимости скорости коагуляции V от концентрации электролита С показан на рисунках 4.10-4.11. На кривой ОАБВ (рис. 4.11) отрезок ОА отвечает периоду скрытой коагуляции, при которой золь сохраняет свою устойчивость. В точке А при концентрации электролита С1 начинается явная коагуляция; на участке АБ скорость коагуляции быстро возрастает с ростом концентрации электролита. На участке БВ скорость коагуляции остается постоянной; это связано с тем, что при концентрации электролита С2 величина ζ-потенциала становится равной нулю; скорость коагуляции при этом достигает максимального значения.
Рис. 4.10 Коагуляционная кривая. Рис. 4.11 Зависимость скорости коагуляции от концентрации.
Взаимная коагуляция золей
Коагуляция золя может быть вызвана его взаимодействием с другим золем, частицы которого имеют противоположный заряд. Так, смешение золя гидроксида железа, частицы которого имеют положительный заряд, с отрицательно заряженным золем сульфида мышьяка приводит к их взаимной коагуляции:
В данном случае коагуляция обусловлена тем, что коллоидные частицы одного вида являются как бы очень крупными многозарядными ионами – коагулянтами для частиц другого вида. Взаимная коагуляция коллоидных систем может наблюдаться и тогда, когда частицы золей имеют одноименный заряд; в этом случае причиной потери устойчивости одного из золей является сильная специфическая адсорбция иона – стабилизатора данной системы поверхностью коллоидных частиц другой системы.
Старение золей и пептизация
Термодинамическая неустойчивость лиофобных коллоидных систем является причиной старения золей – самопроизвольной коагуляции (автокоагуляции) золей. Автокоагуляция золей происходит значительно медленнее, чем коагуляция электролитами; так, золи золота могут сохраняться без видимых изменений десятилетиями. Одной из основных причин старения золей является медленно совершающийся процесс перекристаллизации вещества ядра.
Пептизацией (дезагрегацией) называется процесс расщепления коагулировавшего золя (коагулята) на первичные частицы – процесс, противоположный коагуляции. Пептизация возможна лишь тогда, когда структура частиц в коагуляте не изменена по сравнению с первоначальной (т.е. когда еще не произошло полного сращивания частиц и они слабо связаны друг с другом). Различают непосредственную и опосредованную пептизацию.
Непосредственная пептизация происходит в результате добавления к коагуляту электролита, содержащего потенциалопределяющий ион; в результате его специфической адсорбции на поверхности частиц дисперсной фазы их заряд вновь увеличивается, толщина двойного электрического слоя возрастает. Это приводит к тому, что силы отталкивания между частицами начинают преобладать над силами притяжения; происходит деагрегация – распад образовавшегося ранее агрегата из слипшихся частиц.
Опосредованная пептизация вызывается добавлением в систему вещества, химическое взаимодействие которого с поверхностью коагулята приводит к высвобождению потенциалопределяющих ионов. Например, коагулировавший золь гидроксида железа(III) может быть пептизирован добавлением в систему либо какой-либо соли железа (непосредственная пептизация), либо соляной кислоты (опосредованная пептизация).
Источник
6.4. Коагуляция лиофобных дисперсных систем
В процессе работы с коллоидными системами часто возникает обратная задача – разрушение коллоидных систем. Для этого выявляют факторы, обеспечивающих устойчивость системы и устраняют их. Например,
ионный фактор – избыток электролита
структурно-механический – добавление коротко-цепочечных ПАВ.
Часто можно вызвать коагуляцию изменением температуры.
Внешние признаки коагуляции:
повышение вязкости и т.д.
Коагуляция – самопроизвольный процесс (Gs ↓) .
Различают 2 стадии коагуляции:
скрытая коагуляция (частицы укрупняются, но не теряют седиментационную устойчивость)
явная коагуляция – система теряет устойчивость, и образуется осадок.
Причины коагуляции многообразны: изменение Т, воздействие электрических и магнитных полей, световое механическое воздействия, добавление электролитов и т.д.
Мы рассмотрим причины и некоторые особенности электролитной коагуляции.
6.4.1. Основные закономерности электролитной коагуляции
Различают 3 наиболее характерных вида потенциальных кривых для дисперсных систем с различной устойчивостью


Рис. 6.4. Потенциальные кривые для дисперсных систем с различной степенью агрегативной устойчивости
Кривая 1 →на любом h Еприт > Еотт; не меняет это отношение и тепловое движение. Для системы характерна быстрая коагуляция с образованием агрегатов (в системе с жидкой и газообразной средой – коалесценция).
Кривая 2 – высокий потенциальный барьер и наличие вторичного минимума. Такое состояние отвечает обратимости коагуляции.
Кривая 3 — высокий потенциальный барьер при отсутствии вторичного минимума. Вероятность образования агрегатов мала. Система обладает большой агрегативной устойчивостью.
Правила электролитной коагуляции
1. Коагуляцию вызывает любой электролит, если его концентрация превышает некоторую критическую – порог коагуляции.
Порог коагуляции – это минимальное количество электролита, вызывающее коагуляцию 1 л золя.
Величина, обратная порогу коагуляции, называется коагулирующей способностью: число объёмов золя, коагулирующих под действием 1 моль (1 ммоль) иона-коагулятора.
Величина порога коагуляции зависит от ряда условий:
1. момент фиксирования
2. метод наблюдения
3. концентрации золя и др.
Наиболее распространенные методы определения порога коагуляции – измерение светорассеивания или титрование золя раствором электролита до начала явной коагуляции.
Коагуляцию вызывают ионы, обратные по знаку с зарядом ядра мицеллы.
При введении постороннего электролита в дисперсную систему уменьшается толщина диффузного слоя (ионы из диффузионного слоя переходят в адсорбционный) , уменьшается энергия отталкивания частиц, а следовательно, и U. Кривые 1, 2, 3 на рис.6.5 показывают изменение формы суммарной кривой U и величиныU при повышении концентрации постороннего электролита в системе. При достаточно высокой концентрации электролита толщина диффузного слоя уменьшается практически до нуля (изоэлектрическое состояние), исчезает потенциальный барьер (кривая 3), частицы слипаются при всяком столкновении друг с другом (происходит т.н. быстрая коагуляция ).
Таким образом, малые концентрации электролитов стабилизируют дисперсные системы термодинамически и кинетически, образуя на поверхности частиц двойной электрический слой. Образование ДЭС уменьшает избыточную поверхностную энергию и создает потенциальный барьер отталкивания частиц. Повышенные концентрации электролитов снижают потенциальный барьер отталкивания (в пределе до нуля), вызывая тем самым агрегацию частиц при их столкновении.
С увеличением концентрации противоионов адсорбционный слой ДЭС доукомплектовывается, толщина диффузного слоя δ уменьшается, и ζ↓ до 0. В изоэлектрическом состоянии в системе происходит коагуляция.
↑

φ

Рис.6.5. Влияние концентрации электролита на величину потенциального барьера отталкивания и распределение потенциала в ДЭС
Коагулирующая способность ионов зависит от радиуса иона R
Чем больше радиус иона R, тем меньше он в гидратированном состоянии, тем больше адсорбционная способность иона (при меньших концентрациях укомплектовывают адсорбционный слой и вызывают коагуляцию).
Коагулирующая способность ионов одинакового заряда увеличивается при увеличении радиуса иона в лиотропном ряду:
Li + + + + + Mg +2 +2 +2 +2
Анионы также можно разложить в ряд, но разница в их коагулирующей способности не так значительна.
В гомологических рядах электролитов с органическими ионами коагулирующая способность равномерно возрастает с введением групп –СН2— в соответствии с правилом Траубе.
Коагулирующая способность ионов зависит от их заряда (правило Шульце-Гарди (**) ).
Сравнение значений порогов коагуляции, определенных расчетным путем по теории ДЛФО и полученных экспериментально показывает неплохое сходство в их значениях.
γ 1 20 500 (эксперимент)
При электролитной коагуляции золя различают:
концентрационную коагуляцию – под действием индифферентного электролита: Со↑ → δ↓ → ζ↓ вследствие сжатия диффузного слоя и уменьшения ζ-потенциала до 0;
нейтрализационную коагуляцию: при добавлении неиндифферентного электролита потенциалопределяющие ионы связываются в малорастворимое соединение, при этом Со↑ → φо↓ → ζ↓.
Тут вы можете оставить комментарий к выбранному абзацу или сообщить об ошибке.
Источник