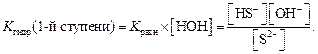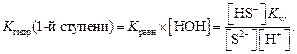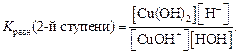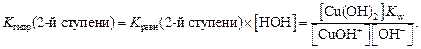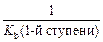Гидролиз соли BaS, образованной сильным основанием и слабой кислотой.
Соль ВаS образована сильным основанием Ba(OH)2 и слабой кислотой H2S (см. приложение), следовательно, будет подвергаться гидролизу по слабому аниону S 2– , а поскольку заряд аниона серы равен
(2–) то стадий гидролиза будет две. Катионы же Ва 2+ не принимают участия в реакции гиролиза, поскольку не образуют с водой слабого электролита, поэтому водный раствор соли приобретет щелочную реакцию.
Далее необходимо убедиться, что соль, гидролиз который вы будете расписывать, растворима в воде (см. таблицу растворимости в приложении 5). Условно считают, что все хорошо растворимые соли являются сильными электролитами и, следовательно, диссоциируют практически полностью на ионы: BaS → Ва +2 + S 2– .
Записываем 1-ю ступеньгидролиза при взаимодействии аниона серы с молекулой воды:
краткое ионно-молекулярное уравнение: S 2– + HOH ↔ HS – + OH – ;
полное ионно-молекулярное уравнение:
S 2– + Ba 2+ + HOH ↔ Ba 2+ + HS – + OH — ;
молекулярное уравнение: 2BaS + 2H2O ↔ Ba(HS)2 + Ba(OH)2.
2-я ступень гидролиза:
краткое ионно-молекулярное уравнение: HS – + HOH ↔ H2S + OH – ;
полное ионно-молекулярное уравнение:
2HS – + Ba 2+ + 2H2O ↔ Ba 2+ + 2H2S + 2OH – ;
Итак, в результате гидролиза появляются несвязанные ОН – , следовательно, среда в растворе соли должна быть щелочной.
Количественной характеристикой гидролиза солей служит константа гидролиза, которую записывают на основании краткого ионного уравнения 1-й ступени гидролиза:

Один из множителей в знаменателе (концентрация воды) практически не меняется при изменении концентрации соли, вследствие чего ее условно можно считать величиной постоянной. Умножив правую и левую части уравнения для константы равновесия на величину [H2O], получаем Kгидролиза для первой ступени:
Из уравнения ионного произведения воды Kw = [H + ] [OH – ]выразим [OH – ]:

Для того чтобы понять, что представляет величина 
1-я ступень Н2S ↔ H + + HS – Kа(1-ой ступени) = 
2-я ступень HS — ↔ H + + S 2– Kа(2-ой ступени) = 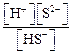
Очевидно, что 


Вычислим pH раствораBaS, если аналитическая концентрация соли С(BaS) = 0,01 моль/л. Прежде всего найдем константу гидролиза Kг (1-й ступени), для этого воспользуемся значением константы диссоциации сероводородной кислоты Kа2 = 1·10 –12 (см. приложение 11) и ионное произведение воды Kw = 10 –14 :
Теперь найдем степень гидролиза: 
Для вычисления pH следует принять во внимание, что в результате гидролиза каждого аниона S 2– образуется один гидроксид-ион OH – . Если исходная концентрация гидролизующихся анионов равна С, моль/л, а гидролизу подверглась доля β этих анионов, то при этом образовалось β×С моль/л ионов OH – .
Таким образом, [OH – ] = β·СBaS = 1 · 0,01 = 0,01 моль/л.
Следовательно, рOH = –lg [OH — ] = –lg 0,01 = 2.
Учитывая, что: рH + рOH = 14 рH = 14 – рOH = 14 – 2 = 12.
Таким образом, выполненные расчеты подтвердили, что соль BaS имеет щелочную реакцию среды.
2. Гидролиз соли СuCl2, образованной слабым основанием и сильной кислотой.
Анионы хлора не принимают участия в реакциях, поскольку не образуют с водой слабого электролита. Так как заряд катиона меди равен «2+», то стадий гидролиза будет также две. Водный раствор будет иметь кислую реакцию, так как взаимодействие ионов слабого основания Сu 2+ с водой приведет к смещению равновесия диссоциации воды и к образованию свободных протонов водорода.
1-я стадия гидролиза:
краткое ионно-молекулярное уравнение: Сu 2+ +HOH ↔ CuOH + +H + ;
полное ионно-молекулярное уравнение:
Сu 2+ + 2Cl – + H2O ↔ CuOH + + H + + 2Cl – ;
молекулярное уравнение: CuCl2 + H2O ↔ CuOHCl + HCl.
2-я стадия гидролиза:
краткое ионно-молекулярное уравнение:
СuOH + + HOH ↔ Cu(OH)2 + H + ;
полное ионно-молекулярное уравнение:
СuOH + + Cl – + HOH ↔ Cu(OH)2 + H + + Cl – ;
молекулярное уравнение: CuOHCl + H2O ↔ Cu(OH)2 + HCl.
Запишем выражение для константы равновесия процесса гидролиза по второй стадии исходя из краткого ионного уравнения:
Поскольку концентрация воды – величина практически постоянная, то умножив константу равновесия на величину [H2O], получаем
Kгидр по 2-й ступени
Kгидр по 2-й ступени =
Из ионного произведения воды Kw = [H + ] [OH – ]выразим концентрацию [H + ]:

Для того чтобы понять, что представляет величина 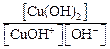
Сu(OH)2 ↔ CuOH + + OH – Kb(1-й ступени) = 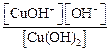
2-я ступень: CuOH + ↔ Cu 2+ + OH – Kb(2-й ступени) = 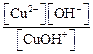
Очевидно, что 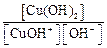
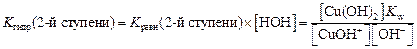
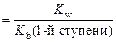
Кислую реакцию среды соли CuCl2 подтвердим расчетами, т.е. определим pH раствора, зная, что С(CuCl2) = 0,001 моль/л.
Прежде всего найдем константу гидролиза Kг2, для этого воспользуемся значением константы диссоциации меди гидроксида (Kb1 =
= 3,4·10 -7 ), ионное произведение воды Kw = 10 –14 :
Теперь найдем степень гидролиза β:
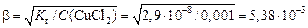
Для вычисления pH следует принять во внимание, что в результате гидролиза каждого катиона Cu 2+ образуется один ион H + . Если исходная концентрация гидролизующихся катионов была С моль/л, а гидролизу подверглась доля β этих катионов, то при этом образовалось βС моль/л ионов H + .
Таким образом, [H + ] = βСBaS = 5,38·10 –3 ·0,001= 5,38·10 –6 моль/л.
Следовательно, рH = –lg [H + ] = –lg 5,38·10 –6 = 5,26.
Выполненные расчеты подтвердили, что соль CuCl2имеет кислую реакцию среды.
3. Гидролиз соли СН3СOONН4, образованной слабым основанием и слабой кислотой.
В процессе гидролиза солей, образованных слабыми основаниями и слабыми кислотами, принимают участие оба иона. Гидролиз идет необратимо и до конца. Водный раствор имеет реакцию, близкую к нейтральной, так как образующиеся в результате уксусная кислота и гидроксид аммония – электролиты почти равной силы.
Источник
§ 20. Подавление и усиление гидролиза солей
В некоторых случаях явление гидролиза мешает проведению анализа, поэтому необходимо знать способы усиления и подавления гидролиза.
Усилить или подавить гидролиз можно тремя способами:
1) прибавлением к раствору соли другого гидролизующегося электролита, кислоты или щелочи;
2) изменением концентрации раствора соли;
3) повышением или понижением температуры раствора соли.
Для усиления гидролиза соли, образованной катионом слабого основания и анионом сильной кислоты, необходимо добавить основание для связывания получающихся в процессе гидролиза ионов водорода:
Kt+ + HOH 5=± KtOH + H+
При добавлении основания произойдет нейтрализация кислоты и динамическое равновесие сдвинется вправо, т. е. гидролиз усилится. Если же к раствору гидролизующейся соли типа NH4Cl прибавить кислоты, то гидролиз затормозится.
Чтобы усилить гидролиз соли, образованной анионом слабой кислоты и катионом сильного основания (например, CH3COONa), необходимо связать свободные ионы гидроксила, получающиеся в процессе гидролиза:
Прибавление кислоты приводит к нейтрализации основания и динамическое равновесие сдвигается вправо, т. е. гидролиз усиливается. Если к раствору гидролизующейся соли рассматриваемого типа прибавить основание, то гидролиз замедлится.
Связать ионы водорода или гидроксила можно добавлением не только щелочей или кислот, но и других электролитов. Этими методами часто пользуются, когда нужно усилить или подавить гидролиз. Ионы водорода можно связать в сложные анионы (НСОз, НРОГ», H2POI и др.) или в нейтральные молекулы слабых кислот (H2CO3, H3BO3, CH3COOH и др.), действуя на растворы гидролизующихся солей солями сильных оснований и слабых кислот, например Na2CO3:
HCO8″+ H+ —> H2CO3 ^zt H2O+ CO3
Ионы гидроксила можно связывать в комплексные ионы [Co(OH)]+ [Al(OH)]++ [Al(OH)2]+ и др. или в нейтральные молекулы слабых оснований, действуя на растворы гидролизующихся солей солями слабых оснований и сильных кислот.
Зависимость гидролиза от концентрации и температуры раствора. С разбавлением растворов солей степень гидролиза, как правило, увеличивается (табл. 4). Нагревание также способствует усилению гидролиза, так как Kw увеличивается с температурой.
Ступенчатый гидролиз солей, образованных многоосновными кислотами или основаниями, идет преимущественно по первой ступени. Чем слабее основание и кислота или чем меньше растворимость продуктов гидролиза, тем полнее протекает гидролиз.
Нацример, гидролиз Fe(CH3COO)3 на холоду протекает с образованием Fe(OH)(CH3COO)2. При кипячении раствора Fe(CH3COO)3 выпадает осадок Fe(OH)2(CH3COO).
При кипячении растворов Na3AlO3 и Na^CrO3 алюминат остается в растворе, а хромит гидролизуется с образованием Cr(OH)3-
Подобно гидролизу, наблюдающемуся в водных растворах, соли также подвергаются сольволизу в неводных растворах. Сольволизом в неводных растворах назы-
Формулы для вычисления ^Сгидр.» ^гидр. и сьГИдр# в растворах гидролизующихся бинарных солей
*гндр.(концентрация гидролизованиой части соли)
Соль, образованная катионом слабого основания и анионом сильной кислоты (типа NH4CI)
Соль, образованная катионом сильного основания и анионом слаО*ой кислоты (типа CH3COONa)
Соль, образованная катионом слабого основания и анионом слабой кислоты (типа
Источник
Гидролиз сульфида бария
Общие сведения о сульфиде бария
Молярная масса – 169г/моль. Представляет собой бесцветные кристаллы.
Гидролиз сульфида бария
Гидролизуется по аниону. Характер среды – щелочной. Теоретически возможна вторая ступень. Уравнение гидролиза выглядит следующим образом:
BaS ↔ Ba 2+ + S 2- (диссоциация соли);
S 2- + HOH ↔ HS — + OH — (гидролиз по аниону);
Ba 2+ + S 2- + HOH ↔ HS — +Ba 2+ +OH — (уравнение в ионной форме);
2BaS +2H2O ↔ Ba(HS)2 + Ba(OH)2↓ (уравнение в молекулярной форме).
Ba(HS)2↔ Ba 2+ +2HS — (диссоциация соли);
HS — + HOH ↔H2S↑ + OH — (гидролиз по аниону);
Ba 2+ + 2HS — + HOH ↔ H2S↑ + Ba 2+ + OH — (уравнение в ионной форме);
Ba(HS)2+ 2H2O ↔ 2H2S↑ + Ba(OH)2↓ (уравнение в молекулярной форме).
Примеры решения задач
| Задание | При прокаливании 15 г сульфида бария, содержащего 7% примесей, на воздухе получили сульфат бария. Определите его массу. |
| Решение | Запишем уравнение реакции: |
Найдем массовую долю чистого (без примесей) сульфида бария:
ω(BaS) = 100% — ωimpurity = 100-7 = 93% =0,93.
Найдем массу сульфида бария, не содержащего примесей:
m(BaS) = mimpurity(BaS)×ω(BaS) = 15×0,93 = 13,95г.
Определим количество молей сульфида бария не содержащего примеси (молярная масса – 169 г/моль):
υ (BaS) = m (BaS)/ M(BaS) = 13,95/169 = 0,08моль.
Согласно уравнению υ (BaS) = υ (BaSO4) =0,08 моль. Найдем массу сульфата бария (молярная масса – 233 г/моль):
| Задание | Смесь, состоящую из 18 г сульфата бария и кокса, прокалили. В результате реакции были получены сульфид бария и угарный газ. Рассчитайте массы продуктов реакции. |
| Решение | Запишем уравнение реакции взаимодействия сульфата бария и кокса: |
BaSO4 + 2С = BaS + 4CO↑.
Найдем количество вещества сульфата бария используя данные, указанные в условии задачи (молярная масса – 233 г/моль):
υ(BaSO4) = υ (BaS) =0,08 моль;
υ(CO) = υ(BaSO4) / 4 = 0,08/4 = 0,02 моль.
Найдем массы продуктов реакции. Молярная масса сульфида бария равна 169 г/моль, угарного газа – 28 г/моль.
m(BaS)= υ(BaS)×M(BaS)= 0,08×169 = 13,52г;
m(CO)= υ(CO)×M(CO)= 0,02×28 = 0,56г.
| Понравился сайт? Расскажи друзьям! |