ГК «Униконс»
Продвижение и реализация комплексных пищевых добавок, антисептиков и др. продукции.
«Антисептики Септоцил»
Септоцил. Бытовая химия, антисептики.
«Петритест»
Микробиологические экспресс-тесты. Первые результаты уже через 4 часа.
«АльтерСтарт»
Закваски, стартовые культуры. Изготовление любых заквасок для любых целей.
- Вы здесь:
- Библиотека технолога
- Пиво и напитки
- Г.С. Качмазов — Дрожжи бродильных производств
5. МЕТОДЫ СТЕРИЛИЗАЦИИ ПОСУДЫ И ПИТАТЕЛЬНЫХ СРЕД
Основываясь на влиянии внешних условий на микроорганизмы, в микробиологической практике разработан ряд приемов, приводящих микроорганизмы к гибели. Одним из таких приемов является стерилизация.
Под стерилизацией (обеспложиванием) понимают полное уничтожение микроорганизмов и их спор в питательных средах, посуде, на инструментах и других предметах лабораторного оборудования. Для их стерильности наиболее часто пользуются воздействием высокой температуры.
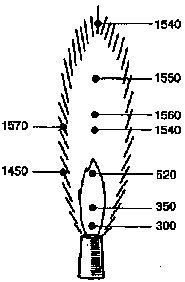
5.1. СТЕРИЛИЗАЦИЯ ОБЖИГАНИЕМ НА ПЛАМЕНИ ГОРЕЛКИ
Небольшие стеклянные (палочка, шпатель) и металлические (игла, петля, пинцет, скальпель) предметы проводят несколько раз через пламя горелки. Стерилизация достигается обугливанием находящихся на их поверхности микроорганизмов. Обжиганием на пламени пользуются и для стерилизации поверхности ватных пробок.
Рис. 14
Значение температуры в разных
участках пламени газовой горелки
5.2. СТЕРИЛИЗАЦИЯ КИПЯЧЕНИЕМ
Стерилизацию металлических инструментов и резиновых трубок проводят кипячением. Так как споры некоторых бактерий сохраняют жизнеспособность при кипячении в воде в течение нескольких часов, то рекомендуется стерилизацию кипячением проводить в 2%-ном растворе карбоната натрия в течение 10 мин. В этих условиях споры погибают.
5.3. СТЕРИЛИЗАЦИЯ СУХИМ ЖАРОМ
Сухим жаром стерилизуют стеклянную посуду. При этом пробирки, колбы предварительно закрывают ватными пробками. Чтобы избежать заражения простерилизованных предметов из воздуха, их перед стерилизацией заворачивают в оберточную бумагу и вынимают только перед работой.
Пипетки перед стерилизацией с концов закрывают ватой. Затем их обертывают длинными полосками бумаги шириной 3,5–4 см. Бумагу наматывают по спирали, начинная с конца пипетки, который будет погружен в среду. Концы обертки закрепляют ниткой. Тонкие пипетки обертывают бумагой вместе по несколько штук.
Чашки Петри заворачивают в бумагу в форме квадрата, сторона которого приблизительно равна трем диаметрам чашки. Чашку Петри помещают на середину листа, загибают его с двух противоположных сторон кверху так, чтобы края налегали друг на друга. Два свободных конца загибают вниз. При таком обертывании у чашек легко различать верх и низ.
Подготовленную таким образом посуду помещают в сушильный шкаф, в котором нагревают ее при температуре 160–170°С в течение 2 ч (с момента установления нужной температуры). При таком нагревании погибают не только бактерии, но и их споры.
Температуру в сушильном шкафу выше 175°С допускать не следует, так как при этом ватные пробки буреют, а бумажная обертка становится ломкой.
5.4. СТЕРИЛИЗАЦИЯ ТЕКУЧИМ ПАРОМ (ДРОБНАЯ СТЕРИЛИЗАЦИЯ), ИЛИ ТИНДАЛИЗАЦИЯ
Питательные среды, воду, резиновые трубки и другие предметы, портящиеся от действия сухого жара, и питательные среды, портящиеся под действием высокой температуры (среды, содержащие молоко, солод, желатину), обеспложивают действием текучего пара.
Стерилизацию текучим паром производят в кипятильнике Коха или в автоклаве с открытым вентилем. Воду в них доводят до кипения, и образующийся пар обтекает стерилизуемые объекты. Температура стерилизуемых питательных сред достигает 100°С. Нагревание в течение 30–45 мин приводит к гибели вегетативных клеток бактерий, но споры их не погибают. Затем жидкость охлаждают до температуры, благоприятной для прорастания спор (до 30°С). Нагревание приводит к активации спор и более быстрому их прорастанию. На следующий день нагревание повторяют. При этом погибают вегетативные клетки, развившиеся из спор. Для обеспечения полной стерильности жидкость оставляют еще на сутки и снова повторяют нагревание. Такую стерилизацию называют дробной или тиндализацией.
5.5. ПАСТЕРИЗАЦИЯ
В основе пастеризации лежит нагревание жидкостей до температуры меньше 100°С. Целью ее является уничтожение неспороносных бактерий в жидкостях, теряющих питательные свойства при кипячении (молоко, пиво, вино и др.). Осуществляется пастеризация путем нагревания жидкостей при 60°С в течение 30 мин, или при 75°С в течение 15 мин, или при 80°С в течение 10 мин.
5.6. ХОЛОДНАЯ СТЕРИЛИЗАЦИЯ
Органические жидкости, не выносящие нагревания, освобождают от бактерий, пропуская через стерильные мелкопористые фильтры. Эти фильтры задерживают микроорганизмы, их называют бактериальными фильтрами.
Бактериальные фильтры имеют разные номера. Фильтры № 1 имеют средний диаметр пор 0,3 мкм и являются наиболее надежными. Фильтры № 5 имеют самые большие отверстия пор, диаметром 1,2 мкм.
Перед употреблением мембранные фильтры стерилизуют кипячением. Фильтры помещают в теплую дистиллированную воду и кипятят 30 мин, меняя 2– 3 раза воду.
5.7. СТЕРИЛИЗАЦИЯ ПАРОМ ПОД ДАВЛЕНИЕМ (АВТОКЛАВИРОВАНИЕ)
Наиболее надежным и универсальным методом стерилизации питательных сред и материалов является стерилизация их насыщенным паром под давлением. Производят ее в автоклаве, в котором стерилизуемые объекты нагревают чистым насыщенным паром при давлении выше атмосферного. Когда насыщенный пар встречается с более холодным объектом, он конденсируется, превращаясь в воду. При конденсации выделяется большое количество теплоты, и температура стерилизуемого объекта быстро повышается.
Полная стерилизация питательных сред при 120°С и давлении 0,1 МПа обеспечивается нагреванием в течение 20 мин.
5.7.1. ПРАВИЛА РАБОТЫ С АВТОКЛАВОМ
Стерилизация в автоклаве производится при повышенном давлении, поэтому работа с ним требует определенной осторожности. Исправность автоклава в определенные сроки проверяют специалисты, которые устанавливают следующий срок проверки.
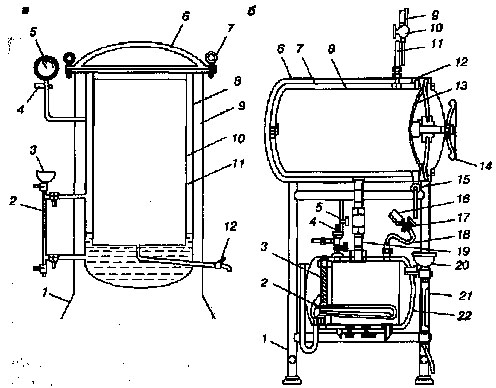
Системы автоклавов различаются, но все они имеют общие принципы устройства (рис. 15), и правила работы с ними однотипны.
Во внутренний котел автоклава (стерилизационную камеру) помещают материал, подлежащий стерилизации.
В водопаровую камеру наливают воду с таким расчетом, чтобы уровень ее в водомерной трубке был между верхней (максимальной) и нижней (минимальной) чертой.
Рис. 15
Устройство автоклавов:
а – вертикальный автоклав: 1 – подставка, 2 – водомерная трубка, 3 – воронка, 4 – предохранительный клапан, 5 – манометр, 6 – крышка, 7 – винтовые зажимы, 8 – котел, 9 – кожух, 10 – камера стерилизации, 11 – водопаровая камера, 12 – паровыпускной клапан;
б – горизонтальный автоклав: 1 – постамент, 2 – нагревательный элемент. 3 – крышка котла, 4 – предохранительный клапан, 5 – вентиль, 6 – кожух, 7 – паровая камера, 8 – стерилизационная камера, 9 – манометр паровой камеры, 10 – трехходовой кран, 11 – сифонная трубка паровой камеры, 12 – опорное кольцо, 13 – крышка паровой камеры, 14 – штурвал, 15 – впускной кран,
16 – манометр котелка, 17 – трехходовой кран котелка, 18 – сифонная трубка котелка, 19 – патрубок, 20 – воронка, 21 – водоуказательная колонка, 22 – котелок.
Крышку автоклава привинчивают болтами к корпусу. Завинчивают болты попарно, крест-накрест, чтобы избежать перекоса крышки, который может возникнуть при завинчивании болтов по кругу.
Открывают краны и включают источник обогрева. Когда пар из выпускного крана начинает выходить непрерывной струей, его закрывают и наблюдают за постепенным повышением давления в рабочей камере по манометру.
Отсчет времени стерилизации начинают с того момента, когда в автоклаве установится заданное давление.
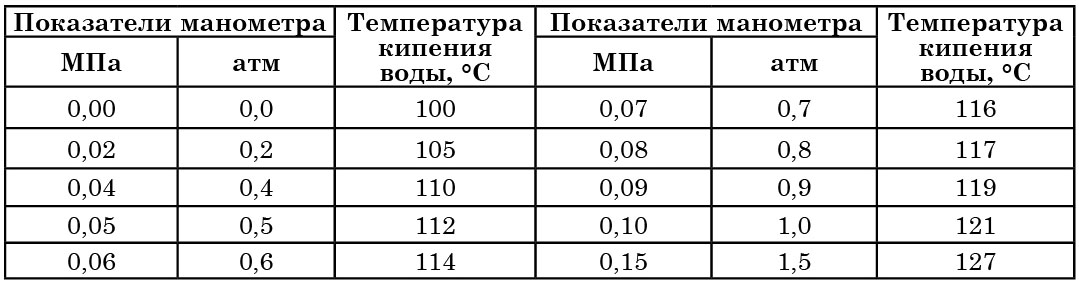
Зависимость давления и температуры в камере автоклава
Между показаниями манометра и температурой кипения воды имеется определенная зависимость (табл. 5). Время от времени эти соотношения следует проверять. Нарушение их указывает на неисправность автоклава и на необходимость его ремонта.
Проверку осуществляют следующим образом: в стерилизационную камеру автоклава помещают 100 г бензойной кислоты с добавлением небольшого количества фуксина или метиленового синего. Если при показании манометра в 0,1 МПа бензойная кислота расплавится, образуя с красителем сплав, то, значит, автоклав дает нужную температуру (120°С).
После окончания заданного срока стерилизации источник нагрева выключают, перекрывают вентиль водопаровой камеры и только после этого постепенно открывают выпускной клапан. При быстром выпускании пара могут быть вырваны ватные пробки из стерилизуемой посуды.
После полного выхода пара отвинчивают болты крышки (снова крест-накрест) и открывают ее, ориентируя крышку на себя для защиты от выходящего пара.
Если во время стерилизации давление начинает подниматься выше заданного уровня, его регулируют, уменьшая нагрев или выпуская часть пара через предохранительный клапан. Последний должен быть отрегулирован так, чтобы при повышении давления излишек пара выходил автоматически.
Источник
Стерилизация питательных сред и оборудования
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
Пермский государственный университет
Кафедра физиологии растений
И микроорганизмов
МАЛЫЙ ПРАКТИКУМ ПО МИКРОБИОЛОГИИ
Учебно-методическое пособие
Пермь 2000
Составители: д-р биол. наук В.Г. Ременников,
асп. И.О. Мартыненко
УДК 576.8
Малый практикум по микробиологии: Учебно-метод. пособие /Перм. ун-т; Сост. В.Г. Ременников, И.О. Мартыненко. — Пермь, 2000 — 55 с.
Издание содержит краткие сведения об объектах микробиологии, описание основных методов и приемов работы с микроорганизмами, а также изложение методов микроскопического анализа, принципов составления питательных сред и условий культивирования микроорганизмов и способов стерилизации. Оно составлено в виде серии лабораторных задач, предлагаемых студентам для самостоятельной работы.
Цель издания – помочь студентам в приобретении навыков лабораторной работы с микроорганизмами.
Предназначено студентам биологического факультета, обучающимся по специальностям «Биология» и «Экология».
Ил. 8. Табл. 2. Библиогр. 9 назв.
Печатается по постановлению методической комиссии биологического факультета Пермского университета.
В настоящее время микробиология является одной из основных биологических дисциплин, без знания которой нельзя понять всего многообразия жизни на Земле, условий ее появления и эволюции. Поэтому роль микробиологии в подготовке специалистов-биологов весьма велика. Формирование эволюционного взгляда на жизнь, ее разнообразие и единство невозможно без тех сведений, которые дает современная наука о мире микробов.
Микробиология играет важную роль в разработке способов рационального использования биохимической активности микроорганизмов для повышения плодородия почв, добычи полезных ископаемых, восполнения энергетических ресурсов и очистки окружающей среды от многих загрязняющих веществ. Возникновение и быстрое развитие биотехнологии, приобретающей все большее значение в народном хозяйстве, базируются, прежде всего, на использовании микроорганизмов как продуцентов множества полезных веществ. Вместе с тем остается необходимым изыскание эффективных способов борьбы с микроорганизмами, вызывающими заболевания человека, животных и растений, а также порчу промышленных продуктов.
Таким образом, круг проблем, требующих интенсивного, глубокого изучения свойств микроорганизмов, весьма широк. Они могут быть решены совместной работой специалистов разных профилей, хорошо знакомых также с биологией этих мельчайших живых существ, которые широко используются для решения проблем не только микробиологии, но и других областей науки.
-4-
Общие указания к проведению практических занятий
Практические занятия должны быть тесно связаны с теоретическим курсом микробиологии. Здесь студенты закрепляют полученные теоретические знания, осваивают методы микробиологического исследования и правила работы с культурами микроорганизмов. Следует экономно расходовать реактивы, бережно относиться к лабораторному оборудованию, не нарушать требования техники безопасности: при выполнении заданий работать в халате, соблюдать тишину, не принимать пищу; необходимо иметь при себе цветные карандаши и тетрадь для записи. Каждый студент на протяжении всех занятий работает на постоянном месте, с одним и тем же микроскопом имеющим порядковый номер и готовит препараты самостоятельно.
В целях правильного понимания основных задач практикума перед каждым занятием дается краткое объяснение общих положений по данной теме и подробное описание методик и приемов для проведения наблюдений. Индивидуальная работа осуществляется преподавателем с каждым студентом по мере выполнения задания. Он следит за тем, как студенты выполняют задание, и в случае необходимости оказывает им помощь. Хорошо выполненные препараты следует рекомендовать для ознакомления всем студентам и требовать их качественного выполнения каждым студентом. Для проверки усвоения студентами пройденного материала и закрепления навыков лабораторной работы проводится семинар, а на последнем практическом занятии им предоставляется возможность провести комплексный микроскопический анализ бактериальных культур, которые выделяются каждым студентом самостоятельно.
Для проведения практических занятий лаборант заранее готовит необходимый материал. Приборы, реактивы, инструменты на рабочем столе должны быть расставлены с учетом правил техники безопасности. После каждого занятия следует привести свое рабочее место в порядок, а отработанные препараты обязательно сложить в склянку с дезинфицирующим раствором.
Целесообразно в конце занятия сообщать тему следующего практического занятия и указывать нужные литературные источники.
-5-
Питательные среды
Любая микробиологическая работа связана с приготовлением питательных сред, которые необходимы для выделения, накопления и сохранения микроорганизмов, а также для выращивания культур с целью изучения их обмена веществ или получения ценных продуктов метаболизма. Среда должна включать все компоненты, необходимые для конструктивных и энергетических процессов клетки, которые крайне разнообразны, поэтому столь же разнообразны и потребности микроорганизмов в питательных веществах. Разнообразие сред проявляется, прежде всего, в отношении микроорганизмов к источнику углерода, что определяет специфику сред и позволяет разделить микроорганизмы на две большие группы — автотрофы и гетеротрофы.
Автотрофные микроорганизмы способны использовать в качестве единственного источника углерода СО2 воздуха, тогда как потребности в углероде гетеротрофных микроорганизмов такими соединениями не могут быть удовлетворены. Для их развития среда должна содержать более восстановленные соединения углерода, которые в зависимости от физиолого-биохимических особенностей организма могут быть представлены различными органическими соединениями. При этом потребности некоторых микроорганизмов могут быть удовлетворены широким набором органических веществ, тогда как другие характеризуются высокой специализацией и способностью использовать лишь немногие соединения углерода.
Неодинаковы требования микроорганизмов и к источнику азота. Для культивирования микроорганизмов, фиксирующих молекулярный азот, используют среды, не содержащие его соединений. В состав всех других сред входят различные азотсодержащие соединения. Это могут быть нитраты и соли аммония, аминокислоты или белки. Потребности значительного числа микроорганизмов в азоте могут быть удовлетворены нитратами. Однако в отличие от солей аммония в качестве источника азота они почти не употребляются, так как при использовании аниона в среде накапливаются катионы калия или натрия, которые токсичны для многих микроорганизмов. Для культивирования микроорганизмов, более требовательных к азоту и соответственно обладающих меньшими синтетическими способностями, питательные среды должны включать одну, несколько или полный набор аминокислот. Аминокислоты — цистин, цистеин, глутамин и аспарагин неустойчивы к нагреванию, поэтому их стерилизуют фильтрацией, остальные
же аминокислоты можно стерилизовать в автоклаве при 0,5 атм в течение 15 мин. Для обеспечения микроорганизмов полным набором аминокислот и витаминами в среду добавляют гидролизат белка, для приготовления которого используют белки животного (мясо), растительного (семена сои) или микробного (дрожжи) происхождения. Гидролиз проводят с помощью протеолитических ферментов или кипячением с минеральными кислотами.
Состав гидролизатов неодинаков и зависит от исходного субстрата, а также способа получения.
Кроме источников углерода, азота и факторов роста (витамины, аминокислоты) для построения веществ клетки необходимы сера, фосфор и ряд других элементов. Потребности разных групп микроорганизмов в этих элементах удовлетворяются за счет минеральных солей. Поэтому минеральный фон сред для культивирования микроорганизмов разных физиологических групп может быть близким по составу.
Питательные среды для культивирования микроорганизмов кроме соединений, необходимых для биосинтеза, должны включать и источники энергии. По этой причине все микроорганизмы делят на хемотрофы, использующие органические (органотрофы) и неорганические (литотрофы) соединения, и фототрофы, использующие энергию солнечного света.
Однако какой бы полноценной и была среда, ее компоненты могут быть недоступны для клетки, если активная кислотность среды (рН) не соответствует значениям, при которых возможно развитие изучаемых организмов. Поэтому после приготовления среды необходимо проверить рН и довести его с помощью щелочей или кислот до нужного значения.
По химическому составу среды делятся на естественные или натуральные неопределенного состава и синтетические, имеющие определенный химический состав.
Натуральные среды состоят из продуктов животного или растительного происхождения. К ним относятся овощные или фруктовые соки, отвары и экстракты, полученные из природных продуктов таких, как мясо или почва. На натуральных средах хорошо развиваются многие микроорганизмы, поскольку такие среды содержат все компоненты, необходимые для их роста. Однако эти среды имеют сложный состав и мало пригодны для изучения обмена веществ микроорганизмов, так как в них трудно определять потребление составных компо-
нентов и образование продуктов метаболизма. Натуральные среды используются главным образом для получения накопительных культур микроорганизмов. К числу наиболее применяемых сред относятся мясопептонный бульон, пивное сусло, дрожжевые и картофельные среды, почвенный экстракт.
Мясопептонный бульон (МПА) готовится следующим образом: 500 г мяса, очищенного от костей и жира, пропущенного через мясорубку, заливают 1 л водопроводной воды и оставляют при комнатной температуре на 12 ч или на 2 ч в термостате при температуре 37°С. За это время из мяса экстрагируются различные вещества, в том числе и растворимые в воде витамины. Затем мясо отжимают через марлю, и полученный настой кипятят 30 мин. Остывший бульон фильтруют через ватный фильтр и добавляют в него 1% — ный раствор пептона и 0,5% — ный раствор хлористого натрия. Данная питательная среда богата разнообразными питательными веществами, но почти не содержит углеводов. Поэтому при необходимости их следует добавлять к МПА. Затем среда разливается в склянки, и стерилизуются автоклавированием при 1 атм 20 мин. Она может быть использована для культивирования гетеротрофных микроорганизмов.
Пивное сусло. 250 г размолотого солода заливают 1 л водопроводной воды, нагревают до 50°С и выдерживают при данной температуре 30 мин, непрерывно перемешивая. В дальнейшем температуру поднимают до 58°С и выдерживают еще 30 мин до полного осахаривания крахмала, т.е. до тех пор, пока реакция остывшей смеси с йодом не станет отрицательной.
Экстракт фильтруют через ватный фильтр и стерилизуют при 0,5 атм 20 мин в автоклаве. Среда используется для культивирования бактерий, дрожжей, плесневых грибов, использующих сахара.
Дрожжевая среда готовится из 100 г свежих дрожжей, растворенных в 1 л водопроводной воды, которые кипятят 30 мин. После осаждения клеток дрожжей жидкость отфильтровывают через ватный фильтр. К полученному фильтрату добавляют еще 1 л воды, вновь кипятят 30 мин и опять фильтруют. Затем к среде добавляют 2% — ный раствор углеводов, 0,1% — ный раствор К2HPO4 и 0,5% — ный раствор хлористого натрия, рН доводят до 7,0 и стерилизуют 30 мин при 1,5 атм. Среда используется для культивирования гетеротрофных микроорганизмов.
Картофельная среда готовится из 200 г очищенного, вымытого и нарезанного мелкими ломтиками картофеля и 1 л воды. После 30
мин кипячения отвар фильтруют и стерилизуют 30 мин при 1,5 атм. Среда используется для культивирования амилолитических бактерий.
Почвенная вытяжка. Для ее приготовления 1 кг почвы заливают 1 л водопроводной воды и кипятят 30 мин. Затем остывшую вытяжку центрифугируют и полученный экстракт стерилизуют при 1,5 атм 30 мин. Среда используется для выделения почвенных микроорганизмов.
Синтетические среды — это среды, в которые входят лишь соединения определенного химического состава, взятые в точно указанных количествах. Однако некоторые микроорганизмы для своего развития требуют витаминов, что обеспечивается в результате добавления небольшого количества веществ неопределенного состава (дрожжевой экстракт). Такие среды принято называть полусинтетическими. Синтетические и полусинтетические среды широко используются при исследовании обмена веществ, физиологии и биохимии микроорганизмов.
По физическому составу различают жидкие, плотные и сыпучие среды. Жидкие среды широко применяются для накопления биомассы или продуктов обмена, для исследования физиологии и биохимии микроорганизмов, а также для поддержания и сохранения культур, плохо развивающихся на плотных средах. Сыпучие среды применяют главным образом в промышленной микробиологии. К ним относятся разваренное пшено, отруби, кварцевый песок, пропитанный питательным раствором. Плотные среды используются для выделения чистых культур, в диагностических целях для описания колоний, для определения количества микроорганизмов и их антибиотической активности, для хранения культур.
Агар представляет собой сложный полисахарид, наиболее широко применяемый для уплотнения сред. В его состав входят агароза и агаропектин. Агар получают из морских водорослей. Он удобен тем, что большинство микроорганизмов не используют его в качестве субстрата для роста. В водной среде он образует гель, который плавится при температуре 100°С и затвердевает при 40°С. Поэтому на агаризованных средах можно культивировать большинство микроорганизмов.
Для уплотнения в среду добавляют 1,5% агара и нагревают до полного его растворения, фильтруют, разливают в склянки и стерилизуют. Для выращивания микроорганизмов в чашках Петри расплавленная среда с агаром разливается в стерильные чашки по 20 мл, после
затвердевания среды делается посев микроорганизмов. Следует учитывать, что при остывании агаризованных сред образуется конденсационная вода. Поэтому для получения изолированных колоний микроорганизмов чашки со средой помещают в термостат крышками вниз. В противном случае на внутренней стороне крышки скапливается конденсат, который, стекая на поверхность среды, мешает получению изолированных колоний.
Агар включает небольшое количество легко ассимилируемых органических и минеральных веществ, которые иногда нежелательны для проведения опытов. Поэтому для удаления этих веществ агар перед добавлением к питательной среде заливают водопроводной водой и выдерживают при 37°С в термостате. Примеси вымываются водой и разлагаются под действием развивающихся в ней микроорганизмов. Когда вода помутнеет, ее заменяют новой и так повторяют до тех пор, пока не исчезнет запах и вода не перестанет мутнеть. Обычно через 2-3 недели получают агар, лишенный растворимых органических и минеральных веществ. Такой агар принято называть выщелоченным агаром.
Желатин – это белок, полученный путем вываривания костей и хрящей животных. Образуемый желатином гель плавится при 23-26°С, что ниже обычной температуры инкубации многих микроорганизмов. Кроме того, желатин разлагается многими протеолитическими ферментами, выделяющимися в среду некоторыми микроорганизмами. Эти свойства желатина сильно ограничивают его применение в качестве уплотнителя сред. Поэтому его используют, главным образом, для определения протеолитической активности микроорганизмов. Желатин добавляют к жидким средам в количестве 15%. Повторная стерилизация желатиновых сред, особенно при рН ниже 6,0 или выше 7,3, не рекомендуется, так как желатин при этом теряет способность образовывать гель.
Стерилизация питательных сред и оборудования
Микробиолог имеет дело преимущественно с чистыми культурами микроорганизмов, которые представляют собой потомство одной клетки. Поскольку в воздухе и на поверхности предметов всегда присутствует большое количество разнообразных микроорганизмов, следует постоянно заботиться о сохранении чистоты изучаемых культур. Поэтому при работе в микробиологической лаборатории необходимо строго соблюдать определенные правила, обеспечивающие стерильность сред и чистоту изучаемых объектов.
Стерилизация в переводе с латинского означает «обеспложивание». В микробиологии под стерилизацией понимают гибель всех живых микроорганизмов. Для этой цели стерилизуют среды, посуду и инструменты, чтобы не допустить развития посторонней микрофлоры в исследуемых культурах.
Питательные среды стерилизуют главным образом автоклавированием. Этот способ основан на прогревании субстрата насыщенным паром при давлении выше атмосферного. При совместном действии высокой температуры и давления, возникающего при автоклавировании, погибают вегетативные формы и споры микроорганизмов. Автоклавирование проводят в различных режимах. Когда указывается режим стерилизации в единицах давления: 0,5; 1,0; 1,5 атм, имеют в виду дополнительное давление. Условия повышенного давления пара создают в специальных герметически закрывающихся толстостенных аппаратах — автоклавах, с устройством и работой которых студенты знакомятся на практических занятиях.
Среды, предназначенные для стерилизации в автоклаве, наливают не выше половины высоты сосуда, который закрывают ватной пробкой. Пробки должны быть достаточно плотными и в то же время хорошо пропускать воздух. Нельзя обертывать пробки целлофаном или другими материалами, не пропускающими пар, который должен обязательно проникать через пробку в сосуд, иначе среда не прогреется до нужной температуры и не простерилизуется. Режим автоклавирования определяется прежде всего составом питательной среды. Среды, содержащие вещества, не выдерживающие нагревания до 120°С, стерилизуют при 0,5 атм. К таким средам относится молоко, дрожжевой автолизат и среды с желатином, стерилизация которых не должна превышать 15 мин. Среды, содержащие сахара и витамины,
например сусло и соки, стерилизуют 20-30 мин. Мясопептонный бульон и мясопептонный агар автоклавируют при 1 атм. 20-30 мин, картофельную среду и почвенную вытяжку при 1,5 атм. 30 мин.
Выбирая режим стерилизации, необходимо учитывать рН среды. В кислых условиях при стерилизации могут подвергнуться гидролизу полимеры, а в щелочных — выпасть в осадок соли железа. Поэтому, чтобы избежать этих явлений, среды, предназначенные для культивирования кислотолюбивых или щелочнолюбивых микроорганизмов, стерилизуют при нейтральном значении рН и только после автоклавирования подкисляют или подщелачивают среду до нужного значения.
Стеклянная посуда, используемая в микробиологических исследованиях, стерилизуется горячим воздухом в сушильных шкафах при 160-180°С в течение 2 ч. При этом погибают вегетативные клетки и споры микроорганизмов. Посуду перед стерилизацией тщательно моют, сушат и заворачивают в бумагу для сохранения стерильности после прогревания. Чашки Петри завертывают парами, пипетки и шпатели — по отдельности, колбы и пробирки закрывают пробками, на которые надевают бумажные колпачки. Посуду, подготовленную для стерилизации, загружают в сушильный шкаф не слишком плотно, чтобы не затруднять циркуляцию воздуха и обеспечить равномерный прогрев стерилизующегося материала.
Приготовление реактивов
Прежде чем готовить рабочие растворы красок, заблаговременно готовят их насыщенные спиртовые растворы. Для этого краски заливают этиловым спиртом в соотношении 1:10 и выдерживают в термостате до полного растворения красок. При этом нерастворимая часть красок выпадает в осадок и её отфильтровывают. Из насыщенных растворов в дальнейшем готовят рабочие растворы.
Фуксин основной — солянокислая соль розанилина, блестящие зеленые кристаллы, хорошо растворимые в этиловом спирте и плохо в воде; цвет спиртового раствора ярко-красный. Насыщенный раствор готовят в результате растворения в 100 мл этилового спирта 10 г сухого основного фуксина. Из него готовят рабочий раствор в результате смешивания 10 мл со 100 мл воды.
Фуксин карболовый (Циля). Для приготовления берут 10 мл
насыщенного спиртового раствора основного фуксина и 100 мл 5%-
ного водного раствора фенола.
Водный раствор при постоянном взбалтывании постепенно приливают к первому, а не наоборот. После смешивания готовый раствор фильтруют через бумажный фильтр и хранят в тщательно упакованной бутыли из темного стекла.
Карболовый фуксин Циля можно приготовить и по следующему рецепту: 1 г основного кристаллического фуксина, 5 г кристаллического фенола, несколько капель глицерина, 10 мл этилового спирта, 100 мл воды. Сначала краски смешивают и растирают в ступке, добавляя по каплям глицерин. Затем, при постоянном перемешивании, по каплям добавляют спирт, постепенно увеличивая порции, а после этого, начиная с малых порций, добавляют воду. Приготовленный в ступке раствор выдерживают 46 ч в термостате при 37°С для полного растворения фуксина, после чего фильтруют через бумажный фильтр. Краска довольно стойкая и может храниться длительное время. Она употребляется при работе с трудноокрашиваемыми объектами — кислотоустойчивые и спорообразующие бактерии.
Раствор Люголя. Основная составная часть данного раствора – кристаллический иод. Для его приготовления берут 1 г кристаллического йода и 2 г йодистого калия, растворяют в 300 мл дистиллированной воды. Йод плохо растворяется в воде, поэтому необходимо сначала в 5-10 мл воды растворить йодистый калий, затем прибавить кристаллический йод и только после полного растворения йода добавить дистиллированную воду, доводя объем до 300 мл. Раствор фильтруют и хранят в темной склянке в прохладном месте. Применяется для окраски бактерий по Граму.
Метиленовый синий (раствор Леффлера)— мелкие зеленые кристаллы с металлическим блеском, хорошо растворимые в спирте и воде; цвет раствора синий. К 30 мл насыщенного спиртового раствора метиленового синего (7 г на 100 мл спирта) добавляют 100 мл дистиллированной воды и 1 мл 1%-ного водного раствора едкого кали (или едкого натра). Раствор краски может долго храниться; по истечении некоторого времени красит лучше, чем свежеприготовленный. Используется в методике окраски спор.
Генциановый фиолетовый карболовый. 1г генцианового фиолетового растворяют в 10 мл спирта, полученный раствор смешивают со 100 мл 5%-ного водного свежеприготовленного раствора фенола. Для устранения образования осадка на препарате к раствору приливают еще несколько капель спирта до исчезновения с поверхнос-
ти металлически блестящей зеленоватой пленки. Применяется в ме тодике окраски по Граму.
Кристаллический фиолетовый. 20 мг кристаллического фиолетового растворяют в 100 мл дистиллированной воды. Применяют при окраске бактерий по Граму.
Судан ш. 0,5 г судана растворяют в 100 мл концентрированной молочной кислоты. Используют для выявления липидов.
Тушь для негативной окраски капсул. Обычную тушь разводят в 10 раз дистиллированной водой и центрифугируют. Надосадочный слой сливают, разливают в пробирки и стерилизуют. Сохранность туши может быть обеспечена в результате добавления детергента (1:100) тритона-100.
Хромовая смесь применяется для мытья посуды. В концентрированную серную кислоту добавляют 5%-ного (от объема серной кислоты) размельченного в порошок кристаллического двухромовокислого калия и осторожно нагревают в фарфоровой чашке на водяной бане до его растворения. После многократного употребления темно-оранжевый цвет хромовой смеси меняется на темно-зеленый. Такая хромовая смесь не обладает моющими свойствами. Хромовой смесью не следует мыть посуду, загрязненную парафином, керосином, минеральными маслами и другими продуктами перегонки нефти. Хромовая смесь сильно разрушает ткани животного и растительного происхождения, поэтому работать с ней следует осторожно. Если хромовая смесь попала на руки или одежду, то пораженное место немедленно обмывают большим количеством воды, а затем разбавленным раствором аммиака или соды, а затем снова водой.
Спиртовый раствор КОН — также хорошее моющее средство. Его готовят растворением 50 г КОН в 500 мл воды. После остывания раствора к нему добавляют этиловый спирт, чтобы общий объем составил 1 л.
Промывка стекол. Предметные и покровные стекла считаются чистыми, когда капля воды растекается по их поверхности. Новые стекла обычно кипятят в 1% — ном растворе соды, затем промывают дистиллированной водой. Стекла, бывшие в употреблении, кипятят в мыльной воде и затем не менее суток выдерживают в растворе хромовой смеси. От бихромата стекла отмывают дистиллированной водой. Чистые стекла хранят в этиловом спирте.
Чернила по стеклу готовят в результате смешивания равных
объемов раствора фуксина (1 г растворяют в 15 мл этилового спирта) и таннина (2 г растворяют в 15 мл воды при нагревании).
Дата добавления: 2019-09-02 ; просмотров: 904 ; Мы поможем в написании вашей работы!
Источник