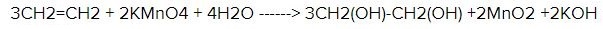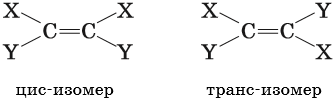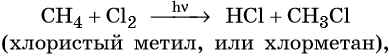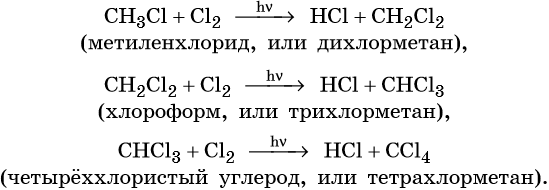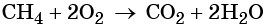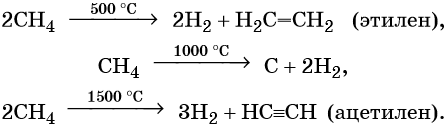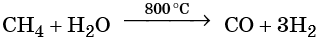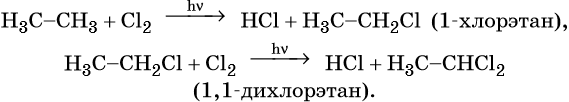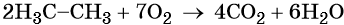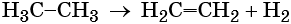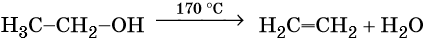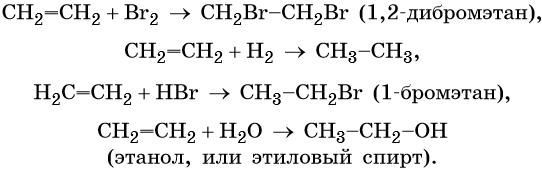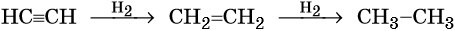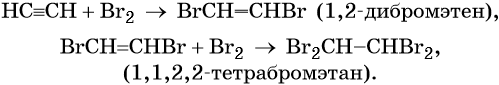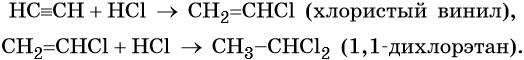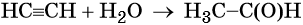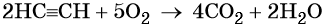Какими способами можно отличить этилен от этана?
Ну, для начала, можно выучить формулы. Этан СН3-СН3, а этилен СН2 = СН-ОН.
А если подойти серьёзнее, то этилен, к примеру, обесцвечивает бромную воду и перманганат калия из-за разрыва двойной связи. Он относится к алкенам, непредельным углеводородам. Этан же — предельный алкан, он в такие реакции не вступает.
Собственно говоря, Юлиана Романова дала правильный ответ, и моё возражение касалось только неправильной формулы. Формула этилена СН2=СН2. Действительно, для того чтобы отличить этилен от этана (оба вещества при обычных условиях — газы), их пропускают либо через бромную воду (раствор брома в воде, имеет желтовато-коричневый цвет), либо через водный раствор перманганата калия (цвет, в зависимости от концентрации от светло-розового до темно-фиолетового). Этилен реагирует с ними и обесцвечивает их. Так обесцвечивание бромной воды обусловлено тем что бром (а окраску бромной воде придает именно он) присоединяется к этилену, образуя бесцветный 1,2-дибромэтан: CH2=CH2 + Br2 ——> Br-CH2-CH2-Br. Обесцвечивание раствора перманганата калия обусловлено тем, что перманганат калия (окрашенный перманганат-ион) окисляет этилен до бесцветного этиленгликоля, и вместо розового перманганата остается бурый осадок диоксида марганца: 3 CH2-CH2 + 2 KMnO4 + 4 H2O ——> 3 HO-CH2-CH2-OH + 2 KOH + 2 MnO2.
Этан в такие реакции не вступает, поэтому обесцвечивания не происходит.
По реакции с таким элементом, как бром (не в чистом, понятно, виде, а в виде бромной воды). Получится следующее — если это этан, то изменения цвета не произойдет, так как он не обесцвечивает. А вот, если у вас оказался этилен, то тут произойдет обесцвечивание водички:
Можно еще и с перманганатом (марганцовка) калия такое же осуществить:
В восьмом классе только начинают знакомиться с химией, химическими явлениями, законами, поэтому здесь всё важно. Нужно знать язык химии,знаки химических элементов,атомно- молекулярное учение, химические формулы,валентность химических элементов, составление химических формул по валентности,знать Периодический закон Менделеева, ориентироваться по таблице Менделеева,химические связи знать: ковалентная,ионная; строение атома,строение вещества, закон Авогадро,умение решать экспериментальные задачи.
Источник
Углеводороды предельные и непредельные: метан, этан, этилен, ацетилен
Органическая химия — это химия углеводородов и их производных.
Основные положения теории строения органических соединений:
- Все атомы, образующие молекулы органического вещества, связаны в определённой последовательности согласно их валентностям.
- Свойства веществ зависят от строения молекул, т. е. свойства и строение взаимосвязаны между собой.
- Зная свойства вещества, можно установить его строение, и наоборот, химическое строение органического соединения может много сказать о его свойствах.
- Химические свойства атомов и атомных группировок не являются постоянными, а зависят от других атомов (атомных групп), находящихся в молекуле. При этом наиболее сильное влияние атомов наблюдается в случае, если они непосредственно связаны друг с другом.
Ниже приводятся основные термины, используемые в органической химии.
Изомерией называют явление существования органических соединений с одинаковым качественным и количественным составом, но с различными свойствами.
Изомерами называют химические соединения, имеющие одинаковый качественный и количественный состав, но разное химическое строение и разные свойства.
Структурной называют изомерию, вызванную наличием химических соединений с одинаковым составом, но с различным порядком связи структурных элементов. Различают изомерию углеродного скелета, изомерию положения заместителя или кратной связи.
Геометрическая, или цис-транс-изомерия, — явление существования веществ с различным расположением заместителей относительно двойной связи.
Геометрическая изомерия возможна как у соединений с двойной связью, так и у алициклических соединений.
Если одинаковые группы атомов располагаются по разные стороны от плоскости π-связи, то такие соединения называют транс-изомерами, если одинаковые группы атомов располагаются по одну сторону от плоскости -связи, то такие соединения называют цис-изомерами.
Вещества, обладающие сходным химическим строением и химическими свойствами, но отличающиеся между собой на одну или несколько CH2-групп, называют гомологами. Гомологи образуют гомологичные ряды. Свой гомологичный ряд существует для каждого класса органических соединений.
Химическую связь, максимальная электронная плотность которой находится на линии связывания ядер, называют σ-связью. Химическую связь, максимальная электронная плотность которой находится вне линии связывания ядер, называют π-связью.
В молекулах органических веществ атом углерода всегда находится в одном из трёх гибридных состояний с различными типами гибридизации:
sp 3 -гибридизация. При этой гибридизации происходит смешение одной 2s- и трёх 2p-орбиталей, в результате чего образуются четыре одинаковые sp 3 -гибридные орбитали. Валентный угол 109° 28′. Атом углерода, находящийся в состоянии sp 3 , связан с четырьмя другими атомами простыми (одинарными) связями. Все эти связи являются σ-связями.
sp 2 -гибридизация. При этой гибридизации происходит смешение одной 2s- и двух 2p-орбиталей, в результате чего образуются три одинаковые sp 2 -гибридные орбитали. Валентный угол 120°. Атом углерода, находящийся в состоянии sp 2 , связан с каким-либо другим атомом двойной связью, например: >C=C C=O; >C=N–. Одна из двойных связей является σ-связью, другая — π-связью.
sp-гибридизация. При этой гибридизации происходит смешение одной 2s- и одной 2p-орбитали, в результате чего образуются две одинаковые sp-гибридные орбитали. Валентный угол 180°. Атом углерода, находящийся в состоянии sp, связан с каким-либо другим атомом тройной связью, например: –C≡C–; –C≡N. Одна из тройных связей является σ-связью, две другие — π-связями.
Углеводородами называют органические вещества, состоящие только из углерода и водорода. По составу их классифицируют на насыщенные и ненасыщенные, по строению — на алифатические, циклические и ароматические.
Алканами называют предельные алифатические углеводороды, отвечающие общей формуле CnH2n+2, в молекулах которых атомы углерода связаны между собой простой (одинарной) σ-связью.
Родоначальником класса предельных углеводородов является метан, CH4. Он представляет собой газ без цвета и запаха, очень мало растворим в воде. Его температура кипения равна –162 °С, а температура плавления — –182 °С. Метан широко распространён в природе. Он образуется в результате разложения без доступа воздуха остатков животных и растительных организмов.
Метан — основной компонент природного газа, кроме того, его получают в качестве попутного газа при нефтедобыче.
Метан, как и другие представители предельных углеводородов, достаточно устойчивы химически. Они не взаимодействуют ни со щелочами, ни с кислотами (за исключением азотной), не реагируют с активными металлами.
Для метана прежде всего характерны реакции замещения, которые протекают по радикальному механизму. Этот механизм химической реакции подробнее изучают в курсе органической химии.
Взаимодействие метана с хлором протекает на свету или при температуре 300 °С. Иногда этот процесс может сопровождаться взрывом. При этом происходит последовательное замещение атомов водорода на хлор. В зависимости от соотношения в качестве основного продукта реакции могут образовываться различные хлорпроизводные:
При сгорании метана в кислороде или на воздухе выделяется углекислый газ, вода и значительное количество тепла:
Именно поэтому его используют в качестве дешёвого топлива.
Термическое разложение метана протекает по различным направления в зависимости от температуры:
При температуре около 800 °С в присутствии никелевого катализатора метан вступает во взаимодействие с водяными парами с образованием так называемого синтез-газа:
В дальнейшем из синтез-газа получают многочисленные продукты органического синтеза.
Этан — ближайший гомолог метана. Его брутто-формула C2H6, структурная формула H3C–CH3. Он представляет собой газ без цвета и запаха, очень мало растворим в воде. Его температура кипения равна –89 °С, а температура плавления –183 °С. Этан широко распространен в природе. В составе попутного газа встречается до 10—15% этана.
Так же, как и метан, этан вступает в реакции замещения:
На воздухе этан горит слабо светящимся пламенем:
Реакция дегидрирования, т. е. отщепление водорода, приводит к этилену:
Этан используют как исходное сырье для получения этилена, каучуков и т. д.
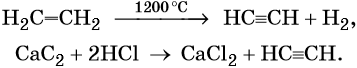
Этилен, брутто-формула C2H4, структурная формула H2C=CH2, представляет собой бесцветный газ, малорастворимый в воде. Его температура кипения равна –103,7 °С, а температура плавления –169,1 °С. Этилен в промышленности получают из этана или метана. Эти реакции были описаны выше. В лабораторной практике этилен получают с помощью реакции дегидратации (отщепления воды) от этилового спирта. Одновременно катализатором этого процесса и водоотнимающим средством является концентрированная серная кислота:
Для этилена характерны реакции присоединения. Он легко обесцвечивает раствор брома в воде или четырёххлористом углероде, присоединяет водород (реакция гидрирования), бромоводород (реакция гидробромирования) и воду (реакция гидратации):
Этилен широко применяют для синтеза различных органических веществ: этилового спирта, стирола, галогенпроизводных, полиэтилена, окиси этилена и т. д.
Ацетилен (этин), брутто-формула C2H2, структурная формула HC=CH, представляет собой бесцветный газ, немного растворимый в воде. Его температура кипения равна –83,8 °С.
Ацетилен в промышленности получают из метана (реакция описана выше) или этана. В лабораторной практике ацетилен получают с помощью реакции карбида кальция с водой или кислотами:
Для ацетилена прежде всего характерны реакции присоединения.
В присутствии катализаторов он легко присоединяет водород, образуя вначале этилен, а потом этан:
Ацетилен обесцвечивает раствор брома в воде или четырёххлористом углероде. При этом происходит последовательное присоединение брома по кратным связям:
Присоединение хлороводорода вначале приведет к образованию хлористого винила, а затем 1,1-дихлорэтана:
Ацетилен реагирует с водой с образованием уксусного альдегида (реакция Кучерова). Катализатором в данном процессе выступают соли ртути.
При сгорании ацетилена в кислороде развивается очень высокая температура, поэтому ацетилен-кислородное пламя используют для сварки и резки металлов:
Ацетилен имеет огромное значение как исходное вещество в органическом синтезе. Из ацетилена получают уксусный альдегид, который далее перерабатывают в уксусную кислоту и её различные эфиры; винилацетилен, перерабатываемый в хлоропрен и хлоропреновые каучуки; хлорвинил и поливинилхлорид; дихлорэтан, глицерин, винилацетат, поливинилацетатный клей.
Тренировочные задания
1. Для метана верны следующие утверждения:
1) его молекула образована атомом углерода в sp-гибридном состоянии
2) это низкокипящая жидкость, хорошо растворимая в воде
3) это низкокипящий газ, плохо растворимый в воде
4) является основным компонентом природного газа
5) легко реагирует с разбавленной серной кислотой
2. Для метана верны следующие утверждения:
1) его молекула образована атомом углерода в состоянии sp2-гибридизации
2) метан реагирует с парами разбавленной азотной кислоты
3) метан обладает характерным неприятным запахом
4) сгорает на воздухе с образованием угарного газа и воды
5) сгорает на воздухе с образованием углекислого газа и воды.
3. Для этана верны следующие утверждения:
1) это бесцветный газ, немного легче воздуха
2) это бесцветный газ, немного тяжелее воздуха
3) при его взаимодействии с водой образуется этиловый спирт
4) при его дегидрировании образуется этилен
5) все атомы углерода в нём — третичные
4. Для этана верны следующие утверждения:
1) оба атома углерода в его молекуле являются первичными
2) не реагирует с гидроксидом натрия
3) реагирует с серной кислотой
4) реагирует с метаном
5) обладает резким неприятным запахом
5. Для этилена верны следующие утверждения:
1) оба атома углерода в его молекуле находятся в состоянии sp2-гибридизации
2) плотность паров этилена равна плотности паров азота
3) не реагирует с водой
4) не сгорает в кислороде
5) не присоединяет хлор
6. Для этилена верны следующие утверждения:
1) при нормальных условиях это легкокипящая жидкость, хорошо растворимая в воде
2) оба атома углерода в его молекуле находятся в состоянии sp3-гибридизации
3) взаимодействует с водой с образованием уксусной кислоты
4) взаимодействует с бромной водой с образованием 1,2-дибромэтана
5) взаимодействует с водой с образованием этилового спирта
7. Для ацетилена верны следующие утверждения:
1) при нормальных условиях это газ, пары которого легче воздуха
2) при нормальных условиях это газ, пары которого тяжелее воздуха
3) не реагирует с бромом
4) реагирует с водой с образованием этанола
5) реагирует с водой с образованием уксусного альдегида
8. Для ацетилена верны следующие утверждения:
1) атомы углерода в его молекуле находятся в состоянии sp 2 -гибридизации и соединены двойной связью
2) атомы углерода в его молекуле соединены тройной связью и находятся в состоянии sp-гибридизации
3) при его сгорании в кислороде образуется угарный газ и вода
4) при его сгорании в кислороде образуется углекислый газ и вода
5) реагирует с азотом
Источник