- Применение брома
- Открытие и история
- Получение брома
- Бром как химический элемент таблицы Менделеева
- Как был открыт Бром
- Где и как добывают Бром
- Распространенность Брома
- Применение Брома
- Интересные факты
- Какими способами можно получить бром
- История открытия.
- Получение брома.
- Простое вещество.
- Биологическая роль и токсичность соединений брома.
- Применение брома и его соединений.
Применение брома
Химические элементы окружают каждого человека повсеместно. Кроме того, из некоторых сделаны предметы повседневного обихода (например, из металлов), а многие из них содержатся даже в продуктах питания. По статистике, к 2016 году человечество узнало порядка 118 химических элементов. Все они нашли свое место в Периодической системе Менделеева согласно группам. Однако, среди этого разнообразия известных химических элементов существует несколько неметаллов, которые благодаря своим специфическим свойствам выделены в отдельную группу под названием «галогены». К данной группе относятся хорошо известные еще со школьной скамьи четыре химических элемента: фтор, хлор, бром и йод.
Открытие и история
Открытие брома состоялось дважды, независимо друг от друга, — в 1825 и 1826 году. Так, бром обязан своей известностью двум химикам – Карлу Якобу Лёвиху и Антуану Жерому Балару, соответственно. Однако, человечество не останавливается на достигнутом и продолжает познавать существующие в природе химические элементы. Это, в свою очередь, способствует и расширению периодической системы. В последнее время группа галогенов пополнилась еще двумя элементами – астатом и теннессином. Последний элемент относится к данной группе формально и является искусственного происхождения.
Бром является активным неметаллом. В нормальных условиях пребывания бром имеет вид тяжелой жидкости красно-бурого цвета и зловонный запах. Также обладает ядовитыми свойствами. Достаточно распространен.
| Характеристики | Показатель |
|---|---|
| Атомный номер | 35 |
| Атомная масса | 79,904 |
| Плотность, кг/м³ | 3120 |
| Температура плавления, °С | -7,2 |
| Температура кипения, °С | 58,8 |
| Теплоемкость, кДж/(кг·°С) | 0,293 |
| Электроотрицательность | 2,8 |
| Ковалентный радиус, Å | 1,14 |
| 1-й ионизац. потенциал, эв | 11,81 |
Не смотря на то, что данный химический элемент был официально открыт только в 19 веке, человечество с ним знакомо очень давно. Первые упоминания о его использовании в литературе датируются вторым тысячелетием до нашей эры. В те далекие времена бром применялся для изготовления красителя пурпурного цвета. После того, как он закрепился в периодической системе химических элементов, его стали активно использовать фотографы и медики. В обиходе у первой категории населения было соединение брома — бромид серебра, обладающий высокой светочувствительностью. Вторыми, в свою очередь, на основе исследований было сделано открытие, что бром позволяет избавиться людям от многих нервных заболеваний.
Сегодня сфера использования брома достаточно широка. Он также продолжает использоваться для производства современных фотопленок, благодаря которым можно делать снимки с выдержкой 10 -7 секунды. Процесс изготовления такого фотоматериала заключается в синтезировании этой соли в водном растворе желатина. Во время данного процесса происходит равномерное распределение выпавших кристалликов бромида серебра по всему раствору. Весь этот процесс в результате застывания желатина завершается образованием тонкодисперсной суспензии, которая тонким слоем в дальнейшем наносится на поверхность прозрачной пленки, полученной из ацетата целлюлозы. На такой фотопленке бромид серебра располагается плотностью в несколько сот миллионов зерен на один квадратный сантиметр. Изображение на пленке получается в результате фотолитического разложения бромида серебра под воздействием света.
Также популярными сферами применения брома являются:
- горнодобывающая (приготовление буровых растворов);
- сельскохозяйственная (получение пестицидов и инсектицидов);
- фармацевтическая;
- химическая;
- машиностроительная;
- пищевая.
Кроме того, данный химический элемент в последнее время стал очень популярен при очистке и дезинфекции воды. В некоторых случаях, им могут заменять хлор (например, в бассейнах). Однако, наиболее широко бром используется при производстве, так называемых, антипиренов – веществ, которые предотвращают воспламенение материалов органического происхождения.
Получение брома
Промышленное производство брома датируется 1865 годом. Оно было начато в Германии на базе Страссфуртского соляного месторождения. Спустя всего два года Америка пошла по стопам немецкого государства и также занялась добычей брома.
В начале 20 века впервые материалом для добычи брома была использована морская вода. Через десять лет было начато очередное промышленное производство брома, в основу которого был положен именно новый метод.
На территории РФ первое предприятие, занимающееся бромным производством, появилось в 1917 году. Местом для его строительства была выбрана окрестность соляного озера Сакское.
Бром можно получить несколькими способами в зависимости от материала, из которого происходит получение:
- выдуванием;
- экстракцией углеводородами;
- адсорбция ионообменными смолами (способ не популярен).
Стоит заметить, что в основе каждого из существующих на сегодня промышленных способов добычи брома из соляных растворов лежит его вытеснение хлором из бромидов:
В лабораторных условиях есть возможность создать условия для контакта бромидов и соответствующего окислителя в кислой среде. Для этого отлично подойдут перманганат калия или диоксид титана. Тот бром, который выделяется в результате реакции, отделяется путем экстракции неполярными растворителями или же перегоняют его с водяным паром. Мировой показатель по добыче брома в год (по состоянию на 2003г.) составляет порядка полумиллиона тонн.
| Страна | 1999 | 2000 | 2001 | 2002 | 2003 |
|---|---|---|---|---|---|
| США | 239 | 228 | 212 | 222 | 216 |
| Израиль | 181 | 210 | 206 | 206 | 206 |
| Китай | 42 | 42 | 40 | 42 | 42 |
| Великобритания | 55 | 32 | 35 | 35 | 35 |
| Иордания | – | – | – | 5 | 20 |
| Япония | 20 | 20 | 20 | 20 | 20 |
| Украина | 3 | 3 | 3 | 3 | 3 |
| Азербайджан | 2 | 2 | 2 | 2 | 2 |
| Франция | 1,95 | 2 | 2 | 2 | 2 |
| Индия | 1,5 | 1,5 | 1,5 | 1,5 | 1,5 |
| Германия | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 |
| Италия | 0,3 | 0,3 | 0,3 | 0,3 | 0,3 |
| Туркменистан | 0,15 | 0,15 | 0,15 | 0,15 | 0,15 |
| Испания | 0,1 | 0,1 | 0,1 | 0,1 | 0,1 |
| Всего в мире | 547 | 542 | 523 | 540 | 548 |
Источник
Бром как химический элемент таблицы Менделеева
Как был открыт Бром
Открытие такого химического элемента как бром было совершено почти одновременно и независимо друг от друга двумя учеными.
Первым является немецкий химик Карл Якоб Левиг. Ему удалось выделить новый элемент из источника минеральных вод в немецком городке Бад-Кройцнах в 1825 году. Для справки этот город является Родиной Левига. Используя раствор минеральной соли насыщенной хлором, Карл Левиг эстрагировал бром диэтиловым эфиром. После испарения эфира на дне оставалась коричневая жидкость. С этой жидкостью в качестве доказательства своего эксперимента, он просился на работу в лабораторию Леопольда Гмелина в Гейдельберге. В результате, публикация этого опыта была отложена и французский химик Антуан Балар опубликовал свою статью раньше.
Статья французского химика была опубликована только в 1826 году. Балар нашел новый химический элемент в золе морских водорослей из солончаков в Монпелье. Морские водоросли в то время использовались для получения йода и содержали в своем составе бром. Он выделил новый элемент из раствора золы водорслей, насыщенных хлором. Свойства этого элемента были похожи на свойства йода и хлора. Балар, проводя свои опыты пытался доказать, что найденое вещество является монохлоридом йода. Когда у него не получилось это доказать он решил зарегистрировать его как новый элемент и назвал его мюрид.
После того, как французские химики, такие как Луи Николя Воклен, Луи Жак Тенар и Гей Люссак, одобрили открытие, новый элемент был представлен на одной из лекций в Академии наук и опубликованы в журнале «Annales de Chimie et Physique». До 1858 года бром не производился в больших количествах. В этом году было обнаружено месторождение в Штасфурте, которое открыло новое дыхание в производство этого элемента.
Где и как добывают Бром
На сегодняшний день, мировое производство брома оценивается в 600 000 тонн в год. Лидерами по производству этого элемента являются США, Китай, Израиль и Иордания. В промышленных масштабах исходным материалом для добычи брома является либо раствор солей, либо вода из подземных источников большой глубины. Само получение элементарного брома в промышленных масштабах осуществляется путем окисления растворов бромида хлором. Химическая реакция этого процесса выглядит следующим образом.
При окислении бромида калия при повышенных температурах образуется чистый бром и хлорид калия. Еще одним возможным способом получения брома является его добыча как побочного продукта при переработке калия для изготовления удобрений. С 1970-х годов этот метод перестал быть коммерчески выгодным и от него отказались.
В лабораториях бром получают с помощью химической реакции бромида натрия с серной кислотой и диоксидом марганца. На выходе реакции из бромида натрия получается сульфат марганца, оксид брома, сульфат натрия и вода. После этого из раствора методом перегонки выделяют бром.
Распространенность Брома
Распространенность брома на нашей планете довольно относительная. Что касается земной коры, то этот элемент занимает почетное 46 место по массе. Его соотношение составляет 2.5 части на миллион. Это означает, что его обходят в несколько раз такие элементы как фтор и хлор. Гораздо большее содержание брома отмечается в морях и океанах, где соотношение брома составляет около 65 частей на миллион. Это означает, что в мировом океане на одну молекулу фтора или хлора приходится около 600 молекул брома. При этом в соляных озерах или скважинах концентрация брома может быть в разы выше. Таким примером выступает «Мертвое море». По оценкам ученых процентное содержание ионов брома в этом месте составляет около 0,4%. В таких источниках наиболее выгодна коммерческая добыча.
Применение Брома
Соединения брома находят широкое применение в разных сферах промышленности. Некоторые соединения изготавливаются из самого брома, другие же изготавливаются из бромистого водорода. Бромистый водород в свою очередь представляет собой двухатомное соединение водорода и брома.
Большую часть коммерческого использования брома приходится на бромированные антипирены. Последние в свою очередь используются в противопожарных средствах защиты. Примером этого могут послужить некоторые огнетушители, а так же противопожарные средства обработки древесины. Так же бромированные антипирены используются в качстве примеси при изготовлении полимеров, различного рода пластмасс, полиэтилена и полипропилена. Еще одним известным применением бромированных антипиренов является изготовление термияески устойчивых эпоксидных смол для печатных плат в электротехнике.
Еще одним значимым применением является использование бромида серебра в качестве светочувствительного компонента фотографических эмульсий. Другим важным применением являлся этиленбромид, который использовался в качестве пиисадки к бензину. Эта присадка помогала избавить бензиновые двигатели от эффекта детонации. В 80-х годах от этой присадки отказались из-за токсичности и разрушения озонового слоя.
До 2005 года бромметан, который явлляется токсичным везеством, широко использовался в качестве пестицидов для фумигации почвы. Он был запрещен по той же причине, что и присадка для бензиновых двигателей. Еще одним значимым применением являлась фармакология, где бромид калия довольно часто использовался в качестве седативного вещества. Другие сферы применения брома составляют буровые растворы высокой плотности, красители и фармацевтические препараты.
Интересные факты
Интересных фактов связанных с бромом достаточно много. Стоит начать с того, что в 2014 году было проведено исследование, которое показало, что бром является необходимым кофактором в биосинтезе коллагена IV, что делает этот элемент необходимым для архитектуры базальной мембраны и развития тканей у животных. Другим интересным предположением является то, что ионы брома могут способствовать различного рода мутациям в ДНК живых организмов. Дибром и ртуть являются единственными веществами, которые при комнатной температуре находятся в жидком состоянии. Еще одним интересным моментом является то, что бром в простом состоянии способен вызывать химические ожоги. Вдыхание его паров способно вызывать одышку, пневмонию и отек легких.
Источник
Какими способами можно получить бром
БРОМ (Bromum, Br) – элемент 17 (VIIa) группы периодической системы, атомный номер 35, относительная атомная масса 79,904. Природный бром состоит из двух стабильных изотопов: 79 Br (50,69 ат.%) и 81 Br (49,31 ат.%), а всего известно 28 изотопов с массовыми числами от 67 до 94. В химических соединениях бром проявляет степени окисления от –1 до +7, в природе встречается исключительно в степени окисления –1.
История открытия.
Вплотную к открытию брома практически одновременно подошли сразу трое ученых, но официально признанным первооткрывателем суждено было стать только одному из них.
В 1825 молодой французский химик Антуан Жером Балар (Antoine-Jérôme Balard), работавший препаратором в Фармакологической школе при университете небольшого южного городка Монпелье, приступил к своим первым самостоятельным научным исследованиям. С древнейших времен Монпелье был знаменит своими соляными промыслами. Для добычи соли на берегу моря вырывали бассейны и заполняли их морской водой. После того, как под действием солнечных лучей вода испарялась, выпавшие кристаллы соли вычерпывали, а оставшийся маточный раствор (рапу) возвращали обратно в море.
Руководитель Балара, профессор Жозеф Англада (Joseph Anglada), поручил ему изучить химический состав сливаемого рассола и прибрежных морских водорослей. Действуя на рапу различными реактивами, Болар заметил, что при пропускании через нее хлора раствор приобретает интенсивный желтый цвет. Аналогично окрашивал хлор и щелочной экстракт золы водорослей. Вначале Балар предположил, что наблюдаемая окраска вызвана присутствием в исследуемых образцах иода, который, реагируя с хлором, и образует неизвестное вещество. Для начала он экстрагировал его последовательно эфиром и водным гидроксидом калия. Обработав полученный щелочной раствор пиролюзитом (MnO2) в сернокислой среде, Балар выделил неприятно пахнущую красно-бурую жидкость и попробовал разделить ее на составные части. Когда все попытки не принесли результата, стало ясно, что это новый элемент. Определив плотность и температуру кипения жидкости, а также изучив ее важнейшие химические свойства, 30 ноября 1825 Балар отправил доклад о своих опытах в Парижскую академию наук. В нем, в частности, для нового элемента было предложено название «мурид» (от латинского слова «muria» – рассол).
Для проверки сообщения была назначена комиссия из трех химиков: Луи Вокелена (Louis Nicolas Vauquelin), Луи Тенара (Louis Jacques Thénard) и Жозефа Гей-Люссака. Повторив описанные эксперименты, они подтвердили выводы Балара, но название «мурид» признали неудачным, т.к. что соляная кислота называлась тогда acidum muriaticum – муриевой (от гипотетического элемента мурия), а ее соли – муриатами и употребление столь похожих названий «мурид» и «мурий» могло вызвать недоразумения. Согласно рекомендации номенклатурного комитета при академии наук новый элемент было предложено назвать бромом от греческого brwmoV – зловонный. В России название «бром» утвердилось не сразу, в течение долгого времени для элемента № 35 использовались названия «вром», «мурид», и «вромид».
Позднее выяснилось, что впервые элементарный бром получил не Балар а студент известного немецкого химика Леопольда Гмелина Карл Левиг (Carl Jacob Löwig, Leopold Gmelin), который в 1825 в Гейдельбергском университете выделил его из воды источника в Крейцнахе. Пока он приготовлял большее количество препарата для исследования, появилось сообщение Балара.
Вплотную к открытию брома подошел и знаменитый немецкий химик Юстус Любих, точно так же, как и Балар, принявший его за соединение хлора и иода.
Можно сказать, что открытие брома лежало на поверхности, и французский химик Шарль Жерар (Charles Frédéric Gerhardt) сказал даже, что «Не Балар открыл бром, а бром открыл Балара».
В природе бром почти всегда встречается вместе с хлором в виде изоморфной примеси в природных хлоридах (до 3% в сильвине KCl и карналлите KCl·MgCl2·6H2O). Собственные минералы брома: бромаргирит AgBr, бромсильвинит KMgBr3·6H2O и эмболит Ag(Br, Cl) – встречаются редко и промышленного значения не имеют. Они были открыты гораздо позже элементарного брома (бромаргирит – в Мексике, в 1841). Кларк (среднее содержание в земной коре) брома в земной коре составляет 2,1·10 –4 %.
Большое количество брома содержится в гидросфере Земли (около 3/4 от имеющегося в земной коре): в океанах (6,6·10 –3 %), соляных озерах, подземных рассолах и грунтовых водах. Наибольшая концентрация растворенных бромидов – около 6 мг/л – отмечена в воде Мертвого моря, а общее количество брома в нем оценивается в 1 млрд. тонн. Вместе с брызгами соленой воды соединения брома попадают в атмосферу.
Бром есть и в живых организмах. Содержание брома в живой фитомассе составляет 1,6·10 –4 %. В человеческом теле средняя концентрация брома составляет около 3,7 мг/кг, большая часть его сосредоточена в мозге, печени, крови и почках. Среди неорганических анионов, входящих в состав крови бромид-ион занимает пятое место по количеству после хлорида, гидрокарбоната, фосфата и сульфата; его концентрация в плазме крови находится в пределах 20–150 мкмоль/л. Некоторые животные, грибы и растения (прежде всего бобовые), способны накапливать бром, особенно много его в морских рыбах и водорослях.
Получение брома.
Промышленное производство брома началось в 1865 на базе Страссфуртского соляного месторождения в Германии, двумя годами позже бром стали добывать в США, в штате Вирджиния. В 1924 на борту судна «Этила» была продемонстрирована возможность добычи брома из морской воды, а в 1934 организовано промышленное производство, основанное на этом методе. В России первый бромный завод был построен в 1917 на соляном озере Сакское.
Все промышленные способы получения брома из соляных растворов основаны на его вытеснении хлором из бромидов:
При получении брома методом выдувания исходное сырье (рапу соляных озер, попутные воды нефтяных скважин, морскую воду) подкисляют серной кислотой до pH » 3,5 и обрабатывают избыточным количеством хлора. Затем рассол, содержащий растворенный бром, подают в верхнюю часть колонны, заполненной небольшими керамическими кольцами. Раствор стекает по кольцам, а навстречу ему продувают мощную струю воздуха, при этом бром переходит в газовую фазу. Бромовоздушную смесь пропускают через раствор карбоната натрия:
3Na2CO3 + 3Br2 = 5NaBr + NaBrO3 + 3CO2
Для выделения брома из полученной смеси бромида и бромата натрия, ее подкисляют серной кислотой:
Если содержание бромидов в исходном сырье достаточно велико, то вместо воздуха экономически выгоднее использовать водяной пар.
Другие предложенные способы извлечения брома из хлорированного рассола: экстракция углеводородами или адсорбция ионообменными смолами – не получили широкого распространения.
Часть используемых в промышленности растворов бромидов (в США до 35%) отправляют на повторную переработку с целью получения дополнительных количеств брома.
Мировое производство брома (по данным на 2003) составило около 550 тыс. тонн в год, большая часть его производится в США (39,4%), Израиле (37,6%), и Китае (7,7%). Динамика производства брома в различных странах мира приведена в таблице 1.
| Табл. 1. ДИНАМИКА МИРОВОГО ПРОИЗВОДСТВА БРОМА (в тыс. тонн). | |||||
| Страна | 1999 | 2000 | 2001 | 2002 | 2003 |
| США | 239 | 228 | 212 | 222 | 216 |
| Израиль | 181 | 210 | 206 | 206 | 206 |
| Китай | 42 | 42 | 40 | 42 | 42 |
| Великобритания | 55 | 32 | 35 | 35 | 35 |
| Иордания | – | – | – | 5 | 20 |
| Япония | 20 | 20 | 20 | 20 | 20 |
| Украина | 3 | 3 | 3 | 3 | 3 |
| Азербайджан | 2 | 2 | 2 | 2 | 2 |
| Франция | 1,95 | 2 | 2 | 2 | 2 |
| Индия | 1,5 | 1,5 | 1,5 | 1,5 | 1,5 |
| Германия | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 |
| Италия | 0,3 | 0,3 | 0,3 | 0,3 | 0,3 |
| Туркменистан | 0,15 | 0,15 | 0,15 | 0,15 | 0,15 |
| Испания | 0,1 | 0,1 | 0,1 | 0,1 | 0,1 |
| Всего в мире | 547 | 542 | 523 | 540 | 548 |
Цена элементного брома колеблется от 700 до 1000 долл. за тонну. Годовая потребность России в броме оценивается в 20–25 тыс. тонн, она удовлетворяется, в основном, за счет импорта из США и Израиля.
В лаборатории бром можно получить взаимодействием бромидов с подходящим окислителем, например перманганатом калия или диоксидом марганца, в кислой среде.
Выделившийся бром отделяют экстракцией неполярными растворителями или перегонкой с водяным паром.
Простое вещество.
Бром – единственный неметалл, жидкий при комнатной температуре. Элементный бром представляет собой тяжелую красно-бурую жидкость с неприятным запахом (плотность при 20° C – 3,1 г/см 3 , температура кипения +59,82° C), пары брома имеют желто-бурый цвет. При температуре –7,25° C бром затвердевает, превращаясь в красно-коричневые игольчатые кристаллы со слабым металлическим блеском.
В твердом, жидком и газообразном состоянии бром существует в виде двухатомных молекул Br2, заметная диссоциация на атомы начинается только при 800° C, диссоциация происходит и под действием света. Элементный бром является сильным окислителем, он непосредственно реагирует почти со всеми неметаллами (за исключением инертных газов, кислорода, азота и углерода) и многими металлами, эти реакции зачастую сопровождаются воспламенением (например, с фосфором, сурьмой, оловом):
Многие металлы медленно реагируют с безводным бромом из-за образования на их поверхности пленки бромида, нерастворимого в броме. Из металлов наиболее устойчивы к действию брома (даже при повышенных температурах и в присутствии влаги) серебро, свинец, платина и тантал. Золото, в отличие от платины, легко реагирует с ним, образуя AuBr3.
В водной среде бром окисляет нитриты до нитратов, аммиак до азота, иодиды до свободного иода, серу и сульфиты до серной кислоты:
2NH3 + 6Br2 = N2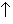
Бром умеренно растворим в воде (3,58 г в 100 г при 20° C), при охлаждении этого раствора до 6° C из него выпадают гранатово-красные кристаллы клатратного гидрата брома состава 6Br2·46H2O. Растворимость брома существенно возрастает при добавлении бромидов за счет образования прочных комплексных соединений:
В водном растворе брома («бромной воде») существует равновесие между молекулярным бромом, бромид-ионом и оксокислотами брома:
В насыщенном растворе бром диссоциирован на 0,85%, в 0,001-молярном – на 17%.
При хранении бромной воды на свету она постепенно разлагается с выделением кислорода из-за фотолиза бромноватистой кислоты:
2HOBr + hv = 2HBr + O2
При взаимодействии брома с растворами щелочей образуются соответствующие бромиды и гипобромиты (на холоду) или броматы:
Br2 + 2NaOH = NaBr + NaBrO + H2O (при t 3 ) бесцветный газ с резким запахом, дымящий на воздухе из-за взаимодействия с парами воды. При охлаждении до –67° C бромоводород переходит в жидкое состояние. HBr хорошо растворим в воде: при 0° C в одном объеме воды растворяется 612 объемов бромоводорода, в растворе HBr диссоциирует на ионы:
Водный раствор HBr называется бромоводородной кислотой, она относится к числу сильных кислот (pKa = –9,5). В HBr бром имеет степень окисления –1 и поэтому бромоводородная кислота проявляет восстановительные свойства, она окисляется концентрированной серной кислотой и кислородом воздуха (на свету):
H2SO4 + 2HBr = Br2 + SO2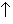
При взаимодействии с металлами, а также с оксидами и гидроксидами металлов бромоводородная кислота образует соли – бромиды:
HBr + KOH = KBr + H2O
В промышленности бромоводород получают прямым синтезом из элементов в присутствии катализатора (платины или активированного угля) H2 + Br2 = 2HBr и, в качестве побочного продукта, при бромировании органических соединений:
В лаборатории HBr может быть получен при действии концентрированной фосфорной кислоты на бромиды щелочных металлов при нагревании:
Удобным лабораторным методом синтеза HBr является также взаимодействие брома с бензолом или декалином в присутствии железа:
Бромоводород применяется для получения бромидов и некоторых органических соединений брома.
Бромид калия KBr – бесцветное кристаллическое вещество, хорошо растворимое в воде (65 г в 100 г воды при 20° C), tпл = 730° C. Бромид калия применяется при изготовлении фотоэмульсий и в качестве противовуалирующего вещества в фотографии. KBr хорошо пропускает инфракрасные лучи и поэтому служит материалом для изготовления линз для ИК-спектроскопии.
Бромид лития LiBr, представляет собой бесцветное гигроскопичное вещество (tпл = 552° C), хорошо растворимое в воде (63,9% при 20° C). Известен кристаллогидрат LiBr·2H2O. Бромид лития получают при взаимодействии водных растворов карбоната лития и бромоводородной кислоты:
Li2CO3 + 2HBr = 2LiBr + H2O + CO2
Бромид лития применяют при лечении психических заболеваний и хронического алкоголизма. Из-за высокой гигроскопичности LiBr используется как осушающее вещество в системах кондиционирования воздуха и для обезвоживания минеральных масел.
Бромноватистая кислота HOBr относится к слабым кислотам, она существует лишь в разбавленных водных растворах, которые получают взаимодействием брома с суспензией оксида ртути:
Соли бромноватистой кислоты называются гипобромитами, они могут быть получены взаимодействием брома с холодным раствором щелочи (см. выше), при нагревании щелочных растворов гипобромиты диспропорционируют:
3NaBrO = 2NaBr + NaBrO3
Степени окисления брома +3 соответствует бромистая кислота HBrO2, которая в настоящее время не получена. Известны только ее соли – бромиты, которые можно получить окислением гипобромитов бромом в щелочной среде:
Бромноватая кислота HBrO3 получена в растворах при действии разбавленной серной кислоты на растворы ее солей – броматов:
При попытке получения растворов с концентрацией выше 30% бромноватая кислота разлагается со взрывом.
Бромноватая кислота и броматы являются сильными окислителями:
Бромат калия KBrO3 – бесцветное кристаллическое вещество, растворимое в воде (в 100 г воды при 20° C растворяется 6,9 г KBrO3, при 100° C – 49,7 г). При нагревании до 434° C разлагается без плавления:
Бромат калия получают электролизом растворов KBr или взаимодействием гидроксида калия с бромом и хлором:
KBrO3 применяется в аналитической химии в качестве окислителя при броматометрическом титровании, он входит в состав нейтрализаторов для химической завивки.
Наиболее устойчивой из оксокислот брома является бромная кислота HBrO4, которая существует в водных растворах с концентрацией, не превышающей 6 моль/л. Несмотря на то, что HBrO4 – самый сильный окислитель среди кислородных кислот брома, окислительно-восстановительные реакции с ее участием протекают очень медленно. Так, например, бромная кислота не выделяет хлор из одномолярного раствора соляной кислоты, хотя эта реакция термодинамически выгодна. Особая устойчивость иона BrO4 – связана с тем, что атомы кислорода, окружая атом брома по тетраэдру, эффективно защищают его от атаки восстановителя. Растворы бромной кислоты можно получить подкислением растворов ее солей – перброматов, которые, в свою очередь, синтезируют электролизом растворов броматов, а также окислением щелочных растворов броматов фтором или фторидами ксенона:
NaBrO3 + XeF2 + 2NaOH = NaBrO4 + 2NaF + Xe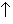
Из-за сильных окислительных свойств перброматов они были синтезированы только во второй половине 20 в. американским ученым Эваном Эпплманом (Evan H.Appelman) в 1968.
Кислородные кислоты брома и их соли могут быть использованы в качестве окислителей.
Биологическая роль и токсичность соединений брома.
Многие аспекты биологической роли брома в настоящее время еще не выяснены. В организме человека бром участвует в регуляции деятельности щитовидной железы, так как является конкурентным ингибитором иода. Некоторые исследователи полагают, что соединения брома участвуют в деятельности эозинофилов – клеток иммунной системы. Пероксидаза эозинофилов окисляет бромид-ионы до бромноватистой кислоты, которая помогает разрушать чужеродные клетки, в том числе и раковые. Недостаток брома в пище приводит к бессоннице, замедлению роста и уменьшению числа эритроцитов в крови. Ежедневное поступление брома в организм человека с пищей составляет 2–6 мг. Особенно богаты бромом рыба, злаки и орехи.
Элементный бром ядовит. Жидкий бром вызывает трудно заживающие ожоги, при попадании на кожу его нужно смыть большим количеством воды или раствора соды. Пары брома в концентрации 1мг/м 3 вызывают раздражение слизистых оболочек, кашель, головокружение и головную боль, а в более высокой (>60 мг/м 3 ) – удушье и смерть. При отравлении парами брома рекомендуется вдыхать аммиак. Токсичность соединений брома менее велика, тем не менее, при длительном употреблении бромсодержащих препаратов может развиться хроническое отравление – бромизм. Его симптомы – общая вялость, появление сыпи на коже, апатия, сонливость. Бромид-ионы, поступая в организм в течение длительного времени, препятствуют накоплению иода в щитовидной железе, угнетая ее деятельность. Для ускорения выведения брома из организма назначают диету с большим содержанием соли и обильное питье.
Применение брома и его соединений.
Первым известным применением соединений брома было производство пурпурного красителя. Его добывали еще во втором тысячелетии до нашей эры из моллюсков вида «мурекс», накапливающих бром из морской воды. Процесс извлечения красителя был очень трудоемок (из 8000 моллюсков можно получить всего 1 грамм пурпура) и позволить себе носить окрашенную им одежду могли только очень богатые люди. В древнем Риме носить ее могли только представители высшей власти, поэтому он получил название «королевский пурпур». Структуру действующего начала этого красителя установили только во второй половине 19 в., им оказалось соединение брома – 6,6’– диброминдиго. Бромпроизводные индиго, синтезируемые искусственно, используются для окрашивания тканей (в основном, хлопковых) и сейчас.
В 19 в. главными областями использования соединений брома были фотография и медицина.
Бромид серебра AgBr стал применяться как светочувствительный материал около 1840. Современные фотоматериалы на основе AgBr позволяют делать снимки с выдержкой 10 –7 секунды. Для изготовления фотопленки на основе бромида серебра, эта соль синтезируется в водном растворе желатина, при этом выпавшие кристаллики AgBr равномерно распределяются по всему объему раствора. После застывания желатина образуется тонкодисперсная суспензия, которую тонким слоем (толщиной от 2 до 20 мкм) равномерно наносят на поверхность носителя – прозрачной пленки, изготовленной из ацетата целлюлозы. В каждом квадратном сантиметре полученного слоя содержится несколько сот миллионов зерен бромида серебра, окруженных желатиновой пленкой. При попадании света на такую фотопленку происходит фотолитическое разложение AgBr:
AgBr + hv = Ag + Br
Протеканию в фотоэмульсии обратного процесса – окисления серебра бромом, препятствует желатина. Фотолиз приводит к образованию в микрокристаллах AgBr групп атомов серебра с размерами 10 –7 –10 –8 см, так называемых центров скрытого изображения. Для получения видимого изображения бромид серебра на засвеченных участках восстанавливают до металлического серебра. Центры скрытого изображения катализируют (ускоряют) реакцию восстановления и позволяют провести ее, практически не затронув неосвещенных кристалликов AgBr. После растворения оставшегося бромида серебра на фотопленке получается черно-белое изображение (негатив), устойчивое к действию света. Для создания позитивного изображения нужно повторить процесс, освещая (обычно) фотобумагу через пленку, на которой с негативным изображением.
Соли брома оказались очень эффективными лекарственными средствами для лечения многих нервных болезней. Знаменитый русский физиолог И.П.Павлов сказал: «Человечество должно быть счастливо тем, что располагает таким драгоценным для нервной системы препаратом, как бром». Использование KBr в медицине в качестве седативного (успокоительного) и противосудорожного средства при лечении эпилепсии началось в 1857. В то время водные растворы бромида калия и натрия были известны под общим названием «бром». В течение долгого времени механизм действия препаратов брома оставался неизвестным, считалось, что бромиды уменьшают возбудимость, действуя аналогично снотворным. Лишь в 1910 один из учеников Павлова П.М.Никифоровский экспериментально показал, что бромиды усиливают процессы торможения в центральной нервной системе. Сейчас бромиды натрия и калия практически вышли из употребления при лечении нервных заболеваний. Они были вытеснены более эффективными броморганическими препаратами.
В начале 20 в. открылась новая область применения брома. С распространением автомобилей появилась нужда в больших количествах дешевого бензина, вместе с тем существующая в то время нефтяная промышленность не могла производить требуемые объемы высокооктанового горючего. Для улучшения качества топлива – уменьшения его способности к детонации в двигателе – в 1921 американский инженер Томас Мидгли (Thomas Midgley) предложил вводить в бензин дополнительный компонент – тетраэтилсвинец (Pb(C2H5)4, ТЭС). Эта добавка оказалась очень эффективной, но при ее использовании возникла новая проблема – отложения свинца в двигателях. Чтобы избежать их образования, ТЭС растворяют в бромуглеводородах – 1,2 -дибромэтане (BrCH2CH2Br) и этилбромиде (C2H5Br), полученная смесь получила название «этиловая жидкость» (см. ОКТАНОВОЕ ЧИСЛО). Механизм ее действия заключается в том, что при совместном сгорании бромуглеводородов и ТЭС образуются летучие бромиды свинца, которые выносятся из двигателя вместе с выхлопными газами. В середине прошлого века на производство этиловой жидкости расходовалась большая часть производимого брома – 75% в 1963. Сейчас использование этиловой жидкости не соответствует современным требованиям экологической безопасности и ее мировое производство сокращается: в России, например, доля этилированного (содержащего этиловую жидкость) бензина в общем объеме автомобильного топлива составляла в 1995 более 50%, а в 2002 – 0,4%. В России использование ТЭС запрещено с 2003, а в некоторых регионах– еще раньше (в Москве – с 1993).
Теперь основной областью использования брома является производство антипиренов (от 40% мирового потребления брома). Антипирены – вещества, защищающие материалы органического происхождения от воспламенения. Их используют для пропитки тканей, изделий из древесины и пластмасс, производства негорючих красок. В качестве антипиренов применяются, в основном, ароматические бромпроизводные: дибромстирол, тетрабромфталевый ангидрид, декабромдифенилоксид, 2,4,6-трибромфенол и другие. Бромхлорметан используется в качестве наполнителя огнетушителей, предназначенных для тушения электропроводки.
Значительная часть брома (в США – 24%) в форме бромидов кальция, натрия и цинка расходуется для изготовления буровых растворов, которые закачивают в скважины для увеличения объема добытой нефти.
До 12% брома идет на синтез пестицидов и инсектицидов, используемых в сельском хозяйстве и для защиты деревянных изделий (метилбромид).
Элементный бром и его соединения применяются в процессах водоочистки и водоподготовки. Бром иногда используют для мягкой дезинфекции воды в бассейнах при повышенной чувствительности к хлору. На эти цели расходуется 7% производимого брома.
Около 17% брома расходуется на производство фотографических материалов, фармацевтических препаратов и высококачественной резины (бромбутилкаучука).
Органические соединения брома применяют для ингаляционного наркоза (галотан – 1,1,1-трифтор-2-хлор-2-бромэтан, CF3CHBrCl), в качестве обезболивающих, успокоительных, антигистаминных и антибактериальных препаратов, при лечении язвенных болезней, эпилепсии, сердечно-сосудистых заболеваний. Изотоп брома с атомной массой 82 находит применение в медицине при лечении опухолей и при изучении поведения бромсодержащих препаратов в организме.
Бромбутилкаучук получают в промышленности при неполном бромировании бутилкаучука – сополимера 97–98% изобутилена CH2=C(CH3)2 и ne 2–3% изопрена CH2=C(CH3)CH=CH2. В этом процессе происходит бромирование только изопреновых звеньев макромолекулы каучука:
Введение брома в бутилкаучук существенно повышает скорость его вулканизации. Бромбутилкаучук не имеет запаха, не выделяет вредных веществ при хранении и переработке, он отличается высокой степенью совулканизации с ненасыщенными каучуками и лучшей, чем у бутилкаучука, адгезией к другим полимерам. Галогенированные бутилкаучуки используются для герметизации резиновых изделий из других полимеров (например, в производстве автомобильных шин), для изготовления теплостойких транспортных лент с высоким сопротивлением истиранию, резиновых пробок, химически стойких обкладок емкостей.
Источник





