Способы приготовления растворов
Содержание
Существует несколько способов приготовления растворов. По способу приготовления различают первичные и вторичные стандартные растворы.
Приготовление раствора по точной навеске
По точной навеске готовят первичные стандартные растворы, растворы стандартных установочных веществ, которые должны удовлетворять следующим требованиям:
а) состав их должен строго соответствовать химической формуле;
б) вещества должны быть устойчивыми при хранении в растворе и в сухом виде (не окисляться, не поглощать диоксид углерода, воду, не терять кристаллизационную воду);
в) величина молярной массы эквивалента должна быть по возможности наибольшей для уменьшения погрешности взвешивания и титрования.
При приготовлении растворов по точной навеске задаются концентрацией раствора и его объемом.
Основные этапы работы:
- рассчитывают необходимую навеску для взвешивания с точностью до 0,0001 г;
- взвешивают точную навеску на аналитических весах;
- взвешенную навеску количественно переносят в мерную колбу вместимостью, равной Vр-ра, растворяют вещество, доводят до метки дистиллированной водой и перемешивают;
- если взятая навеска отличается от теоретически рассчитанной, то концентрацию раствора пересчитывают.
Приготовление раствора по приблизительной навеске
По приблизительной навеске готовят растворы нестандартных веществ или растворы приблизительной концентрации. Этапы работы такие же, как и при приготовлении растворов по точной навеске, но навеску рассчитывают с точностью не более, чем до 0,01 г и берут ее на технических весах. Точную концентрацию такого раствора устанавливают титрованием (часто растворами первичных стандартов) и рассчитывают по закону эквивалентов:
Приготовленные таким образом растворы с точно установленной концентрацией называются вторичными стандартами или титрованными.
Приготовление раствора из фиксанала
Из фиксанала (норма-дозы, стандарт-титра) готовят первичные стандартные растворы точной концентрации. Фиксанал – стеклянная ампула, в которой содержится точно известное количество вещества (nэкв) в кристаллическом виде или в виде раствора. Содержимое фиксанала количественно переносят в мерную колбу, доводят уровень раствора до метки, раствор перемешивают. Концентрация раствора должна быть задана, а вместимость мерной колбы рассчитывают, используя формулу:
Приготовление раствора разбавлением концентрированного раствора
Разбавлением концентрированных растворов готовят растворы многих веществ. В этом случае должны быть заданы объем разбавленного раствора, его концентрация и концентрация концентрированного раствора. Рассчитывают необходимый для разбавления объем концентрированного раствора, затем измеряют рассчитанный объем, переносят в мерную колбу или в мерный стакан, доводят уровень жидкости до метки дистиллированной водой и перемешивают. Если исходный раствор имел точную концентрацию и при его разбавлении использовали точную мерную посуду, то получают раствор точной концентрации. В противном случае получают раствор приблизительной концентрации.
Все расчеты ведут с точностью не более чем до 0,01. Точную концентрацию устанавливают титрованием.
Установка титра
Установка титра – одна из важных операций лабораторной техники. От правильности приготовления титрованного раствора зависит и результат анализа. Так как каждый анализ почти всегда сопровождается титрованием, каждый работник лаборатории должен хорошо освоить технику проведения этой операции. Нужно помнить несколько правил, относящихся к титрованным растворам.
1. Титрованные растворы должны быть по возможности свежими. Длительное хранение их не должно допускаться. Для каждого раствора есть свой предельный срок хранения.
2. Титрованные растворы при стоянии изменяют свой титр, поэтому их следует иногда проверять. Если же делают особенно ответственный анализ, проверка титра раствора обязательна.
3. При приготовлении растворов марганцовокислого калия титр их следует устанавливать не ранее, чем через 3—4 дня после приготовления. То же относится ко всём другим растворам, способным изменяться со временем или при соприкосновении с воздухом, стеклом и пр.
4. Титрованные растворы щелочей лучше хранить в бутылях, покрытых внутри парафином, а также защищать их от действия двуокиси углерода воздуха (хлоркальциевая трубка с натронной известью или аскаритом).
5. Все бутыли с титрованными растворами должны иметь четкую надпись с указанием вещества, нормальности, поправки, времени изготовления раствора и даты проверки титра.
Во время титрования колбу нужно держать левой рукой, а правой рукой управлять краном бюретки, давая стекать жидкости равномерно. При титровании очень большое значение имеет скорость, поэтому, при повторном титровании одного и того же раствора, нужно, чтобы скорость добавления раствора из бюретки была по возможности одинаковой, т. е. в одно и то же время вытекало бы определенное количество жидкости. Для перемешивания титруемого раствора очень удобно применять магнитные мешалки. В этом случае титрование можно вести как в обычной конической колбе, так и в специальных, приспособленных для титрования темноокрашенных жидкостей.
Общие рекомендации
Подведем итог сказанному о приготовлении растворов.
1. Все водные растворы следует готовить только на дистиллированной воде. При приготовлении водных растворов солей заданной концентрации нужно учитывать также кристаллизационную воду.
2. Приготовляя точные растворы, нельзя наливать в мерную колбу сразу все нужное количество воды.
3. Мерные колбы калиброваны на определенный объем лишь при температуре, указанной на колбе. Поэтому точный объем жидкости можно получить только при стандартной температуре.
4. Так как приготовить растворы точно заданной концентрации трудно, то, прежде чем пользоваться раствором, надо установить его концентрацию или поправку на нормальность.
5. Необходимо наклеивать этикетки (или делать надпись специальным карандашом) на сосудах с растворами.
6. Все растворы следует готовить только в хорошо вымытой посуде. Надо заботиться о том, чтобы приготовленные растворы не загрязнялись каким-либо образом. Нельзя путать пробки от посуды, содержащей растворы разных веществ.
7. Растворы, которые могут портиться от действия света, такие, как марганцовокислый калий, азотнокислое серебро и др., нужно хранить только в темных склянках. Для некоторых веществ можно употреблять желтые склянки, для других же сосуды необходимо оклеивать черной бумагой, но не покрывать стекло черным лаком: лаковая пленка всегда немного пропускает свет. Если черной бумаги нет, бутыль или другой сосуд следует оклеить плотной бумагой и бумагу покрыть черным лаком.
8. Растворы щелочей нужно хранить так, чтобы на них не действовала двуокись углерода. Для этого в пробку вставляют хлоркальциевую трубку, наполненную натронной известью или другим твердым поглотителем двуокиси углерода.
9. Растворы щелочей следует готовить вначале очень концентрированными и разбавлять их до нужной концентрации только после отстаивания и фильтрования.
10. Надо быть осторожным с растворами, которые могут вредно действовать на кожу рук, одежду или обувь.
11. Все растворы нужно проверять. Точные растворы – путем установки титра, приблизительные – по плотности или иным путем.
12. Растворы (за исключением точных) после приготовления следует обязательно профильтровывать. Это относится одинаково и к водным растворам, и к растворам в органических жидкостях.
13. При приготовлении растворов в органических жидкостях надо применять только чистые растворители и, когда нужно, – безводные. Если растворитель чем-либо загрязнен, его следует перегнать или очистить от примесей каким-либо другим способом.
Источник
Способы приготовления стандартных растворов.
1. Метод точной навески. Предполагает работу с растворами, которые не меняют свою молекулярную массу и объем при взаимодействии с воздухом. К таким веществам относятся щавелевая кислота, сода, бура (Na2B4O7·10H2O), бихромат калия и ряд других веществ. На аналитических весах (погрешность таких весов составляет 0,0002г) точно взвешивают вещество и переносят в мерную колбу для растворения, доводят до метки растворителем (водой) и тщательно перемешивают.
2. Фиксанальный метод. Предполагает приготовление растворов из фиксаналов. Фиксанал — ампула с сухим веществом или раствором с точно известной концентрацией. Фиксанал разбивают и переносят в колбу для растворения. Этот метод считается наиболее точным и часто применяется в аналитической химии.
3. Метод приблизительной навески. Предполагает работу с растворами, которые меняют свою массу на воздухе, например, перманганат калия. Работать с такими растворами нельзя, поэтому перед применением их в качестве стандартных, необходимо оттитровать другим раствором с точно известной концентрацией.
4. Метод разбавления. Из раствора с точно известной концентрацией готовят разбавлением раствора другой концентрации. Концентрация полученного раствора зависит от концентрации исходного.
Посуда, применяемая в объемном анализе.
В объемном анализе применяется специальная мерная посуда: бюретки, пипетки и мерные колбы.
Бюретки. Это градуированные стеклянные трубки, приспособленные для отмеривания растворов небольшими порциями или отдельными каплями. Бюретка укрепляется вертикально в штативе, и отсчет делений ведется сверху вниз. Нижняя часть бюретки сужена и соединяется короткой резиновой трубкой с тонким стеклянным носиком. Бюретки изготавливаются объемом от 1 до 50мл. Раствор заливают в бюретку через воронку.
Пипетки. Это специальные стеклянные трубки, предназначенные для отмеривания и переноса заданного объема раствора из одного сосуда в другой. При выливании раствора из пипетки, наполненной до метки, объем раствора в точности соответствует маркировке. Наполнение пипетки производят всасыванием раствора резиновой грушей, плотно приставленной к верхнему концу пипетки. Пипетки изготавливаются различных объемов: от 0,1 до 10мл.
Дозаторы. Большое распространение получили более удобные и безопасные в обращении пипетки-дозаторы, гарантирующие высокую точность и воспроизводимость объема измеряемых жидкостей в пределах от 2 до 5000 мкл. Дозатор забирает из химического сосуда тот объем раствора, который предварительно механически установлен на нем.
Мерные колбы. Это колбы с длинным узким горлышком, на котором наносится кольцевая метка. На колбе указывается объем, который реализуется при наполнении колбы до метки. Объем мерной колбы составляет 25, 50, 100, 200, 250, 500, 1000 или 2000мл.
Мерные цилиндры. В объемном анализе они используются для приблизительного измерения объемов некоторых вспомогательных растворов или воды и имеют второстепенное значение при необходимости измерения объемов меньшей точности.
Вопросы для самоконтроля
1. Раствор как гомогенная система. Растворитель, растворённое вещество. Концентрированные и разбавленные растворы.
2. Количественный состав раствора как одна из главных характеристик раствора.
3. Роль воды и растворов в жизнедеятельности.
4. Физико-химические свойства воды, обуславливающие ее уникальную роль как единственного биорастворителя.
5. Способы выражения концентрации растворов: массовая доля вещества в растворе, молярная концентрация, молярная концентрация эквивалента (или нормальная концентрация), массовая концентрация (или титр).
6. Химический эквивалент, закон эквивалентов.
7. Эквивалентная масса вещества, её связь с молярной массой, фактор эквивалентности. Правила расчёта фактора эквивалентности для различных классов неорганических соединений.
Примеры решения задач
1. Приготовьте 500г раствора NaCl с ω=10%.
| Дано: m раствора (NaCl)=500г ω (NaCl)=10% | Решение ω =m вещества·100%/ m раствора 1. Определяем массу NaCl по формуле: m вещества= ω· m раствора 100% m (NaCl)=10%·500г =50г 100г 2. Определяем массу воды по формуле: m раствора= m вещества+ m растворителя m (H2O)= m раствора— m вещества m (H2O)=500г-50г=450г. Согласно формуле ρ= m/V, где ρ- плотность раствора, m-масса, V-объем V(H2O)= m (H2O)=450г =450мл ρ (H2O) 1г/мл |
| Найти: m (NaCl)=? m (H2O)=? |
Ответ: Для того, что бы приготовить 500г раствора NaCl с ω=10%, нужно взвесить на аналитических весах 50г NaCl, поместить в любую посуду и добавить туда 450мл воды, отмерив ее цилиндром.
Приготовьте 250мл 0,5М раствора CuSO4 из безводного CuSO4 мл
| Дано: Cм(CuSO4)=0,5М V (CuSO4)=0,25л | Решение См=n(CuSO4)/V Находим количество молей раствора CuSO4 по формуле n(CuSO4)=См·V, тогда n(CuSO4)=0,5моль/л·0,25л=0,125моль. М(CuSO4)=160г/моль Согласно формуле n=m/M, находим массу CuSO4 m (CuSO4)= n· M=0,125моль ·160г/моль=20г |
| Найти: m (CuSO4)=? |
Ответ: Для того, что бы приготовить 250мл CuSO4 из безводного, нужно взвесить на аналитических весах 20г CuSO4, перенести в мерную колбу объемом 250мл и довести до метки водой.
Приготовьте 50мл 0,025N раствора NaOH разбавлением 1N раствора NaOH.
Дано:  (NaOH)=1N (NaOH)=1N  (NaOH)=0,025N V2(NaOH)=50 мл (NaOH)=0,025N V2(NaOH)=50 мл | Решение 1. Определяем объем исходного 1N раствора NaOH по формуле  тогда тогда 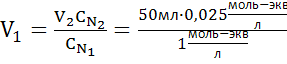 = 1,25мл = 1,25мл |
| Найти: V1(NaOH)= ? |
Ответ: Для того, что бы приготовить 50 мл 0,025N раствор NaOH из 1N, нужно с помощью пипетки отобрать 1,25мл 1N раствора NaOH, перенести в мерную колбу объемом 50 мл и довести до метки водой.
Тесты для самоконтроля
Тест № 1
1. Выражение ω (СаС12)= 5% означает:
а) 5 г СаС12 растворено в 95 г Н2О,
б) 5 г СаС12 растворено в 100 г Н2О,
в) 5 г СаС12 растворено в 1000 г Н2О,
г) 5 моль СаС12 растворено в 100 г Н2О
2. Эквивалентная масса меди в соединении СuSO4 равна:
3. Укажите истинный раствор:
б) вода + поваренная соль,
4. Молярная концентрация показывает:
а) сколько г растворенного вещества содержится в 100 г воды,
б) сколько моль растворенного вещества содержится в 1 л раствора,
в) сколько моль-экв растворенного вещества содержится в 100 мл раствора,
г) сколько мл растворенного вещества содержится в 1000 мл раствора.
5. Эквивалентую массу щавелевой кислоты, вступающей в реакцию c гидроксидом натрия, рассчитывают по следующей формуле:
Тест № 2
1. Нормальная концентрация – это количество моль вещества, растворенного в:
б) 1 л растворителя,
в) 100 г растворителя,
г) 100 г раствора.
2. Титр показывает сколько:
а) г вещества содержится в 1000 мл раствора,
б) г вещества содержится в 1 мл раствора,
в) г вещества содержится в 100 г раствора,
г) моль вещества содержится в 1 мл раствора
3. Приведите основную формулу для определения концентраций в объемном анализе.
в) 

г) 

4. Масса хлорида натрия количеством вещества 0,8 моль равна:
5. Массовая доля показывает количество:
б) г растворенного вещества на 100 г воды,
в) 1 моль вещества в 1 л раствора,
г) г растворенного вещества в 100 г раствора.
Тест № 3
1. Титр показывает сколько:
а) г вещества содержится в 1000 мл раствора,
б) г вещества содержится в 1 мл раствора,
в) г вещества содержится в 100 г раствора,
г) моль вещества содержится в 1 мл раствора
2. Эквивалентная масса меди в соединении СuSO4 равна:
3. Молярная концентрация показывает:
а) сколько г растворенного вещества содержится в 100 г воды,
б) сколько моль растворенного вещества содержится в 1 л раствора,
в) сколько моль-экв растворенного вещества содержится в 100 мл раствора,
г) сколько мл растворенного вещества содержится в 1000 мл раствора.
4. Приведите основную формулу для определения концентраций в объемном анализе.
в) 

г) 

5. Методом приблизительной навески можно приготовить раствор:
Тест № 4
1. Массовая доля показывает количество:
б) г растворенного вещества на 100 г воды;
в) 1 моль вещества в 1 л раствора;
г) г растворенного вещества в 100 г раствора.
2. Масса хлорида натрия количеством вещества 0,8 моль равна:
3. Эквивалентую массу щавелевой кислоты, вступающей в реакцию c гидроксидом натрия, рассчитывают по следующей формуле:
4. Молярная концентрация показывает:
а) сколько г растворенного вещества содержится в 100 г воды,
б) сколько моль растворенного вещества содержится в 1 л раствора,
в) сколько моль-экв растворенного вещества содержится в 100 мл раствора,
г) сколько мл растворенного вещества содержится в 1000 мл раствора.
а) 188 г/моль; б) 171 г/моль; в) 94 г/моль; г) 114 г/моль.
Тест № 5
1. Приведите основную формулу для определения концентраций в объемном анализе.
в) 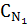

г) 

2. Выражение ω (СаС12)= 5% означает:
а) 5 г СаС12 растворено в 95 г Н2О,
б) 5 г СаС12 растворено в 100 г Н2О,
в) 5 г СаС12 растворено в 1000 г Н2О,
г) 5 моль СаС12 растворено в 100 г Н2О
3. Массовая доля метилового спирта в растворе, содержащем 60 г спирта и 40 г воды равна:
4. При полной нейтрализации Н3РО4 её эквивалент равен:
5. Методом точной навески можно приготовить раствор:
Ответы к тестам для самоконтроля
| № теста | Номер вопроса | |||
| а | а | б | б | б |
| а | б | б | б | г |
| г | а | б | б | г |
| г | б | б | б | в |
| б | а | б | б | а |
Занятие 3. Коллигативные свойства растворов
Цель занятия:
Изучение коллигативных свойств растворов
Студент должен знать:
Коллигативные свойства разбавленных растворов неэлектролитов. Законы Рауля и следствия из них. Осмос. Роль осмоса в жизнедеятельности живых организмов. Осмотическое давление: закон Вант-Гоффа.
Студент должен уметь:
решать задачи, определять осмотическое давление раствора
Изменения термодинамических свойств растворов относительно свойств растворителя зависят от: понижения давления пара, повышения температуры кипения, понижения температуры замерзания и осмотического давления. Поскольку такие свойства обусловлены коллективным влиянием растворённых частиц, их принято называть коллигативными – от латинского colligatus, что означает собирать.
Разберем этот вопрос подробнее.
При внесении в растворитель некоторого вещества меняются термодинамические свойства не только растворяемого вещества, но и свойства растворителя. Эти изменения связаны с характером взаимодействия молекул вещества и растворителя, а также с уменьшением концентрации молекул растворителя и пропорциональны числу растворенных частиц. Поэтому для свойств растворителя удобно использовать понятие идеального раствора.
Идеальным раствором называется раствор, образование которого не сопровождается химическим взаимодействием, изменением объёма и тепловым эффектом (∆Нсмеш. = 0).
Французский ученый Ф. М. Рауль первый сформулировал законы, описывающие влияние растворенного вещества на физические свойства растворителя. Эти законы выведены на основе второго начала термодинамики из условия термодинамического равновесия ∆ G = 0 для физических процессов.
Например, если в замкнутый сосуд поместить чистый растворитель, можно воду, то в этой системе будут протекать два процесса: испарение молекул воды с поверхности жидкости и обратный процесс – конденсация молекул из газовой фазы на поверхности жидкости. Через некоторое время в системе установится динамическое равновесие ∆ G = 0, т.е. такое состояние системы, когда число частиц, испаряющихся с поверхности жидкости за единицу времени, равно числу частиц, переходящих в жидкость из газовой фазы.
Пар, находящийся в равновесии с жидкостью, называют насыщенным. Давление такого пара р 0 называют давлением или упругостью насыщенного пара чистого растворителя.
При данной температуре давление насыщенного пара чистого растворителя – величина постоянная и является термодинамической характеристикой растворителя. При повышении температуры р 0 над растворителем возрастает в соответствии с принципом Ле Шателье, так как испарение – процесс эндотермический. (∆Ниспар. => 0).
Если в летучий растворитель (спирт, вода и т. д.) внести нелетучее растворимое вещество, например сахарозу или хлористый натрий, то концентрация растворителя в образовавшемся растворе уменьшится, а следовательно, уменьшится число частиц растворителя, переходящих в газовую фазу, соответственно уменьшится химический потенциал растворителя. При этом давление насыщенного пара над раствором нелетучего вещества станет меньше, чем над чистым растворителем, следовательно, чем более концентрированный раствор, тем ниже давление пара растворителя над раствором. Эти эксперименты позволили Раулю в 1886 г. сформулировать первый закон:
Источник





