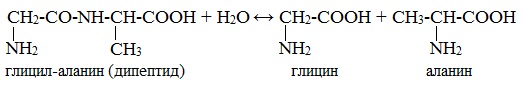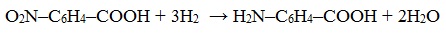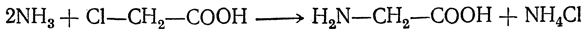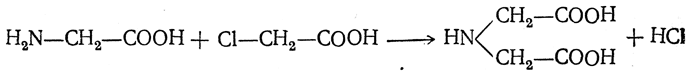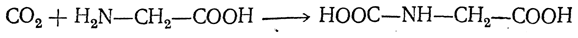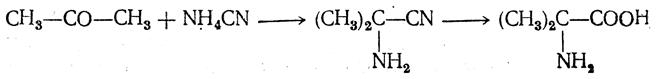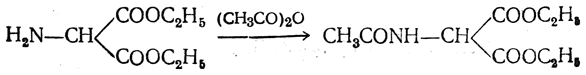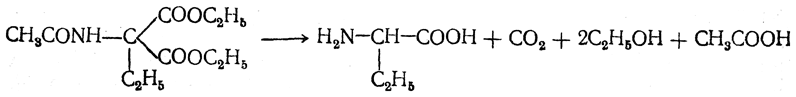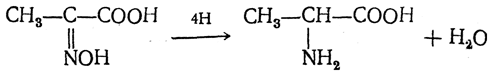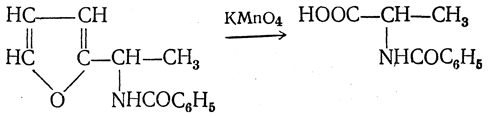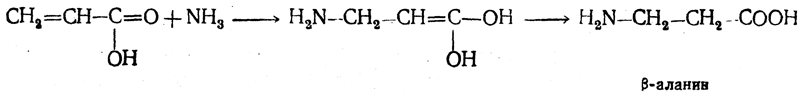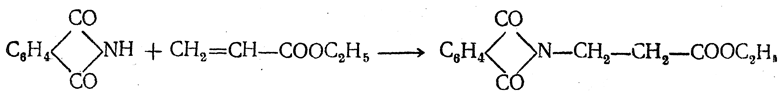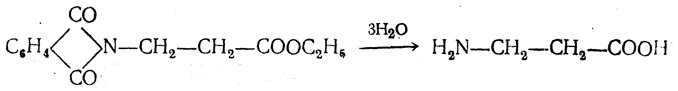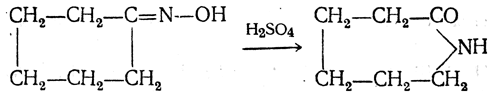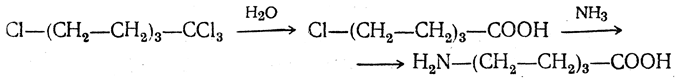- Характерные химические свойства азотсодержащих органических соединений. Важнейшие способы получения аминов и аминокислот
- Содержание:
- Амины
- Способы получения аминов
- Химические реакции аминов
- Аминокислоты
- Способы получения аминокислот
- Химические свойства аминокислот
- Каким способом получают аминокислоты
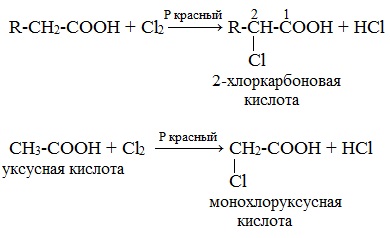
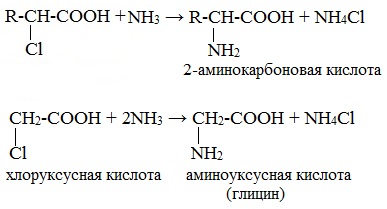
- 1. Из карбоновых кислот через их галогенопроизводные в радикале
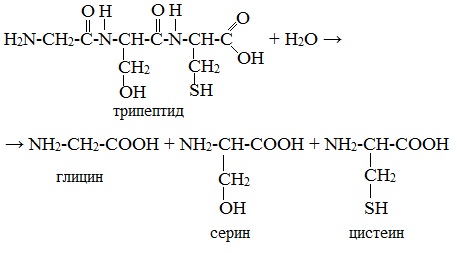
- 2. Гидролиз пептидов и белков
- 3. Восстановление нитрозамещенных карбоновых кислот (применяется обычно для получения ароматических аминокислот)
- 4. Микробиологический синтез
- Общие способы получения аминокислот
Характерные химические свойства азотсодержащих органических соединений. Важнейшие способы получения аминов и аминокислот
Содержание:
Азотсодержащие соединения – это молекулы, имеющие в строении атомы азота. С помощью инертного газа образуются различные классы органических соединений:
- амины (R-NH2);
- аминокислоты (H2N-R-COOH);
- нитрилы (R-CN);
- нитросоединения (R-NO2);
- нитрозосоединения (R-NO) и т.д.
Амины
Амины – аммиачные производные, которые рассматриваются как замещенный продукт водородных атомов на органические радикалы (R).
У аминов так же как и в растворе аммиака проявляются слабые основные свойства. Классифицируются по числу катионов водорода, которые заместили, на:
Амины разделяют по характеру органических заместителей:
- предельные – молекулы без ароматических колец и кратных связей;
- непредельные – в молекулах присутствуют ароматические кольца и кратные связи.
В азоте амина находится внешняя электронная пара, за счет которой способен проявлять себя как основание. Но существуют ионы, являющиеся продуктами замещения на радикал всех водородных атомов – NH4 + .
Когда аминогруппа в ароматических аминах связана с ароматическим ядром, то амины являются более слабыми снованиями по сравнению с аммиаком. Так как неподеленная электронная пара атома азота смещается в сторону ароматической π-системы бензольного кольца, таким образом электронная плотность на атоме азота снижается. Бензольное ядро, обладающее большей энергией ионизации, оттягивает на себя электронную плотность молекулы. В результате основные свойства снижаются в реакциях, например взаимодействия с водой. Так, анилин реагирует только с сильными кислотами, а с водой практически не реагирует.
Способы получения аминов
Амины сохраняют многие особенности аммиака – запах, растворимость в воде, сильные основные свойства.
- Реакция Гофмана (алкилирование аммиака и его производных)
- R-Hal + NH3 → R-NH2 + HHal
- R-Hal + R ’ -NH2 + NH3 → R-NH-R ’ + NH4Hal
- R-Hal + R-NH-R → N-(R)3 + NH4Hal
- Взаимодействие непредельных аминов со спиртами – способ получения вторичных аминов
- С6H5-NH2 + CH3-OH → С6H5-NH-CH3 + H2O
- Пропускание паров спирта и аммиака над катализатором оксида алюминия при температуре в 30°C
- R-OH + NH3 → R-NH2 + H2O
- Расщепление амидов при взаимодействии с гипохлоридом калия
- R-CONH2 + KBrO → R-NH2 + Cl2 + KBr
- Восстановление нитросоединений в присутствии катализатора в виде никеля, палладия – способ получения первичных аминов
- R-NO2 + H2 → R-NH2 + H2O
Химические реакции аминов
Химические свойства определяются реакционными центрами (РЦ):
- первый РЦ, представляющий собой неподеленную пару электронов на азоте;
- второй РЦ, определяющийся полярностью связи N-H;
- третий РЦ – это бензольное кольцо.
У непредельных аминов роль первого РЦ незначительна, т.к. ароматическое кольцо смещает на себя плотность и неподеленная пара электронов азота в проявлении основных свойств не принимает участия.
I. Основные свойства
Атом азота в амине принимает участие в образовании ковалентной связи, выступая как донор, благодаря внешней паре электронов. Т.о. амины присоединяют катион водорода и проявлять свойства основания.
По сравнению с основностью аммиака, амин проявляет большие основные свойства. Это связано с тем, что индуктивный эффект направлен на аминогруппу и азот становится более активным, т.е. прочнее связывает протон.
Степень проявления основных свойств зависит от величины частичного отрицательного заряда на азоте. Чем он выше, тем сильнее основные свойства.
Предельные первичные амины реагируют с азотистой кислотой с образованием спиртов, азота N2 и воды. Например:
- Признаком этой реакции — выделение азота.
- Реакция является качественной на первичные амины .
- Реакцию проводят поэтапно:
- смешивают амин с раствором соли азотистой кислоты (нитрита)
- добавляют к этой смеси сильную минеральную кислоту. При взаимодействии нитритов с сильными минеральными кислотами образуется азотистая кислота, которая потом реагирует с амином:
- R – NH2+ KNO2 + HCl = R – OH + N2 + KCl + H2O
Вторичные амины дают при похожих условиях маслянистые жидкости с характерным запахом, поэтому и название N-нитрозаминами.
Третичные амины с азотистой кислотой не взаимодействуют.
Сгорание любых аминов приводит к образованию углекислого газа, воды и азота:
II. Слабые кислотные свойства
Первичным и вторичным аминам характерен разрыв связи N-H и замещение атома водорода на другие функциональные группы.
- Взаимодействия с металлами
- R-NH2 + Na → R-NH-Na + H2
- Алкилирование (реакция Гофмана) под действием катализатора в виде аммиака
- R-NH2 + R’-Hal → R-NH-R’ + HHal
- Ацилирование
- CH3-COCl + CH3-NH2 → CH3-NH-CO-CH3 + HHal
III. Качественная реакция на амины
Она осуществляется с помощью азотистой кислоты, которую необходимо получить непосредственно в момент реакции.
Амины широко применяют в фармакологической промышленности в препаратах с упрощенной адреналиновой структурой, а также в строительной отрасли в качестве компонента полимерных материалов.
Аминокислоты
Аминокислоты – это органические вещества, которые включают в себя аминогруппу (-NH2) и карбоксигруппу (-COOH). Единая формула аминокислот – (NH2)xR(COOH)y, где x и y принимают значения больше одного.
Аминокислоты – это элементарная структура белков, из которых состоят структуры животного тела. В состав белков входят только α-аминокислоты. На планете Земля 20 аминокислот, общая формула которых H2N-CH(R)-COOH. Эта двадцатка содержит в себе радикалы – углеводородные, кислородсодержащие, серосодержащие, азотсодержащие и ароматические.
Способы получения аминокислот
Аминокислоты – это бесцветные кристаллы, плавящиеся при 200°C. Они способны растворяться в воде, но нерастворимы в эфирах.
- Взаимодействие α-галогенпроизводных карбоновых кислот с аммиачным раствором (действие температур)
- Cl-R-COOH + NH3 → H2N-R-COOH + HCl
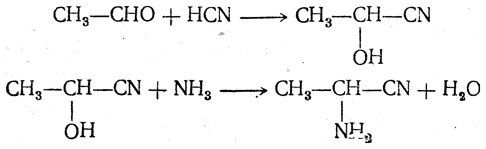
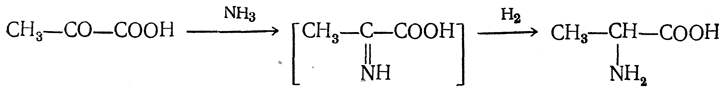
- Воздействие аммиака и цианистого водорода на альдегиды и кетоны
- R-CHO + NH3 → R-CH=NH + H2O
- R-CH=NH + HCN → R-CH(NH2)-CN
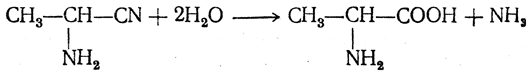
- R-CH(NH2)-CN + 2H2O → R-CH(NH2)-COOH + NH3
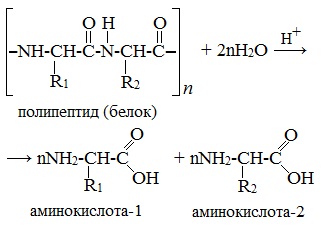
- Взаимодействие белка с водой при добавлении кислоты
- [-HN-CH(R)-C(O)-NH-CH(R’)-C(O)-]n + HOH → H2N-CH(R)-COOH + H2N-CH(R’)-COOH
- Добывание аминокислот клеточными организмами
Микроорганизмы при нарушении нормальной жизнедеятельности начинают синтезировать аминокислоту, вместо того, чтобы накапливать белок.
Химические свойства аминокислот
В составе аминокислот две функциональные группы, поэтому с одной группой веществ они ведут себя как амины, с другой как карбоновые кислоты, а с третьей – проявляют все свойства сразу.
I. Карбоксильная группа – ее химические реакции
Многие химические свойства, характерные для спиртов, встречаются и у аминокислот. Реакции задействуют только группу –COOH.
- Кислотные свойства
- Особые взаимодействия
- H2N-CH(R)-COOH + R’-OH → H2N-CH(R)-COOR’ + H2O2. Особые взаимодействия
- H2N-CH(R)-COOH + SOCl2 → H2N-CH(R)-COCl + SO2 + HCl
- Реакция с аммиаком
- H2N-CH(R)-COOH + NH3 → H2N-CH(R)-CONH2 + H2O
- Элиминирование молекулы диоксида углерода (под действием температур)
- H2N-CH(R)-COOH → H2N-CH2-R + CO2
II. Аминогруппа – ее химические реакции
Многие химические свойства, характерные для аминов, встречаются и у аминокислот. Реакции задействуют только группу ––NH2.
- Реакции с кислотами
- H2N-CH(R)-COOH + HCl → [H3N + -CH(R)-COOH]Cl —
- Введение ацила в аминокислоту
- H2N-CH(R)-COOH + CH3-COCl → CH3-C(O)-NH-CH(R)-COOH + HCl
- Введение алкильного остатка в состав аминокислоты
- H2N-CH(R)-COOH + 2СH3J → (CH3)2-N(R)-CH(R)-COOH + 2HJ
- Отщепление аминогруппы от аминокислоты под действием температур
- COOH-CH2-CH(NH2)-COOH → COOH-CH2-CH2-COOH + NH3
III. Реакции по обеим группам
Ряд химических свойств связан с действием реактивов на все функциональные группы.
- Синтез комплексных солей
- Нагревание β-аминокислот
- H2N-CH2-CH2-COOH → CH2=CH-COONH4 + H2O
- Нагревание γ и δ-аминокислот
Аминокислоты – это звенья, из которых составляются нити белка. Из них строятся живые ткани на планете. Почти все аминокислоты организм использует для построения органики тела. Некоторые играют роль медиаторов в нервных импульсах, другие используются в химической промышленности для проведения синтезов, третьи – в пищевой отрасли.
Источник
Каким способом получают аминокислоты
Большинство аминокислот можно получить в результате химических реакций или при гидролизе белков.
1. Из карбоновых кислот через их галогенопроизводные в радикале
Галогенирование карбоновых кислот
Взаимодействие α-галогенкарбоновых кислот с избытком аммиака (аммонолиз)
На второй стадии происходит замещение атома галогена в галогенкарбоновых кислотах на аминогруппу. Выделяющийся при этом хлороводород связывается избытком аммиака в хлорид аммония:
2. Гидролиз пептидов и белков
α-Аминокислоты образуются при гидролизе пептидов и белков.
При гидролизе белков обычно образуются сложные смеси α-аминокислот, однако с помощью специальных методов из этих смесей можно выделять отдельные чистые аминокислоты.
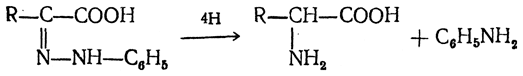
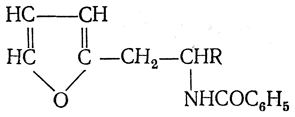
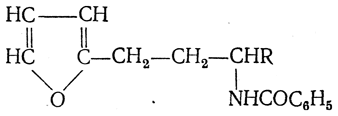
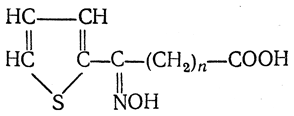
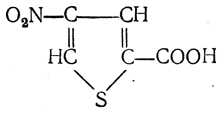
3. Восстановление нитрозамещенных карбоновых кислот (применяется обычно для получения ароматических аминокислот)
4. Микробиологический синтез
Этот способ основан на способности специальных микроорганизмов вырабатывать в питательной среде в процессе жизнедеятельности определенную α-аминокислоту.
Источник
Общие способы получения аминокислот
Чтобы свести к минимуму нежелательное образование иминодиуксусной кислоты по реакции
реакцию ведут с очень большим избытком аммиака или в присутствии карбоната аммония, который защищает аминогруппу. Образующееся карбаминовое производное аминокислоты
легко разлагается при нагревании.
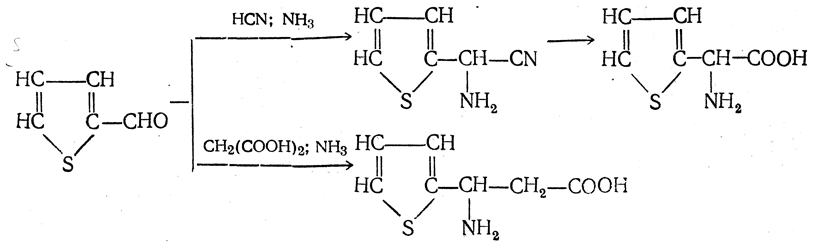
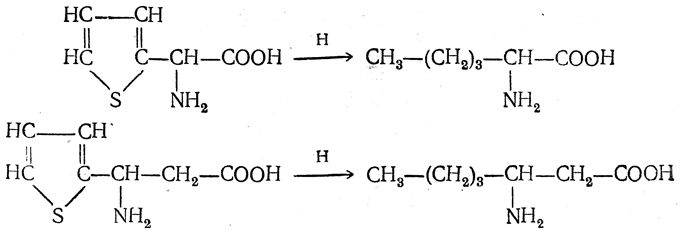
2. Получение из циангидринов альдегидов и кетонов (циангидринный метод). Важной реакцией получения α-аминокислот является действие аммиака на циангидрины альдегидов и кетонов
Аминонитрилы можно получить также, действуя на альдегиды или кетоны непосредственно цианистым аммонием. Эта реакция приобрела особое значение после того, как Н. Д. Зелинский с сотрудниками показали, что синильную кислоту и аммиак или цианистый аммоний можно заменить смесью водных растворов хлористого аммония и цианистого калия, в результате обменного разложения дающих цианистый аммоний, который и вступает в реакцию с альдегидами или кетонами:
3. Синтезы из сложных эфиров, содержащих подвижный атом водорода. Большое значение приобрели синтезы аминокислот из малонового, циануксусного и ацетоуксусного эфиров. Пользуясь этими методами, можно получить аминокислоты, содержащие различные радикалы.
а) Синтез из малонового эфира. Из малонового эфира получают нитрозомалоновый эфир, который восстанавливают в аминомалоновый эфир водородом в присутствии катализатора или цинком в кислой среде:
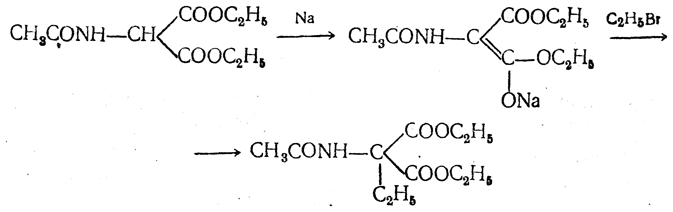
полученный ацетиламиномалоновый эфир алкилируют, действуя на него последовательно металлическим натрием и галоидным алкилом:
После омыления и декарбоксилирования получается α-аминокислота:
б) Синтез из циануксусного эфира проводится аналогично синтезу из малонового эфира.
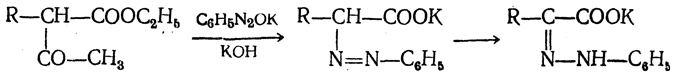
в) Синтез из ацетоуксусного эфира. При действии на однозамещенные ацетоуксусные эфиры раствором фенилдиазотата, а затем щелочью отщепляется уксусная кислота и образуется неустойчивое азосоединение, которое изомеризуется в фенилгидразон соответствующей кетокислоты:
Восстановление фенилгидразона кетокислоты цинком в солянокислой спиртовой среде приводит к α-аминокислоте:
Этот метод синтеза аминокислот предложен В. В. Феофилактовым.
4. В осст а н ов л ен и е оксимов или гидразонов альдегид о- или кетонокислот. Например:
Особенно удачным оказался метод, состоящий в одновременном действии на кетокислоту аммиака и водорода в присутствии катализатора (платины или палладия). По-видимому, при этом промежуточно образуется иминопроизводное:
Этим методом синтезируют аминокислоты, содержащие изотоп азота N 15 («меченый азот»), которыми пользуются при изучении поведения аминокислот в живом организме.
В последние годы предложено еще два новых общих метода синтеза аминокислот, основанных на использовании дешевого промышленного сырья — фурана и тиофена.
5. Синтез аминокислот из фурановых производных (метод А. П. Терентьева и Р. А. Грачевой) основан на легкости окисления фуранового кольца перманганатом с образованием карбоксильной группы. Если в боковой цепи у фуранового кольца имеется аминогруппа (обычно защищенная бензоильной группой), то в результате окисления получается бензоиламинокислота, а после омыления — сама аминокислота. В зависимости от положения аминогруппы в цепи получается α-, β-, γ- и т. п. кислота.
Так, при окислении 1-бензоиламино-1-(α-фурил)-алкилов получается α-кислота, например из 1-бензоиламино-1-(α-фурил)-этана — бензоил-α-аланин:
Для получения β-аминокислот пользуются 2-бензоиламино-1-(α-фурил)алкилами
а для синтеза γ-аминокислот берут 3-бензоиламино-1-(α-фурил)-алкилы:
6. Синтез аминокислот из производных тиофен а (метод Я. Л. Гольдфарба, Б. П. Фабричного и И. Ф. Шалавиной) основан на восстановительном десульфировании производных тиофена или его гомологов водородом скелетного никелевого катализатора. В зависимости от взятого производного десульфирование приводит к аминокислотам с разным положением аминогруппы.
Из тиенилальдегида обычными методами получают тиенил-α- или тиенил-β -аминокислоты
которые затем десульфируют:
Из разных оксиминокислот тиофенового ряда
можно получать аминокислоты с любым положением аминогруппы. Наконец, можно ввести непосредственно в ядро тиофена нитро- и карбоксильную группы, например
и затем прогидрировать полученное соединение никелем Ренея. Этим путем можно получать только γ- и δ-аминокислоты.
Способы получения аминокислот с удаленной аминогруппой (β-, γ-, δ-, ε-, . . ., ω-аминокислот). Кроме общих способов получения аминокислот, дающих возможность синтезировать как
α-аминокислоты, так и кислоты с удаленной аминогруппой, для получения последних имеются и специальные методы, рассматриваемые ниже.
1. Присоединение аммиака к ненасыщенным кислотам. При действии аммиака в спиртовом растворе на α,β-ненасыщенные кислоты или их эфиры аминогруппа вступает в β-положение. Как и в случае присоединения воды при образовании оксикислот, аммиак, вероятно, сначала присоединяется в положение 1,4 системы сопряженных двойных связей:
Поэтому присоединение аммиака идет против правила Марковникова.
Реакцию удобнее проводить, действуя на эфир акриловой кислоты не аммиаком, а фталимидом (в присутствии гидроокиси триметилфениламмония как катализатора):
Гидролизом образующегося эфира фталил-β-аланина можно получить и сам β-аланин:
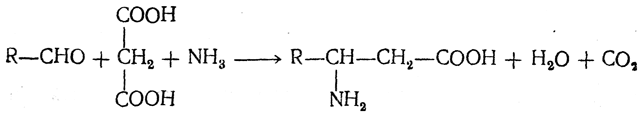
2. Конденсация альдегидов с малоновой кислотой в присутствии спиртового раствора аммиака. Этот путь синтеза, разработанный В. М. Родионовым с сотрудниками, является общим методом получения β-аминокислот:
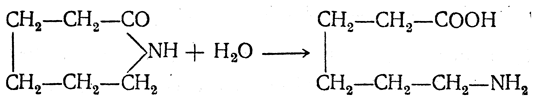
3. Получение из оксимов циклических кетон о в. δ- и ε-Аминокислоты получают чаще всего из оксимов циклических кетонов путем так называемой бекмановской перегруппировки. Так, например, оксим циклогексанона под действием серной кислоты изомеризуется с расширением цикла, в результате чего образуется ε-капролактам:
Эта реакция используется для производства капролактама в промышленном масштабе. Гидролиз капролактама приводит к ε-аминокапроновой кислоте:
4. Получение «-аминокислот действием аммиака на ω-га л о и дз а м еще н н ы е кислоты. ω-Аминокислоты с нечетным числом углеродных атомов получаются из тетрахлоралканов типа Сl—(СН2—СН2)n—ССl3, являющихся продуктами реакции теломеризации. Гидролиз тетрахлоралканов указанного типа, полученных из этилена и четыреххлористого углерода, приводит к ω-хлоркарбоновым кислотам, которые действием избытка аммиака превращаются в соответствующие ω-аминокислоты, например:
Этим путем получается ω-аминоэнантовая кислота — исходный продукт для получения синтетического волокна энант (А. Н. Несмеянов, Р. X. Фрейдлина и др.).
Источник