§ 57. Индикаторы в методе кислотно-основного титрования
Как известно, реакция нейтрализации не сопровождается видимыми изменениями, например переменой окраски раствора. Поэтому для фиксирования точки эквивалентности приходится прибавлять к титруемому раствору какой-либо подходящий индикатор.
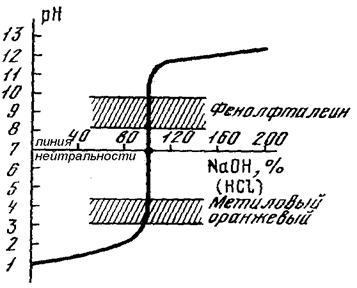
Выше указывалось, что признаком достижения точки эквивалентности служит приобретение раствором определенного значения рН. Индикаторами в методе кислотно-основного титрования служат вещества, окраска которых меняется в зависимости от изменения величины рН. Поэтому эти вещества называют кислотно-основными индикаторами. Окраска каждого из индикаторов изменяется внутри определенного узкого интервала значений рН, причем этот интервал зависит только от свойств данного рН-индикатора и совершенно не зависит от природы реагирующих между собой кислоты и основания.
К индикаторам предъявляются следующие требования:
1) окраска индикатора при близких значениях рН должна явно отличаться;
2) изменение цвета индикатора должно происходить резко в небольшом интервале значений рН;
3) окраска индикатора должна быть возможно более интенсивной;
4) количество щелочи или кислоты, необходимое для изменения окраски индикатора, должно быть настолько мало, чтобы не искажались результаты титрования;
5) изменение окраски индикатора должно быть вполне обратимым процессом.
Все эти требования сильно ограничивают выбор индикаторов. Несмотря на большое число известных веществ, обладающих индикаторными свойствами, число широко применяемых индикаторов не превышает двадцати. Очень большое значение имеет правильный выбор индикатора при титровании.
Сделать правильный выбор индикатора для титриметрического анализа можно лишь хорошо зная теорию индикаторов.
Источник
Подбор индикаторов при кислотно-основном титровании



Правильный подбор индикатора имеет большое значение для титрования, т.к. от этого, в первую очередь, будет зависеть точность анализа и достоверность полученных результатов.
Для решения данной задачи строят кривые титрования, которые выражают зависимость изменения рН реакционной среды от объёма добавленного титранта. Необходимые для построения такого графика значения водородного показателя раствора можно рассчитать теоретически или определить экспериментально с помощью потенциометрии.
Типичная кривая титрования, полученная при взаимодействии между собой сильной кислоты (НСl) и щёлочи (NaOH), представлена на рис 54. Если двигаться вдоль кривой слева направо – проследим ход изменения рН при титровании кислоты щёлочью.
Рис. 54. Кривая титрования сильной кислоты (HCl) сильным основанием (NaOH)
Наоборот, движение справа налево соответствует изменению рН при титровании щелочи кислотой.
Как следует из рисунка 54 общий вид кривой является довольно своеобразным. В начале титрования рН среды по сравнению с исходным его значением изменяется очень медленно, вплоть до расходования более 90% вещества в титруемом растворе. Затем наблюдается более быстрое изменение рН и, наконец, вблизи точки эквивалентности добавление буквально одной капли титранта вызывает резкое (взрывное) изменение величины рН сразу на несколько единиц. Этот участок на кривой титрования называется иначе скачком титрования. Дальнейшее добавление титранта опять сопровождается медленным и плавным изменением рН.
Скачок титрования является самой существенной частью кривой титрования, т.к. на нём всегда лежит точка эквивалентности.
С помощью него осуществляют выбор индикатора, решают некоторые другие вопросы.
Чем больше скачок титрования, тем точнее будут результаты анализа и более широкий выбор индикаторов для его проведения.
На величину скачка титрования влияют, в первую очередь, кислотные и основные свойства исходных веществ, их содержание в растворе, а также температура реакционной среды.
Чем более сильными являются используемые кислота и основание, и чем выше их концентрация в растворе, тем скачок титрования больше. Так, при молярной концентрации химического эквивалента НСl и NaOH, равной 0,1 моль/дм 3 , величина скачка титрования составляет почти 6 единиц рН (рис. 54).
В случае сантимолярных растворов этих же исходных веществ (0,01 моль/дм 3 ) скачок титрования составляет уже 4 единицы рН. Обычно на практике редко используют растворы с концентрацией химического эквивалента вещества больше 0,2 моль/дм 3 . Это связано с тем, что значительно возрастают ошибки титрования за счёт неточности измерения количественных характеристик (объема, массы растворенной навески) более концентрированных растворов.
Повышение температуры оказывает существенное влияние на скачок титрования в сторону его уменьшения вследствие возрастания константы диссоциации воды. Отсюда следует, что кислотно-основное титрование лучше проводить, не прибегая к нагреванию.
Для титрования можно использовать только те индикаторы, интервал перехода которых полностью лежит на скачке титрования. Причём, чем более симметрично он расположен относительно точки эквивалентности, тем более предпочтительным является данный индикатор (в идеале точка эквивалентности должна лежать в середине интервала перехода).
Показатель титрования (рТ) индикатора при этом тоже будет лежать на скачке титрования и может отклониться от точки эквивалентности в ту или иную сторону. Наиболее оптимальным является случай, когда рТ индикатора совпадает на графике с точкой эквивалентности, но это происходит далеко не всегда. В случае несовпадения значений рН для рТ индикатора и точки эквивалентности возникает так называемая индикаторная ошибка, связанная с недотитровыванием части исследуемого раствора или, наоборот, с добавлением небольшого избытка титранта. Однако следует подчеркнуть, что если рТ индикатора лежит внутри скачка титрования, то индикаторная ошибка составляет не более 0,3% и, таким образом, существенно не влияет на результаты анализа.
Сопоставляя данные таблицы 20 и вид графика на рис. 54, можно сделать вывод, что при титровании соляной кислоты щёлочью (NаOH) в качестве индикатора можно использовать метиловый оранжевый (рТ≈4) или фенолфталеин (рТ≈9). В первом случае рТ индикатора будет иметь меньшее значение, чем рН в точке эквивалентности, и мы будет немного не дотитровывать кислоту. Во втором случае рТ индикатора лежит выше точки эквивалентности на скачке титрования. Вследствие этого мы добавим щелочи немного больше, чем нужно (другими словами, мы слегка перетитруем исследуемый раствор).

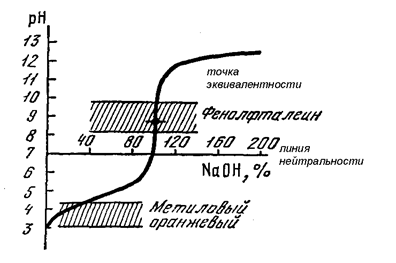
При титровании слабой кислоты (СН3СООН) сильным основанием (NаOH) точка эквивалентности смещается в щелочную область (рН>7) из-за гидролиза образующейся соли (СН3CООNa) и лежит выше линий нейтральности на кривой титрования с проходящим через рН = 7 и параллельной оси абсцисс (рис. 55). Скачок титрования становится менее выраженным. Например, при сравнении с предыдущим случаем (рис. 54) он уменьшается на 3 единицы рН. Уменьшение (сужение) скачка титрования выражено тем сильнее, чем более слабой является исследуемая кислота. Для кислот, имеющих значение (рКа>7), скачок титрования будет практически отсутствовать, т.е. он выродится в точку перегиба на кривой титрования. Такие кислоты нельзя количественно измерить в водном растворе с помощью титриметрии. Необходимо использовать в этом случае неводное титрование, т.е. в растворителе, который бы значительно усилил кислотные свойства слабой кислоты.
Рис. 55. Кривая титрования слабой кислоты (СН3СООН) сильным основанием (NaOH)
Как видно из рис. 55, метиловый оранжевый нельзя использовать в качестве индикатора при титровании уксусной кислоты или любой другой слабой кислоты, т.к. его интервал перехода лежит ниже скачка титрования. В противном случае мы будем получать заниженные результаты вследствие недотитровывания исследуемого раствора.
А вот интервал перехода фенолфталеина лежит внутри скачка титрования, поэтому его можно применять в качестве индикатора при титровании слабой кислоты. Соответственно, для этих же целей можно использовать и другие индикаторы, интервал перехода которых и величина рТ лежат в области значений рН >7: тимолфталеин, ализариновый красный и т.д. (табл. 20).
При взаимодействии слабого основания с сильной кислотой наблюдаются такие же отличительные способности (по сравнению с реакцией нейтрализации между сильными электролитами), как и при титровании слабой кислоты щелочью. Так, вследствие гидролиза соли, образующейся в ходе реакции, точка эквивалентности тоже не совпадает с точкой нейтральности, но смещается в данном случае уже в кислую область (рН 7, не укладывается в скачок титрования и лежит за его пределами. При использовании данных индикаторов мы будем перетитровывать исследуемый раствор и получать завышенные результаты анализа.
При взаимодействии слабой кислоты и слабого основания изменение рН происходит постепенно на протяжении всего процесса титрования. Скачок титрования на соответствующей кривой практически отсутствует, вследствие чего точно определить момент эквивалентности и подобрать для данного случая соответствующий индикатор становится невозможным.
На основании данного заключения в кислотно-основном методе анализа в качестве рабочих растворов (титрантов) не используют растворы слабой кислоты либо слабого основания.
Кривые титрования многоосновных (полипротонных) кислот, многокислотных оснований и их солей
Многоосновные кислоты и многокислотные основания в водных растворах диссоциируют ступенчато. Кривые титрования данных соединений могут иметь в соответствии с этим несколько (два и более) скачков титрования и точек эквивалентности. На рисунке 57 представлена кривая титрования трёхосновной фосфорной кислоты (H3PO4) щелочью (NaOH). Отчётливо видно наличие двух скачков титрования. Первый из них соответствует достижению первой точки эквивалентности, когда кислота оттитровывается по первой ступени
Н3PO4 + NaOH = NaH2PO4 + H2O с образованием однозамещённого дигидрофосфата натрия.
Второй скачок титрования соответствует взаимодействию кислоты с NaOH по второй ступени с образованием двухзамещённого гидрофосфата натрия:
Третий скачок титрования на графике, соответствующий реакции:
Na2HPO4 + NaOH = Na3PO4 + H2O, отсутствует, т.к. константа диссоциации фосфорной кислоты на третьей стадии очень мала (≈10 -13 ).
При необходимости можно оттитровать Н3PO4 по всем трём стадиям. Для этого в исследуемый раствор вводят CaCl2, в результате чего образуется малорастворимый Ca3(PO4)2
2H3PO4 + 3 CaCl2 = Ca3(PO4)2↓ + 6HCl, а выделившееся эквивалентное количество соляной кислоты титруют обычным способом.
Рис. 57. Кривая титрования трехосновной фосфорной кислоты (H3PO4) сильным основанием (NaOH)
Как следует из рис. 57, каждой стадии нейтрализации фосфорной кислоты соответствует свой индикатор. Если мы будем использовать метиловый оранжевый, то оттитруем фосфорную кислоту только по первой стадии. При использовании фенолфталеина оттитруем фосфорную кислоту как двухосновную с образованием двухзамещенной соли. Соли слабых многоосновных кислот и щелочных металлов при взаимодействии с сильными кислотами ведут себя как слабые основания, и кривые титрования таких веществ тоже имеют несколько точек эквивалентности и скачков титрования (рис. 58) вследствие ступенчатого протекания реакции:
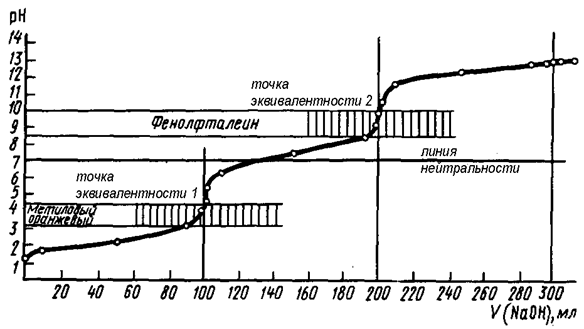
Na2CO3 + HCl = NaHCO3 + NaCl – точка эквивалентности 1
NaHCO3 + HCl = NaCl + CO2 + H2O – точка эквивалентности 2
Рис. 58. Кривая титрования раствора Na2CO3 сильной кислотой (HCl)
В смеси сильных кислот можно установить только их общую суммарную концентрацию, раздельное определение компонентов невозможно. Кривая титрования такой смеси не отличается от кривой титрования одной сильной кислоты (рис. 54).
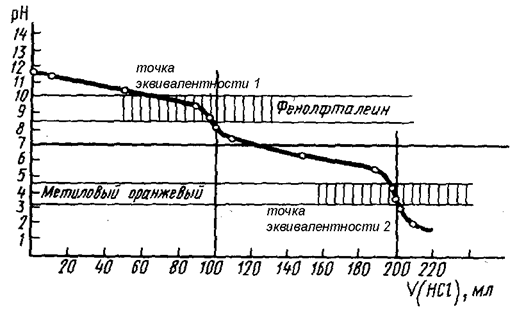
При титровании сильной кислоты в присутствии слабой наблюдаются два скачка титрования (рис. 59) и используются 2 индикатора, причём первой оттитровывается с использованием метилового оранжевого сильная кислота, и скачок титрования в данном случае невелик. Соответственно, и погрешность измерения может достигать нескольких процентов.
HCl + NaOH = NaCl + H2O – точка эквивалентности 1
CH3COOH + NaOH = CH3COONa + H2O – точка эквивалентности 2.
Зато скачок титрования, соответствующий нейтрализации слабой кислоты, является хорошо выраженным. При титровании в присутствии фенолфталеина можно точно определить суммарное содержание обеих кислот в смеси.
Титрование смеси нескольких слабых кислот практически не отличается от титрования многоосновной кислоты, подробно рассмотренной нами выше.
Рис. 59. Кривая титрования смеси кислот (НСl и СН3СООН) раствором NaOH
Точное количественное определение более сильной кислоты в этой смеси возможно, если константы диссоциации присутствующих кислот различаются на четыре и более порядка.
Источник
Каким способом подбирают индикаторы при кислотно основном титровании
В методах, основанных на реакциях кислотно-основного взаимодействия, кривые титрования обычно показывают зависимость pH раствора от объема добавленного титранта. Для построения кривой титрования рассчитывают значения pH : 1) до точки эквивалентности (т.э.); 2) в т.э.; 3) после т.э.
Кривая титрования сильной кислоты сильным основанием
Рассчитаем кривую титрования 100,0 мл 0,1 М HCl раствором 0,1 М NaOH Гидроксид натрия (щелочь). при комнатной температуре. Поскольку объем раствора при титровании изменяется, это необходимо учитывать множителем 100/(100+ V ), где V –объем добавленного раствора титранта. Расчет кривой титрования начинается с вычисления pH исходного титруемого раствора. Сильные кислоты и основания в воде диссоциированы полностью, поэтому концентрация ионов H + будет равна концентрации HCl , т.е. 0,10 M , и, следовательно, pH =1,00. Значения pH раствора HCl до точки эквивалентности будут определяться концентрацией неоттитрованной кислоты. При добавлении 10,0 мл щелочи в реакцию вступает 10% кислоты, и в растворе остается 90% неоттитрованной HCl . Концентрация ионов водорода в этом растворе составит [ H + ]=0,1 × 0,9 × 100/110=0,082 моль/л, т.е. pH =1,09. Если добавить 50 мл щелочи, прореагирует 50% исходного количества кислоты, и концентрация ионов водорода в растворе составит [ H + ]=0,1 × 0,5 × 100/150=0,033 моль/л, а pH =1,48. При объеме добавленной щелочи 90,0 мл в растворе останется 10% первоначального количества кислоты, т.е. [ H + ]=0,1 × 0,1 × 100/190=0,0053 моль/л и pH =2,28. При введении 99,0 мл щелочи в растворе будет [ H + ]=0,1 × 0,01 × 100/199=0,000503 моль/л и pH =3,30, а если добавить 99,9 мл, то [ H + ]=0,1 × 0,001 × 100/199,9=5 × 10 -5 моль/л и pH =4,30. В точке эквивалентности, когда вся кислота прореагирует со щелочью, pH раствора определяется автопротолизом воды и становится равным 7,00.
После точки эквивалентности pH раствора будет определяться количеством добавленной щелочи. Концентрация ионов OH — растет пропорционально количеству добавленного раствора NaOH . Если добавить 0,1 мл (0,1 × 10 ‑3 л) 0,1 М NaOH , то объем раствора увеличится до 200,1 мл (0,2001 л) и [ OH ‑ ]=0,1 × 10 ‑3 × 0,1/0,2001=5 × 10 ‑5 моль/л, pOH =4,30 и pH =9,70. При добавлении 1,0 мл (1 × 10 ‑3 л) щелочи [ OH ‑ ]=1 × 10 ‑3 × 0,1/0,201=4,98 × 10 ‑4 моль/л, pOH =3,30, pH =10,70. Аналогично находим, что при добавлении 10,0 мл щелочи [ OH ‑ ]=1 × 10 ‑2 × 0,1/0,210=4,76 × 10 ‑3 моль/л, pOH =2,32, pH =11,68. По этим данным построим кривую титрования в координатах pH – V ( NaOH ) (рисунок 2.1)


Рисунок 2.1 — Кривая титрования 100,0 мл 0,1 М HCl 0,1 М раствором NaOH
Прямую, параллельную оси абсцисс и пересекающую ось ординат при pH 7,0, называют линией нейтральности. Прямую, параллельную оси ординат и пересекающую ось абсцисс при значении эквивалентного объема щелочи ( VNaOH =100,0 мл), называют линией эквивалентности. Точку пересечения кривой титрования с линией эквивалентности, называют точкой эквивалентности, а пересечение кривой титрования с линией нейтральности – точкой нейтральности.
При титровании сильной кислоты сильным основанием точка эквивалентности и точка нейтральности совпадают.
В начале титрования pH изменяется очень медленно. Например, если оттитровать половину имеющегося количества кислоты ( V NaOH =50,0 мл), pH среды изменится примерно на 0,5 единицы по сравнению с исходным (от 1,00 до 1,48). Даже если оттитровать 90% кислоты, изменение pH составит всего 1,28. С уменьшением концентрации остающейся кислоты возрастание pH при титровании становится более резким. Титрование последних 0,1% кислоты приводит к резкому изменению pH на 2,7 единицы (от 4,30 до 7,00). Введение избытка в 0,1% NaOH по сравнению с эквивалентным количеством вызывает рост pH раствора также на 2,7 единицы.
Резкое изменение pH в области точки эквивалентности называют скачком титрования.
Это наиболее важный участок кривой титрования, так как по нему осуществляется выбор индикатора и решается ряд других важных вопросов, связанных с процессом титрования.
Погрешности многих титриметрических методов не превышают 0,1%, поэтому величиной скачка считают изменение pH от состояния, когда раствор недотитрован на 0,1%, к состоянию, когда он на 0,1% перетитрован. В рассматриваемом случае при интервале ± 0,1% скачок титрования составляет 5,4 единиц (от 4,3 до 9,7). Расчеты показывают, что величина скачка титрования зависит от концентрации реагирующих веществ. Чем ниже концентрация реагентов, тем меньше скачок титрования. Повышение температуры также уменьшает скачок титрования.
Кривая титрования сильного основания сильной кислотой рассчитывается аналогично и представляет собой зеркальное отображение (относительно линии нейтральности) кривой титрования сильной кислоты сильным основанием.
Кислотно-основные индикаторы и их выбор
Для обнаружения точки эквивалентности применяют индикаторы. В кислотно-основном титровании наиболее широкое распространение получили цветные индикаторы, окраска которых зависит от pH раствора.
По химической природе кислотно-основные индикаторы являются слабыми органическими кислотами или основаниями, частично диссоциирующими в растворе: HInd 
Равновесие диссоциации индикатора характеризуется константой диссоциации K HInd

Рассмотрим один из наиболее распространенных индикаторов – метиловый оранжевый. Кислая форма HInd у него имеет красный цвет, а основная Ind — – желтый. Из выражения ( 1 ) можно получить

Это соотношение показывает, что с увеличением концентрации ионов водорода дробь [ Ind — ]/[ HInd ] будет уменьшаться. Если кислотность раствора снижать, то отношение [ Ind — ]/[ HInd ] будет расти, и интенсивность желтой окраски увеличится. При логарифмировании ( 2 ) получаем

Глаз человека способен установить появление окрашенных частиц, если их содержание будет примерно в 10 раз или более превышать концентрацию других окрашенных частиц в растворе. Это означает, что если отношение [ Ind ‑ ]/[ HInd ] будет близко к значению 10/1 и больше, то цвет раствора на глаз будет восприниматься как цвет индикаторной формы Ind ‑ , а если отношение [ Ind ‑ ]/[ HInd ] будет близко к 1/10 и меньше, то цвет раствора будет восприниматься как окраска индикаторной формы HInd . При выполнении условия 0,1 ≤ [ Ind ‑ ]/[ HInd ] ≤ 10 наблюдается промежуточная окраска индикатора.
Интервал pH , в котором индикатор изменяет свою окраску, называется интервалом перехода индикатора.
Чтобы его найти, подставим предельные значения отношения [ Ind ‑ ]/[ HInd ], равные 10 и 0,1, в уравнение ( 3 )
Выражение ( 4 ) показывает, что интервал перехода индикатора составляет примерно две единицы pH . Область pH , в которой находится интервал перехода, определяется величиной pKHInd . Если pKHInd 7, интервал перехода находится в кислой области; если pKHInd > 7 – в щелочной. Соотношение ( 4 ) является приближенным, так как оно не учитывает спектральную чувствительность глаза и разницу в интенсивности окраски кислотной и щелочной форм индикатора. Например, у метилового оранжевого pKHInd =3,36. Из формулы ( 4 ) следует, что изменение цвета метилового оранжевого будет происходить в области pH от 2,36 до 4,36. Экспериментально наблюдаемый интервал перехода этого индикатора лежит в области pH 3,1…4,4. В таблице 1 приведены параметры некоторых часто используемых кислотно-основных индикаторов (см. также табл. 1 Приложения).
Источник