Химия NeoChemistry — мы знаем о химии всё
 |  | ||||||||||||||||||||||||||||||||||||
| Задачи по химии (с решениями) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
|
| Химия общая | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
| Химия неорганическая | |||||||||
|---|---|---|---|---|---|---|---|---|---|
|
Какой способ образования ковалентной связи называют донорно-акцепторным?
Какие химические связи имеются в ионах NH4¯ и BF4 ¯? Укажите донор и акцептор.
Решение.
При наличии незавершенных внешних энергетических уровней атома он стремится к их заполнению путем химического взаимодействия и образования химической связи с другими атомами. В образовании химической связи участвуют валентные электроны, т. е. электроны незавершенного внешнего уровня. Химические связи могут быть 3-ех типов:
ковалентная, ионная и металлическая.
Ковалентная связь. Когда два атома приближаются друг к другу на близкое расстояние, электронные орбитали внешних незавершенных уровней перекрывают друг друга, притягивают ядра атомов и образуют общее электронное облако или ковалентную связь.
Если возникает одно общее электронное облако или ковалентная связь, то связь называется одинарной, если две пары электронов образуют связь – она называется двойной и т.д.
Итак, ковалентная связь это химическая связь, осуществляемая электронными парами. Это двухэлектронная и двухцентровая (удерживает два ядра) связь. Соединения с ковалентной связью называются гомеополярными или атомными. Связь может быть неполярной (электронное облако равномерно удалено от центров ядер атомов, как в двухатомных молекулах О2 N2 H2) и полярной (смещенной в сторону атома с большей электроотрицательностью как NH3, HCl).
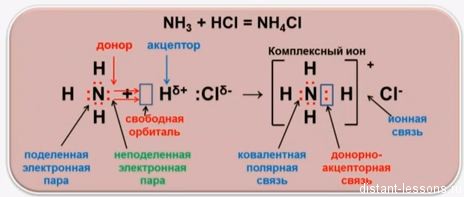
Разновидностью ковалентной связи является донорно-акцепторная связь. В этом случае химическая связь возникает за счет двухэлектронного облака одного атома и свободной орбитали другого атома как в случае образования иона аммония NH4+.
Схема образования связей иона аммония NH4+.
Строение атома N: N7 1s²/2s²2p3
Источник
Химия, Биология, подготовка к ГИА и ЕГЭ
Ковалентная связь — химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.
Понятие «металлические свойства» — определяется способностью отдавать электроны — на этом основана металлическая химическая связь. Что происходит, когда встречаются атомы неметаллов?
«Неметаллические свойства» — определяются способностью принимать электроны, отбирать их у других атомов.
Давайте рассмотрим образование молекулы водорода (H2)
Первый вид ковалентной связи — ковалентная неполярная
У каждого атома водорода имеется электрон. При сближении двух атомов возникает такой момент, когда оба электрона будут находиться рядом. Что получается?
Образуется общая электронная пара
У левого атома (зеленый) стало 2 электрона на орбитали — очень выгодное энергетическое состояние, и у правого атома (синий) стало 2 электрона — тоже выгодное состояние. Образуется молекула водорода.
При образовании неполярной ковалентной связи плотность равномерно распределена между обоими атомами
Получается, что ковалентная связь «стягивает» атомы в молекулы.
Второй вид ковалентной связи — ковалентная полярная
Точно таким же образом образуется молекула воды — кислород добавляет себе пару электронов, что делает его электронную оболочку завершенной, каждый атом водорода тоже становится двухэлектронным — у всех стабильное энергетическое состояние.
Образуются две электронные пары — 2 ковалентные связи.
При образовании полярной ковалентной связи — электронная плотность смещается в сторону одного из атомов. Поляризация возникает в следствии различия электроотрицательностей элементов в паре.
Третий вид химической связи — ковалентная донорно-акцепторная связь
Вообще, нельзя назвать это видом связи, это, скорее, механизм образования связи.
Донорно-акцепторный механизм — способ образования ковалентной химической связи между двумя атомами или группой атомов, осуществляемый за счет неподеленной пары электронов атома-донора и свободной орбитали атома-акцептора
Давайте подведем итог по видам ковалентной связи:
- Ковалентную неполярную связь образуют одинаковые атомы неметаллов и атомы водорода;
- Ковалентную полярную химическую связь образуют разные атомы неметаллов и неметаллы с водородом;
- Донорно-акцепторную ковалентную связь образуют атомы, имеющие неподеленную электронную пару — доноры электронов (например, азот, кислород, фосфор, сера и т.д.) и атомы, образующие пустую орбиталь — акцепторы (например, протон водорода и некоторые d-элементы.
Источник
Химические связи
Химическая связь — связь между атомами в молекуле или молекулярном соединении, возникающая в результате переноса электронов с одного атома на другой, либо обобществления электронов для обоих атомов.
Различают несколько типов химических связей: ковалентная, ионная, металлическая, водородная.
Ковалентная связь ( лат. со — совместно + valens — имеющий силу)
Ковалентная связь возникает между двумя атомами по обменному механизму (обобществление пары электронов) или донорно-акцепторному механизму (электронов донора и свободной орбитали акцептора).
Ковалентной связью соединены атомы в молекулах простых веществ (Cl2, Br2, O2), органических веществ (C2H2), а также, в общем случае, между атомами неметалла и другого неметалла (NH3, H2O, HBr).
Если атомы, образующие ковалентную связь, имеют одинаковые значения электроотрицательности, то связь между ними называется ковалентной неполярной связью. В таких молекулах нет «полюса» — электронная плотность распределяется равномерно. Примеры: Cl2, O2, H2, N2, I2.
Если атомы, образующие ковалентную связь, имеют разные значения электроотрицательности, то связь между ними называется ковалентной полярной. В таких молекулах имеется «полюс» — электронная плотность смещена к более электроотрицательному элементу. Примеры: HCl, HBr, HI, NH3, H2O.
Ковалентная связь может быть образована по обменному механизму — обобществлению электронной пары. В таком случае каждый атом «одинаково» вкладывается создание связи. Например, два атома азота, образующие молекулу N2, отдают по 3 электрона с внешнего уровня для создания связи.
Существует донорно-акцепторный механизм образования ковалентной связи, при котором один атом выступает в качестве донора неподеленной электронной пары. Другой атом не тратит свои электроны, а только лишь предоставляет орбиталь (ячейку) для этой электронной пары.
Рекомендую выучить список веществ, образованных по донорно-акцепторному механизму:
- NH4 + — в ионе аммония
- NH4 + Cl, NH4 + Br — внутри иона аммония во всех его солях
- NO3 — — в нитрат ионе
- KNO3, LiNO3 — внутри нитрат иона во всех нитратах
- O3 — озон
- H3O + — ион гидроксония
- CO — угарный газ
- K[Al(OH)4], Na2[Zn(OH)4] — во всех комплексных солях есть хотя бы одна ковалентная связь, возникшая по донорно-акцепторному механизму
Ионная связь
Ионная связь — один из видов химической связи, в основе которого лежит электростатическое взаимодействие между противоположно заряженными ионами.
В наиболее частом случае ионная связь образуется между типичным металлом и типичным неметаллом. Примеры:
Большой подсказкой служит таблица растворимости, ведь все соли имеют ионные связи: CaSO4, Na3PO4. Даже ион аммония не исключение, между катионом аммония и различными анионами образуются ионные связи, например в соединениях: NH4I, NH4NO3, (NH4)2SO4.
Часто в химии встречаются несколько связей внутри одной молекулы. Рассмотрим, например, фосфат аммония, обозначив тип каждой связи внутри этой молекулы.
Металлическая связь
Металлическая связь — вид химической связи удерживающая вместе атомы металла. Этот тип связи выделен отдельно, так как его отличием является наличие высокой концентрации в металлах электронов проводимости — «электронного газа». По природе металлическая связь близка к ковалентной.
«Облако» электронов в металлах способно приходить в движение под различным воздействием. Именно оно является причиной электропроводности металлов.
Водородная связь
Водородная связь — вид химической связи, образующийся между некоторыми молекулами, содержащими водород. Одна из наиболее частых ошибок считать, что в самом газе, водороде, имеются водородные связи — это вовсе не так.
Водородные связи возникают между атомом водорода и другим более электроотрицательным атомом (O, S, N, C).
Необходимо осознать самую важную деталь: водородные связи образуются между молекулами, а не внутри. Они имеются между молекулами:
- H2O
- NH3
- HF
- Органических спиртов: С2H5OH, C3H7OH
- Органических кислот: CH3COOH, C2H5COOH
Отчасти за счет водородных связей наблюдается то самое исключение, связанное с усилением кислотных свойств в ряду галогеноводородных кислот: HF → HCl → HBr → HI. Фтор является самым ЭО-ым элементов, сильно притягивает к себе атом водорода другой молекулы, что снижает способность кислоты отщеплять водород и снижает ее силу.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Какой способ образования ковалентной связи называется донорно-акцепторным. Какие химические связи имеются в ионах?
Какой способ образования ковалентной связи называется донорно-акцепторным. Какие химические связи имеются в ионах: NH4 + , BF4 – ? Укажите донор и акцептор.
Решение: Химическая связь, образованная за счет пары электронов одного атома (донора) и вакантной орбитали второго атома (акцептора), называется донорно-акцепторной или донорно-акцепторным механизмом образования ковалентной связи.
Совокупность химически связанных атомов (молекула, кристалл) состоит из атомных ядер и связанных с ними электронов. Положение атомных ядер экспериментально устанавливается довольно точно. Распределение электронной плотности фиксируется менее точно, поскольку в молекуле каждый из валентных электронов может быть обнаружен в окрестности любого ядра. Тем не менее каждому из этих валентных электронов, как и в атоме, соответствует определенный энергетический уровень, называемый молекулярной орбиталью (МО). При построении молекулярных орбиталей используется метод линейной комбинации атомных орбиталей (ЛКАО), обозначаемый аббревиатурой МО – ЛКАО.
Метод валентных связей (МВС), основан на предположении, что химическая связь осуществляется одной или несколькими электронными парами, локализованными между взаимодействующими атомами.
Источник