Каким способом необходимо разбавлять серную кислоту

Разбавление кислоты ‑ приготовление раствора меньшей концентрации. Раствор меньшей концентрации содержит большее количество воды. Однако ни в коем случае при разбавлении нельзя добавлять воду в кислоту. Существует строгое правило: лить кислоту в воду! Нарушение этого правила может привести к несчастному случаю. Дело в том, что при приготовлении растворов часто происходит их разогрев. При приготовлении растворов серной кислоты происходит сильный разогрев. В нашем опыте при добавлении небольшого количества концентрированной серной кислоты температура поднимается до 90 градусов! Представьте, что будет, если добавить воду в кислоту. Вода, попав в массу концентрированной кислоты, моментально разогреется до кипения — произойдет выброс кислоты.Особенно опасна кислота для глаз и слизистых оболочек. Поэтому правила техники безопасности при приготовлении растворов – правила сохранения жизни и здоровья. На производстве при составлении растворов мастера надевают резиновые сапоги и перчатки, резиновые фартуки и защитные очки. И всегда кислоту льют в воду, а не наоборот.
Оборудование: химические стаканы, термометр.
Техника безопасности . Следует соблюдать правила работы с концентрированными кислотами.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
Источник
Большая Энциклопедия Нефти и Газа
Разбавление — концентрированная серная кислота
Разбавление концентрированной серной кислоты следует производить, приливая кислоту в воду, а не наоборот. В противном случае возможно вскипание жидкости и ее разбрызгивание. Кислоту следует приливать малыми порциями или очень тонкой струей при непрерывном перемешивании раствора. При сильном разогревании раствора следует дать ему охладиться. [1]
Разбавление концентрированной серной кислоты и растворение едких щелочей проводят в фарфоровой посуде ( стаканах, чашках), так как эти процессы сопровождаются выделением большого количества тепла. При разбавлении серной кислоты ее следует медленно приливать в воду, все время перемешивая. Приливание воды в кислоту категорически запрещается, что обусловлено бурным вскипанием и разбрызгиванием горячей кислоты, которая может вызвать тяжелые ожоги. [2]
Для разбавления концентрированной серной кислоты удобно пользоваться правилом креста. [3]
Для разбавления концентрированной серной кислоты ее следует тонкой струей вливать в воду, перемешивая при этом раствор; воду нельзя приливать к кислоте, так как это вызовет разбрызгивание кислоты. [4]
SOt-Для разбавления концентрированной серной кислоты ее следует тонкой струей вливать в воду, перемешивая при этом раствор; воду нельзя приливать к кислоте, так как это вызовет вскипание и сильное разбрызгивание кислоты. [5]
При разбавлении концентрированной серной кислоты , при смешивании концентрированной серной и азотной кислот и вообще, если смешивание веществ сопровождается выделением тепла, можно пользоваться только тонкостенной химической посудой из стекла или фарфоровой посудой. [6]
При разбавлении концентрированной серной кислоты , при смешивании концентрированной серной и азотной кислот и, вообще, если смешивание веществ сопровождается выделением тепла можно пользоваться только тонкостенной химической посудой из стекла или фарфоровой посудой. [7]
При разбавлении концентрированной серной кислоты вливают кислоту в воду небольшими порциями, при помешивании. [8]
При разбавлении концентрированной серной кислоты следует медленно и осторожно приливать кислоту к воде, но не наоборот. Так как при разбавлении кислоты выделяется большое количество тепла, то при приливании воды к кислоте может произойти разбрызгивание кислоты. [9]
При разбавлении концентрированной серной кислоты водой необходимо вливать кислоту тонкой струйкой в воду, а не наоборот, так как лри разбавлении кислоты выделяется большое количество тепла. Если ввести в кислоту небольшое количество воды, последняя мгновенно вскипит и кислоту вместе с паром может выбросить из чана. [10]
При разбавлении концентрированной серной кислоты водой следует постепенно вливать кислоту в холодную воду, постоянно помешивая. [11]
При разбавлении концентрированной серной кислоты вливают кислоту в воду небольшими порциями, при помешивании. [12]
При разбавлении концентрированной серной кислоты следует медленно и осторожно приливать кислоту в воду, но не наоборот. При разбавлении кислоты выделяется большое количество тепла, поэтому при при-ливании воды к кислоте может произойти разбрызгивание кислоты. [13]
При разбавлении концентрированной серной кислоты ни в коем случае не разрешается вливать в нее воду ( или разбавленную кислоту), так как смешение кислоты с водой сопровождается выделением большого количества тепла, и первые капли воды ( или разбавленной серной кислоты), попадая в концентрированную кислоту, вызовут ее быстрое вскипание и разбрызгивание. [14]
При разбавлении концентрированной серной кислоты , при смешивании концентрированной серной и азотной кислот и вообще, если смешивание веществ сопровождается выделением тепла; можно пользоваться только тонкостенной химической посудой из стекла или фарфоровой посудой. [15]
Источник
Серная кислота
Серная кислота — сильная двухосновная кислота, при н.у. маслянистая жидкость без цвета и запаха.
Обладает выраженным дегидратационным (водоотнимающим) действием. При попадании на кожу или слизистые оболочки приводит к тяжелым ожогам.
Замечу, что существует олеум — раствор SO3 в безводной серной кислоте, дымящее жидкое или твердое вещество. Олеум применяется при изготовлении красителей, органическом синтезе и в производстве серной кислот.
Получение
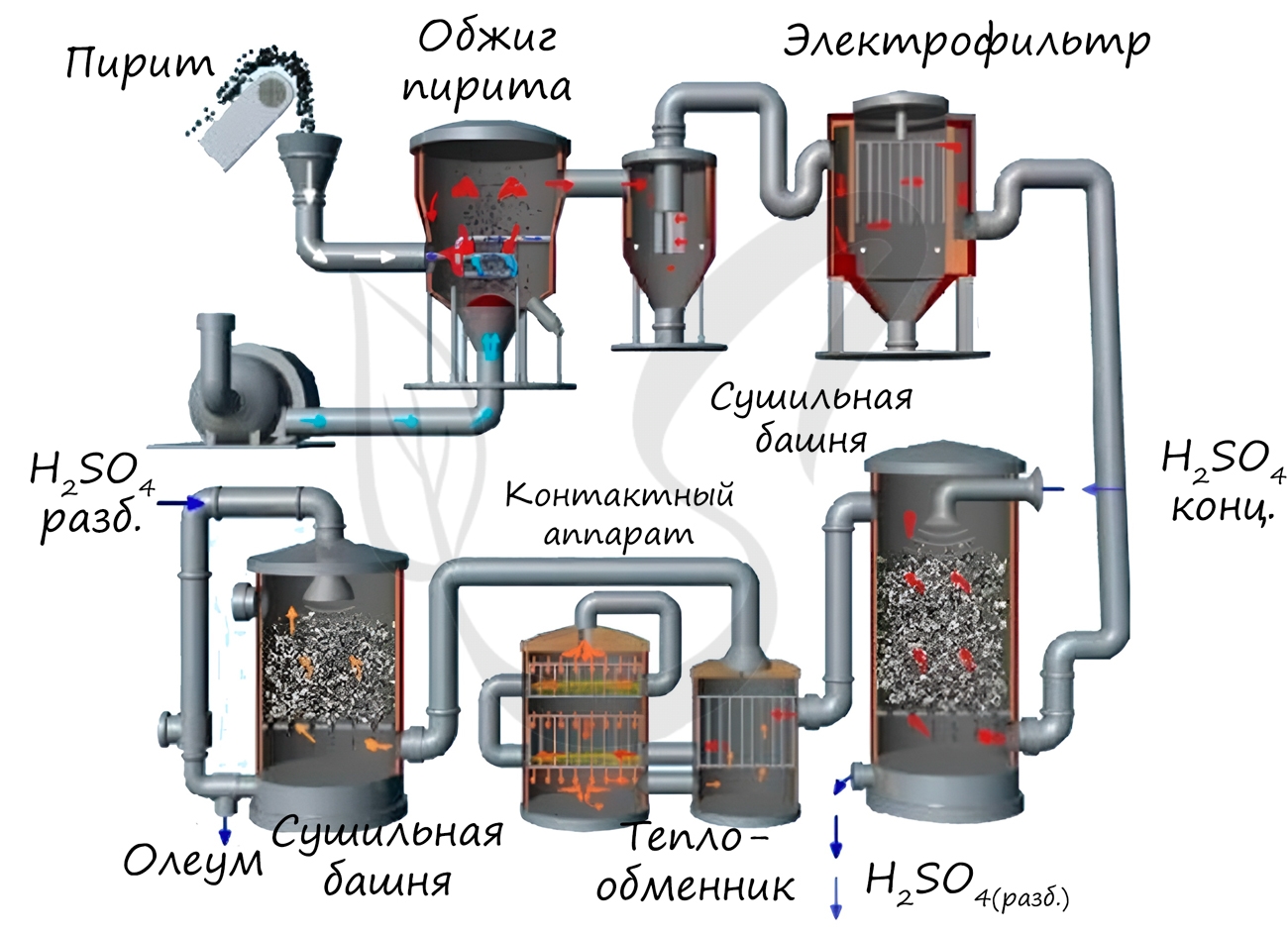
Известны несколько способов получения серной кислоты. Применяется промышленный (контактный) способ, основанный на сжигании пирита, окислении образовавшегося SO2 до SO3 и последующим взаимодействием с водой.
Нитрозный способ получения основан на взаимодействии сернистого газа с диоксидом азота IV в присутствии воды. Он состоит из нескольких этапов:
В окислительной башне смешивают оксиды азота (II) и (IV) с воздухом:
Смесь газов подается в башни, орошаемые 75-ной% серной кислотой, здесь смесь оксидов азота поглощается с образованием нитрозилсерной кислоты:
В ходе гидролиза нитрозилсерной кислоты получают азотистую кислоту и серную:
В упрощенном виде нитрозный способ можно записать так:
Химические свойства
В водном растворе диссоциирует ступенчато.
Сильная кислота. Реагирует с основными оксидами, основаниями, образуя соли — сульфаты.
KOH + H2SO4 = KHSO4 + H2O (гидросульфат калия, соотношение 1:1 — кислая соль)
2KOH + H2SO4 = K2SO4 + 2H2O (сульфат калия, соотношение 2:1 — средняя соль)
С солями реакция идет, если в результате выпадает осадок, образуется газ или слабый электролит (вода). Серная кислота, как и многие другие кислоты, способна растворять осадки.
Серная кислота окисляет неметаллы — серу и углерод — соответственно до угольной кислоты (нестойкой) и сернистого газа.
Реакции с металлами
Реакции разбавленной серной кислоты с металлами не составляют никаких трудностей: она реагирует как самая обычная кислота, например HCl. Все металлы, стоящие до водорода, вытесняют из серной кислоты водород, а стоящие после — не реагируют с ней.
Подчеркну, что реакции разбавленной серной кислоты с железом и хромом не сопровождаются переходом этих элементов в максимальную степень окисления. Они окисляются до +2.
Cu + H2SO4(разб.) ⇸ (реакция не идет, медь не может вытеснить водород из кислоты)
Концентрированная серная кислота ведет себя совершенно по-иному. Водород никогда не выделяется, вместо него с активными металлами выделяется H2S, с металлами средней активности — S, с малоактивными металлами — SO2.
Холодная концентрированная серная кислота пассивирует Al, Cr, Fe, Ni, Be, Co. При нагревании или амальгамировании данных металлов реакция идет.
Обратите особое внимание, что при реакции железа, хрома с концентрированной серной кислотой достигается степень окисления +3. В подобных реакциях с разбавленной серной кислотой (написаны выше) достигается степень окисления +2.
Иногда в тексте задания даны подсказки. Например, если написано, что выделился газ с неприятным запахом тухлых яиц — речь идет об H2S, если же написано, что выделилось простое вещество — речь о сере (S).
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Разбавление и смешивание серной кислоты
В заводских условиях нередко бывает необходимо разбавить концентрированную серную кислоту водой или повысить концентрацию разбавленной кислоты, добавляя к ней концентрированную. Для этого предварительно надо установить или проверить концентрацию ИСХОДНЫХ КИСЛОТ, определив в НИХ содержание H2SO4.
При добавлении воды к концентрированной кислоте (олеуму или моногидрату) можно получить кислоту любой концентрации, однако при смешивании концентрированной. серной кислоты с водой выделяется большое количество тепла. Кислота может нагреться до кипения, произойдет бурное выделение паров и возможен выброс раствора из сосуда. Поэтому кислоты смешивают в специальных аппаратах — смесителях, соблюдая соответствующие меры предосторожности.
Смесители для приготовления кислоты низкой концентрации делают из кислотостойкого материала, для приготовления концентрированной кислоты — из чугуна. В производстве серной кислоты используют смесители разнообразного устройства. В некоторых случаях смеситель представляет собой чугунный эмалированный изнутри котел, помещенный в стальной кожух и закрытый крышкой. Смешиваемые кислоты поступают в чугунный эмалированный с обеих сторон конус, в котором они перемешиваются, после чего вытекают в котел. Для отвода тепла, выделяющегося при смешивании кислот, в пространство между котлом и кожухом непрерывно подается струя воды, омывающая стенки аппарата.
В некоторых случаях кислота после смешивания в небольшом резервуаре поступает в трубы, орошаемые снаружи водой, где одновременно охлаждается и дополнительно перемешивается.
При смешивании концентрированной серной кислоты с водой или с более разбавленной серной кислотой необходимо рассчитывать количество смешиваемых кислот. Расчеты проводят по так называемому правилу креста. Ниже приводится несколько примеров такого расчета.
1. Определить количество 100%-ной серной кислоты и воды, которые необходимо смешать для получения 45%-ной II2SO|.
Слева указывают концентрацию более концентрированной кислоты (в данном случае 100%), а справа — более разбавленной (п данном случае 0%—вода). Ннже, между ними, указывают заданную концентрацию (45%). Через цифру, обозначающую эту концентрацию, проводят дне перекрещивающиеся линии, а на их концах указывают соответствующую разность чисел:
Полученные под кислотами исходных концентраций цифры показывают, сколько массовых частей кислоты каждой из указанных концентраций необходимо смешать для получения кислоты заданной концентрации. В нашем примере для приготовления 45%-ной кислоты следует смешать 45 масс. ч. 100%-ной кислоты н 55 масс. ч. воды.
Эту же задачу можно решить исходя из общего баланса II2SO4 (или S03) в серной кислоте:
Числитель левой части уравнения соответствует содержанию H2S04 (в кг) в I кг 100%-ной серной кислоты, знаменатель — общему количеству заданного раствора (в кг). Правая часть уравнения соответствует концентрации серной кислоты в долях единицы. Решая уравнение, получаем х—1,221 кг. Это значит, что к 1 кг 100%- ной серной кислоты надо добавить 1,221 кг воды, при этом получится 45%-ная кислота.
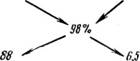
2. Определить количество 20%-ного олеума, которое следует смешать с 10%-нон серной кислотой для получения 98%-ной кислоты.
Задача решается также по правилу креста, однако концентрацию олеума в этом примере нужно выразить в % H2SO4, используя уравнения (9) н (8):
А —= 81,63 + 0,1837-20—= 85,304;
Б 1,225-85,304 — 104,5.
По правилу креста
Следовательно, для получения 98%-ной серной кислоты требуется смешать 88 масс. ч. 20%-ного олеума и 6,5 масс. ч. 10%-иой серной кислоты.
Источник
Каким способом необходимо разбавлять серную кислоту

Разбавление кислоты ‑ приготовление раствора меньшей концентрации. Раствор меньшей концентрации содержит большее количество воды. Однако ни в коем случае при разбавлении нельзя добавлять воду в кислоту. Существует строгое правило: лить кислоту в воду! Нарушение этого правила может привести к несчастному случаю. Дело в том, что при приготовлении растворов часто происходит их разогрев. При приготовлении растворов серной кислоты происходит сильный разогрев. В нашем опыте при добавлении небольшого количества концентрированной серной кислоты температура поднимается до 90 градусов! Представьте, что будет, если добавить воду в кислоту. Вода, попав в массу концентрированной кислоты, моментально разогреется до кипения — произойдет выброс кислоты.Особенно опасна кислота для глаз и слизистых оболочек. Поэтому правила техники безопасности при приготовлении растворов – правила сохранения жизни и здоровья. На производстве при составлении растворов мастера надевают резиновые сапоги и перчатки, резиновые фартуки и защитные очки. И всегда кислоту льют в воду, а не наоборот.
Оборудование: химические стаканы, термометр.
Техника безопасности . Следует соблюдать правила работы с концентрированными кислотами.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
Источник