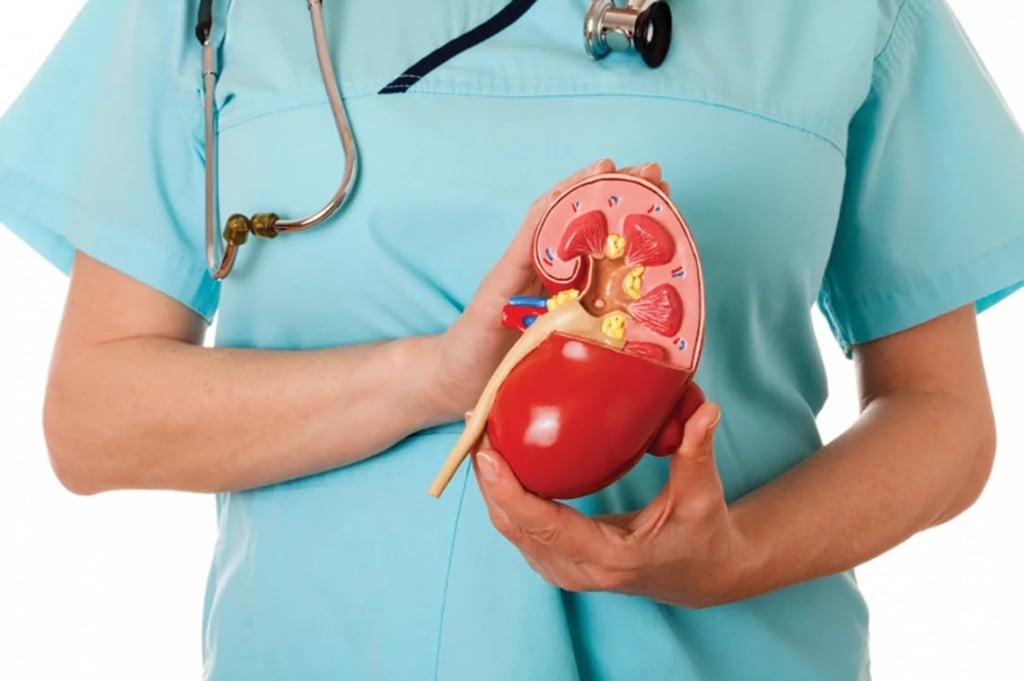
Перитонеальный диализ
Катетер брюшной полости врачи устанавливают для перитонеального диализа – очистки крови внутри организма, которую пациент может выполнять самостоятельно в домашних условиях. Перитонеальный катетер – это тонкая пластиковая трубка размером с карандаш, которую вводят в брюшную полость через переднюю стенку живота. Основным показанием к установке катетера для перитонеального диализа является хроническая почечная недостаточность. В Юсуповской больнице созданы все условия для лечения пациентов с заболеваниями почек:
- благоустроенные палаты любого класса комфортности;
- использование современной диагностической аппаратуры ведущих мировых производителей;
- применение инновационных методов лечения эффективными зарегистрированными в РФ препаратами;
- обеспечение пациентов индивидуальными средствами личной гигиены и диетическим питанием.
В клинике терапии работают профессора и врачи высшей категории. Терапевты принимают коллегиальное решение в отношении тактики лечения пациентов. Все тяжёлые случаи заболевания обсуждаются на заседании экспертного совета. Грамотный медицинский персонал профессионально выполняет все процедуры и осуществляет уход за пациентами. Родственники имеют возможность находиться в палате совместно с больным.
Показания и противопоказаний к установке перитонеального катетера
Перитонеальный диализ предоставляет вполне реальные возможности мобильной очистки крови. После проведения катетера через брюшную полость кровь очищается не через внешний фильтр, а через брюшину пациента. Брюшина – это тонкая серозная оболочка, расположенная на внешней поверхности полостных органов и внутренней стенке брюшной. Она является изумительным мембранным фильтром. Исключительное преимущество установки катетера через брюшную полость – сохранение подвижности и самостоятельности пациента на весь продолжительный период очищения крови.
Перитонеальный диализ показан следующим пациентам:
- с низким артериальным давлением и выраженной диабетической ангиопатией, которым нет возможности установить сосудистый доступ;
- с тяжёлыми заболеваниями сердечно-сосудистой системы, у которых проведение сеансов гемодиализа чревато риском развития осложнений;
- с нарушением свертываемости крови при наличии противопоказаний к применению средств, препятствующих тромбообразованию;
- не желающим зависеть от аппарата для гемодиализа;
- с непереносимостью синтетических мембран фильтров для гемодиализа.
Перитонеальный катетер не устанавливают при наличии спаек в брюшной полости, а также увеличении внутренних органов, установленных низких фильтрационных характеристиках брюшины, наличии дренажей в брюшной полости (колостомы, цистостомы). Катетер брюшной полости не устанавливают пациентам с гнойными заболеваниями кожи в области брюшной стенки, страдающим психическими расстройствами, не позволяющими больному правильно провести сеанс перитонеального диализа, и ожирением, когда эффективность очистки крови ставится под сомнение.
Техника установки перитонеального катетера
Для проведения перитонеального диализа необходимо установить в брюшную полость катетер. Фото можно увидеть в интернете. Перитонеальный катетер должен находиться в области малого таза, иначе возникают трудности в обмене диализирующего раствора. Существует несколько способов проведения катетера через брюшную полость.
Процедуру установки перитонеального катетера выполняют следующим способом:
- производят послойное иссечение тканей до брюшины;
- делают небольшой разрез в брюшине;
- при помощи жёсткого проводника вслепую вводят катетер в область малого таза;
- крепят перитонеальный катетер к брюшине посредством прошивания манжеты, которая находится на нем.
Указанный способ установки перитонеального катетера является травматичным. Рана заживает 1-4 недели. Катетер через брюшную полость невозможно провести пациентам, подвергавшимся операциям на брюшной полости, при наличии спаек. Высока вероятность повреждения проводником внутренних органов, так как его вводят вслепую.
Перитонеальный катетер также устанавливают с помощью специального набора инструментов, который включает:
- мини стилет;
- металлическую канюлю;
- проводник, покрытый пластиком;
- лапароскоп очень малого диаметра (2,2 мм);
- специальные расширители.
Мини стилетом производят прободение брюшной полости. В образовавшееся отверстие вводят лапароскоп и нагнетают стерильный воздух. Проводят осмотр брюшной полости. Лапароскоп с канюлей проводят к месту предполагаемой установки катетера. После этого их удаляют. Затем с помощью стилета, установленного в дилататоре, по проводнику в брюшную полость вслепую без лапароскопического контроля вводят катетер.
Метод имеет ряд недостатков:
- не обеспечивает надёжной фиксации катетера;
- существует риск смещения стилета с катетером и повреждения внутренних органов;
- всплытие катетера лишает пациентов возможности проведения перитонеального диализа.
С помощью этого метода невозможно проводить перитонеальный диализа у пациентов с предшествующими операциями на брюшной полости, поскольку не производится иссечение спаек. Методика выполнима только при наличии прямого катетера.
Профилактика осложнений установки перитонеального катетера
Для того чтобы предотвратить осложнения установки перитонеального катетера, манжету дальней части катетера предварительно прошивают кисетным швом, оставляя 2 свободных конца нити. Катетер вводят в брюшную полость под контролем лапароскопа и с помощью специального устройства фиксируют к брюшине. Затем осуществляют сквозной прокол тканей передней брюшной стенки, нажимают на рукоятку и выводят в брюшную полость нитевидную петлю.
С помощью зажима вдевают в неё один из свободных концов нити и обратным ходом устройства выводят его на поверхность кожи. Аналогичным образом выводят второй свободный конец нити и завязывают узел. Его который погружают через пункционное отверстие под кожу. Устройство с фиксированной в нём нитью устанавливают на уровне проекции удалённой части катетера, насквозь прокалывают ткани, выводят в брюшную полость петлю с нитью. Из неё вокруг дальней части катетера формируют петлю. Конец нити вдевают в петлю и после выведения устройства на поверхность завязывают узел.
Получите консультацию по установке перитонеального катетера, позвонив по телефону Юсуповской больницы. Специалисты контакт-центра клиники ответят на все ваши вопросы.
Источник
Перитонеальный диализ
Версия: Клинические протоколы 2006-2019 (Беларусь)
Общая информация
Краткое описание
ПЕРИТОНЕАЛЬНЫЙ ДИАЛИЗ ПАЦИЕНТОВ ПРИ ХРОНИЧЕСКОЙ БОЛЕЗНИ ПОЧЕК
Перитонеальный диализ
— один из методов почечно-заместительной терапии, принцип которого заключается в интракорпоральном очищении крови от уремических токсинов при помощи брюшины, которая выполняет роль полупроницаемой мембраны. Через поры брюшины в диализирующий раствор, введенный в брюшную полость, поступают низко- и среднемолекулярные токсины, а также избыток воды из крови больного. Для длительного жизнеобеспечения лиц с терминальной стадией ХПН требуется регулярная (несколько раз в сутки) замена диализирующего раствора в брюшной полости, которая, при использовании данного метода, производится самим пациентам в амбулаторных условиях, в связи с чем метод получил название — постоянный амбулаторный перитонеальный диализ (далее-ПАПД).
Методика автоматизированного перитонеального диализа (далее-АПД) применяется в виде двух способов — непрерывного автоматизированного перитонеального диализа (далее-НАПД) и интермиттирующего автоматизированного перитонеального диализа (далее-ИАПД). Особенностью этих способов служит необходимость в специальном аппарате — циклере, который по заданной программе производит автоматические циклы замены раствора в брюшной полости. Этот процесс чаще происходит ночью. Днем брюшная полость при НАПД заполнена диализирующим раствором, при ИАПД — пуста.
Лечение
36. Показания к ПАПД
Постоянный амбулаторный перитонеальный диализ является альтернативой программному гемодиализу и главным показанием к нему является наступление V стадии ХБП со всеми ее проявлениями:
общие признаки эндотоксикоза — слабость, недомогание, тошнота, рвота, головная боль, субфебрильная температура тела, нестабильная центральная гемодинамика;
нарушение водно-электролитного обмена — гипергидратация (при олигоанурии) с периферическими и полостными отеками, угроза развития отека легких, повышение или понижение уровня калия, натрия и хлора в крови;
нарушения азотистого баланса — мочевина сыворотки крови свыше 30 ммоль/л, креатинина свыше 1,0 ммоль/л, снижение скорости клубочковой фильтрации по эндогенному креатинину ниже 10 мл/мин (у пациентов сахарным диабетом и детей ниже 15 мл/мин);
развитие декомпенсированного метаболического ацидоза — pH капиллярной крови менее 7,35, стандартный бикарбонат (SB) — ниже 20 ммоль/л, дефицит буферных оснований (BE) — меньше -10 ммоль/л;
угрожающие клинические проявления в виде отека головного мозга и легких, уремическое коматозное или предкоматозное состояние.
Постоянный перитонеальный диализ показан: пациентам с терминальной стадией ХЕИ, у которых по тем или иным причинам невозможно создание постоянного сосудистого доступа для программного гемодиализа (маленькие дети, лица с низким артериальным давлением, пациенты с периферической ангиопатией при сахарном диабете, множественными тромбозами или окклюзиями артерио-венозных фистул);
пациентам с тяжелыми осложнениями со стороны сердечнососудистой системы, у которых создание артерио-венозного сброса приведет к дополнительной нагрузке на сердце;
пациентам с геморрагическими осложнениями, у которых использование антикоагулянтов во время гемодиализа способно создать угрозу профузных кровотечений;
пациентам, с тяжелыми аллергическими реакциями на контакт с синтетическими диализными мембранами;
пациентам, желающим вести более активный образ жизни, которому препятствует привязанность к аппаратуре для гемодиализа.
37. Противопоказания к ПАПД
наличие спаек в брюшной полости, препятствующих равномерному распределению диализирующего раствора по всей брюшине;
гепато-, сплено-, нефромегалия, ограничивающая поверхность брюшины и уменьшающая роль ее как полупроницаемой мембраны;
документированные низкие транспортные характеристики перитонеальной мембраны (низкие показатели перитонеального эквилибрационного теста, низкий коэффициент адекватности Kt/V); тяжелые обструктивные легочные заболевания; прогрессирующие инкурабельные онкологические заболевания; наличие дренажей в брюшной полости или в расположенных рядом полых органах (цистостома, колостома);
наличие гнойных поражений кожи на передней брюшной стенке; низкий уровень интеллекта, асоциальное поведение, алкогольная или наркотическая зависимость, препятствующие соблюдению строгих правил асептики при смене раствора;
большая масса тела и/или выраженное ожирение, ставящие под сомнение достижение адекватности ПАНД;
нежелание больного использовать методику ПАПД.
| Преимущества | Недостатки |
| Физиологичность Биосовместимость Отсутствие осмотических расстройств Отсутствие нагрузки на сердце Нет необходимости в антикоагулянтах Лечение на дому в отдаленных регионах Возможность дальних поездок (свобода передвижения) | Высокая частота перитонитов Сложность регуляции водного баланса Нагрузка глюкозой (у диабетиков) Высокая ответственность пациента Высокая стоимость |
38. Физиологические принципы перитонеального диализа
Процесс удаления растворимых уремических токсинов из крови в диализирующий раствор, находящийся в брюшной полости, происходит вследствие диффузии, основанной на концентрационном градиенте. Чем выше концентрационный градиент вещества, тем быстрее происходит его диффузия. На скорость диффузии влияют молекулярная масса вещества и проницаемость брюшины. При этом скорость капиллярного кровотока в стенке брюшины, составляющая 70-100 мл/мин, существенного значения не имеет.
В отличие от синтетических мембран диализаторов (особенно, low flux) перитонеальная мембрана проницаема для молекул средней массы и некоторых мелко дисперсных белков. Потеря белка одно из отрицательных свойств ПАПД и требует более полноценного или усиленного питания.
Ультрафильтрация (УФ) является механизмом выведения жидкости при ПАПД. Существует две основные движущие силы УФ — осмотический градиент и гидростатическое давление. В случае перитонеального диализа основная роль отводится осмотическому градиенту, в то время как при гемодиализе использован гидростатический градиент. Осмотическая УФ при перитонеальном диализе осуществляется добавлением в диализат значительных количеств глюкозы или декстрозы. Использование для этого аминокислот и макромолекулярных полимеров (айкодекстрин) существенно удорожает процедуру и широкого практического применения не нашло.
При использовании стандартного раствора натрий и хлор диффундируют через перитонеальную мембрану в обе стороны практически в равной мере, калий и магний выходят в диализат, а кальций поступает в кровь из раствора. Лактат натрия вводится в диализат для коррекции метаболического ацидоза. Он поступает в кровь и в организме больного превращается в бикарбонат.
Для обеспечения постоянного градиента концентрации метаболитов и осмотических веществ требуется частая замена раствора в брюшной полости. Расчеты и многолетний эмпирический опыт показали, что 4- кратный режим смены раствора с примерно одинаковыми промежутками времени у пациентов с массой тела не более 75 кг способен обеспечить адекватное удаление токсинов и длительно сохранять жизнь больных. Как «классический» вариант можно рассматривать использование трех контейнеров с изоосмолярным раствором и одного — с гиперосмолярным. При этом следует помнить, что время нахождения гиперосмолярного раствора в брюшной полости следует уменьшать на 1,5-2 часа по сравнению с изоосмолярным, что связывается с резорбцией глюкозы в кровь и повышением ее осмолярности, сопровождающейся обратной фильтрацией жидкости из брюшной полости.
У пациентов с большой массой тела (свыше 80 кг), у лиц с плохими характеристиками проницаемости брюшины, с гипергидратацией и высоким артериальным давлением частота смены раствора увеличивается до 6 и более раз. Они являются группой лиц, у которых предпочтительней проводить один из видов АПД.
39. Перитонеальный доступ для ПАПД
Перитонеальные катетеры для хронического перитонеального диализа всех типов (ПАПД, НАПД, ИАПД) должны обеспечивать хороший дренаж брюшной полости, т.е короткое время для залива и слива диализирующего раствора. Они должны быть плотно фиксированы в подкожном туннеле (герметичность) и иметь систему защиты от проникновения инфекции вдоль катетера в брюшную полость. Катетеры для хронического периотонеального диализа производят из силикона или полиуретана, имеют на своей наружной поверхности одну или две дакроновые манжеты (муфты), которые быстро прорастают соединительной тканью и, фиксируя катетер, создают механический барьер для патогенных микроорганизмов. Продолжительность функционирования катетеров для хронического перитонеального диализа достигает нескольких лет.
Дистальный (рабочий) отдел катетеров, опускаемый в полость малого таза, может быть прямым, изогнутым или в виде горизонтального диска с множеством мелких боковых отверстий для дренажа брюшной полости. В практической медицине наиболее распространены катетеры Ореопулоса-Циллермана и Тенкхоффа.
Катетеры имплантируются в полость брюшины (лапаротомически, путем лапароцентеза или лапароскопически) таким образом, что внутренняя манжетка устанавливается и фиксируется отдельными швами предбрюшинно, а наружная — подкожно, в 1,5-2 см от места выхода катетера на поверхность передней или боковой стенки живота. Хирургический доступ в брюшную полость проводится по срединной линии на 2-3 см ниже пупка или на этом же уровне параректально. Наружная часть катетера выводится на кожу через контрапертуру.
Вводный период использования брюшного катетера составляет от нескольких дней до 2-3 недель, после чего приступают к плановому лечению в полном объеме. Характер вводного периода зависит от необходимости проведения диализотерапии сразу после имплантации катетера.
Если состояние пациента требует немедленного начала лечения, а проведение гемодиализа невозможно, то объем первых заливок в течение 2-3 дней не должен превышать 500 мл. В каждый пакет добавляется гепарин из расчета 500 ЕД на литр раствора. Поскольку эти пациенты, как правило, находятся на постельном режиме и подъема внутрибрюшинного давления у них не происходит, то протечки раствора мимо катетера при этом не наблюдается. В течение недели можно постепенно переходить к стандартным двухлитровым заливкам без антикоагулянтов.
Существует иная стратегия вводного периода использования хронического катетера:
а) если возможно, перитонеальный диализ откладывается на 1-2 недели;
б) один раз в неделю в брюшную полость вводится физиологический раствор с гепарином для профилактики окклюзии катетера сгустками крови и фибрина и снижения вероятности адгезии к сальнику;
в) когда перитонеальный диализ начинается в первую неделю, перитонеальная полость после дренирования остается пустой в течение нескольких часов в сутки;
г) физическая активность больного максимально ограничивается для предотвращения повышения внутрибрюшного давления.
д) если перитонеальный диализ начинается в плановом порядке через 2-3 недели, то используется сразу максимальный объем заливки, т.е. 2,0 — 2,5 л на каждый цикл.
40. Растворы для перитонеального диализа
Сбалансированный солевые растворы для перитонеального диализа производятся промышленным способом в пластиковых мешках (контейнерах, пакетах) различного объема — от 0,5 до 3,0 л для ПАПД и 3- 5 л для АПД. Концентрация электролитов в диализных растворах мало отличается у разных производителей. Одна из стандартных прописей растворов, наиболее часто применяемых в клинической практике, показана в таблице 14.
| Компоненты | Диализат, ммоль/л | Плазма, ммоль/л |
| Натрий | 132 | 135-142 |
| Калий | 0 | 4-6 |
| Хлор | 96-102 | 95-100 |
| Кальций | 2,5 или 3,5 | 2,7-3,3 |
| Магний | 0,5 или 1,5 | 1,1-1.4 |
| Глюкоза | 1500-4250 мг% | 60-100 мг% |
| Лактат натрия | 35-40 | 0 |
Все стандартные растворы содержат лактат как основу для печеночной продукции бикарбоната с целью коррекции метаболического ацидоза. Недавно появились растворы, содержащие в качестве буфера чистый бикарбонат, но он содержится в дополнительном пакете внутри контейнера, который разрушается и смешивается с основным раствором непосредственно перед заливкой в брюшную полость. Разница в содержании кальция в некоторых растворах связана с необходимостью борьбы с гиперкальциемией у отдельных групп больных при развитии вторичного гиперпаратиреоидизма.
Декстроза или глюкоза — это осмотические агенты, содержащиеся в диализате в количестве 1,5% (1,36%), 2,5% (2,27%) и 4,25% (3,86%). Приблизительная осмолярность этих растворов составляет соответственно 345, 395 и 484 мосм/л. Применяя растворы с разной осмотической активностью можно индивидуально регулировать водный баланс организма и удалять из организма заданный объем жидкости.
Магистрали для ПАПД предназначены для соединения диализного контейнера с брюшным катетером, имплантированным в брюшную полость. Между катетером и магистралью от пакета с диализирующим раствором располагается короткий адаптер (адаптирующая магистраль), меняющаяся 1 раз в квартал. Ее цель — предотвратить пережатие и повреждение самого катетера при смене раствора и защитить его от инфицирования. Существует три основных типа магистралей, каждый из которых требует своего особого метода проведения процедуры обмена. Это прямые магистрали, которые в настоящее время применяются редко, Y-образные и Y-образные с двойным пакетом.
Y-образная магистраль специальным коннектором соединяются с адаптером брюшного катетера. При этом одна из двух линий (входная) соединена с контейнером, содержащим диализирующий раствор, а вторая (сливная) со сливным (дренажным) мешком. Этот тип магистрали был разработан для того, чтобы освободить больного от необходимости постоянного ношения пустого мешка в промежутках между обменами. Их использование снизило число эпизодов перитонита за счет проведения процедуры «промывание перед заполнением», когда перед введением раствора в брюшную полость производится орошение внутреннего участка соединения магистрали с адаптером и первые порции раствора идут в дренажный пакет. Единственным недостатком Y-образных систем с двойным пакетом является возросшая стоимость всей технологии, хотя меньшая частота перитонитов компенсирует общие затраты на лечение.
41. Другие компоненты для ПАПД
Комплект для проведения перитонеального диализа, включающий контейнеры (пустой и с раствором) и магистрали, упаковывается в плотный пластиковый пакет, обеспечивающий стерильность и защиту содержимого от механических повреждений. На нем представлена информация о типе диализирующего раствора, его объеме и сроках хранения.
Для обеспечения стерильности при смене раствора и препятствия к попаданию микробов в брюшную полость используются другие компоненты:
удлинитель-адаптор, меняющийся один раз в три месяца;
защитные запирающие колпачки, меняющиеся при каждой смене раствора;
колпачки с дезинфицирующими вкладышами, меняющиеся при каждой смене раствора (при использовании системы Stay Safe);
организатор потока диализата (при использовании системы Stay Safe);
многоразовые зажимы для пережатия магистралей;
дезинфектанты для обработки поверхности стола и обработки рук;
плитки — нагреватели перитонеального раствора;
маски для лица.
Использование всех компонентов технологии ПАПД носит обязательный характер и предотвращает развитие инфекционных осложнений при лечении больных с терминальной стадией ХПН.
42. Технология подготовки к смене раствора
Инфекция является наиболее распространенным осложнением перитонеального диализа, ограничивающим его широкое применение. С другой стороны, большинство инфекций предотвратимо при соблюдении надлежащих правил ухода, чистоты и гигиены. Риск инфицирования подкожного катетерного туннеля и брюшной полости при проведении ПАПД наиболее высок при выполнении следующих процедур:
подключение соединительной магистрали к адаптору-удлинителю;
отключении соединительной магистрали и надевании защитного колпачка на адаптор;
при смене адаптора-удлинителя.
Поверхности. Для профилактики инфекционных осложнений требуется производить гигиеническую и антисептическую обработку поверхностей стола, на котором производится обмен растворов, рук, мест соединения адаптора и магистралей, а также соблюдать определенные условия для помещения, где осуществляется лечение. При решении вопросов подготовки помещений следует руководствоваться Приказом Минздрава Республики Беларусь №165 от 25.11.2002 г.
Поверхности моются и дезинфицируются с помощью любых хозяйственных дезинфицирующих растворов или любого хозяйственного отбеливателя, разводя его в соотношении 1:10 с водой или в соответствии с инструкциями производителя.
Перед дезинфекцией поверхности должны быть вымыты водой с моющим средством для удаления органического материала. Моющее средство смывается с поверхности большим количеством воды, после чего не менее чем 10 минут подвергается действию любого отбеливателя. Перед использованием поверхность высушивается.
Одежда/постельное белье. Полотенца или салфетки, использованные во время процедуры замены раствора, подвергаются машинной стирке (или кипячению). Загрязненная одежда и постельное белье стираются в горячей воде (60°) с любым стиральным порошком.
Мойка и подготовка помещения. Помещение, в котором проводится смена раствора, следует содержать в максимальной чистоте. Все поверхности следует протирать от пыли влажной салфеткой. Полы и мягкую мебель следует чистить пылесосом как минимум один раз в день за один час до процедуры. Домашние животные не должны допускаться в помещение, где проводится смена раствора. Перед началом процедуры (за один час) необходимо закрыть все двери и окна, выключить кондиционер и отключить нагревательные приборы. Эти мероприятия направлены на уменьшение движения воздуха с частицами пыли.
Мытье рук. Перед мытьем рук необходимо закатать рукава одежды до локтей, снять кольца и закрыть порезы и трещины водонепроницаемым пластырем. Ногти должны быть коротко пострижены. Нельзя носить искусственные ногти и окрашивать ногти лаком, поскольку в них могут содержаться вредные микроорганизмы. Мыть руки необходимо тщательно с мылом, обращая особое внимание на межпальцевые зоны, обратную сторону ладоней и зону выше запястий. Тщательно высушивать руки и запястья одноразовым (по возможности) или сухим полотенцем. Если водопроводный кран нельзя закрыть локтем, то закрывать его, взявшись через сухое чистое полотенце. Для дополнительной дезинфекции рук рекомендуется пользоваться любыми гелями или лосьонами на спиртовой основе, которые более эффективно уничтожают микроорганизмы по сравнению с моющими средствами.
43. Соединение брюшного катетера для ПАПД с контейнерами диализирующего раствора.
Высвобождение адаптора-удлинителя выполняется только после соответствующей обработки поверхности стола, рук и надевания маски, закрывающей ротовое и носовые отверстия. После освобождения одежды вокруг места выхода катетера осторожно удалить с катетера и удлинителя пластырь или фиксатор, которым они могут крепиться к коже. Проверить целостность коннектора, закрытого защитным колпачком. Закрепить на поясе чистое хлопковое полотенце.
Из защитного пакета с контейнерами достаются мешки с магистралями. Разъединяются сливной контейнер и контейнер, заполненный свежим диализирующим раствором. При этом мешок с раствором помещается на штатив на уровне 1,5 м от пола, сливной — ложится на пол.
Наконечники магистрали и адаптора-удлинителя снабжены замками Люэра или системами винтового типа для упрощенного и безопасного соединения. Перед соединением адаптор-удлинитель пережимается зажимом, концы адаптора и магистрали обрабатываются аэрозолем дезинфицирующего средства, снимаются защитные колпачки и магистрали соединяются между собой.
Слив раствора из брюшной полости. Приносящая (входная) ветвь Y- образной магистрали пережимается зажимом. Снимается зажим с адаптора и диализирующий раствор из брюшной полости по отводящей ветви Y-образной магистрали начинает поступать в пустой контейнер (мешок).
Промывка. После полного слива раствора пережимается адаптор- удлинитель, снимается зажим с приносящей ветви и примерно 50 мл свежего раствора из нового пакета проливается через входную ветвь в отводящий участок и сливной контейнер.
Залив раствора. Отводящая ветвь магистрали пережимается, зажим с адаптора снимается и свежий раствор из контейнера по приносящей ветви поступает в брюшную полость.
Отсоединение. После заполнения брюшной полости раствором из сливного пакета на адаптор накладывается зажим и он отсоединяется от Y- образной магистрали. Наружный конец адаптора-удлинителя закрывается новым защитным колпачком после чего удлинитель с катетером осторожно помещаются под одежду. Пустой пакет и пакет с отработанным диализирующим раствором уничтожаются.
Существуют дополнительные устройства (организатор потока типа Stay Safe) для предотвращения случайного загрязнения и удобства пользования больных с плохим зрением, которые не требуют применения наружных зажимов на входящую и выносящую магистрали и облегчают процедуру ПАПД. Работа с ними приводится в инструкции производителя. Дезинфицирующие колпачки при этом играют одновременно роль запирающих колпачков.
44. Назначение режима ПАПД
Эффективность лечения больных с V стадией ХБП определяется объемом плазмы, очищенной от уремических токсинов за единицу времени, т.е клиренсом этих токсинов. При гемодиализе клиренс малых молекул, таких как мочевина и креатинин, относительно постоянен во время сеанса, но при перитонеальном диализе он меняется, будучи максимален в начале заливки раствора, когда диффузия и ультрафильтрация максимальны, снижаясь затем из-за снижения градиента концентрации и осмотического градиента глюкозы.
Клиренс на ПАПД зависит от всех факторов, определяющих диффузию, ультрафильтрацию и абсорбцию. На практике клиренс на перитонеальном диализе можно увеличить с помощью повышения:
максимально возможного времени на перитонеальном диализе (отказ от «сухого» промежутка ночью или днем);
максимально возможного концентрационног градиента (т.е. более частые обмены, как при АЛД, или большие объемы заливки).
максимально возможной эффективной площади перитонеальной поверхности (т.е. больший объем заливки);
максимально возможного удаления перитонеальной жидкости. Пропись (доза) перитонеального диализа зависит от ряда факторов, однако в основе ее лежат принципы адекватности диализотерапии. Вычисление прямого клиренса маркерных соединений (мочевина, креатинин, фосфаты, витамин В12), как это делается при гемодиализе, при ПАПД невозможно. Поэтому измерение клиренса производится путем сравнения количества выделенного за сутки диализата, содержания в нем одного из маркеров с концентрацией его в венозной крови. При этом вычисляется отношение концентрации вещества в диализате и плазме (D/P) и умножается на объем выделенного за сутки диализата. Получается величина клиренса в л/день или л/неделю.
Если время нахождения диализата в брюшной полости длительное (при ПАПД), то достаточно одного определения в сутки. Если применяется НАПД, то оценивается раздельно ночная порция диализата и дневная, которые затем суммируются. Сравнительная характеристика недельных клиренсов по мочевине, креатинину и витамину BJ2 при различных вариантов перитонеального диализа и гемодиализа представлена в таблице 16.
Средние клиренсы веществ (л/нед.)
при перитонеальном диализе и гемодиализе
| Вещество | ПАПД | НАПД | ИАПД | гмд |
| Мочевина | 57 | 57 | 58 | 126 |
| Креатинин | 47 | 47 | 36 | 100 |
| Витамин В12 | 34 | 30 | 17 | 30 |
Приведенные в таблице 16 клиренсы являются средними, в зависимости от различных условий перитонеальный транспорт может быть низким, нормальным или высоким. Этот показатель рассчитывается перитонеальным эквилибрационным тестом (ПЭТ). При нем брюшную полость заполняют 2 л диализирующего раствора с 2,5% декстрозы. Пробы диализата и крови на содержание мочевины, креатинина, натрия и декстрозы исследуются через 0-2-4 часа. Перитонеальный транспорт делится на четыре категории: высокий, средневысокий, средненизкий и низкий.
Пациенты с высоким транспортом имеют наивысшие значения D/P по мочевине, креатинину и натрию, но низкие значения ультрафильтрации и малый процент деградации декстрозы. У них наблюдаются наибольшие потери белка с диализатом.
При низком транспорте, напротив, выравнивание концентраций креатинина и мочевины происходит медленнее и в меньшей степени, что указывает на низкую проницаемость мембраны или ее малую эффективную поверхность. У таких больных имеются высокие значения ультрафильтрации и содержания декстрозы. Потери белка, как правило, не происходит.
Таким образом, пациенты с высоким транспортом лучше лечатся при частых и коротких обменах (лучше АПД), чтобы добиться хорошей ультрафильтрации. Пациенты с низким транспортом должны получать режимы с длительным обменом и большими объемами для достижения лучшей диффузии. Пациенты с промежуточными значениями транспорта могут хорошо переносить лечение любым режимом перитонеального диализа.
45. Принципы оценки адекватности ПАПД по кинетике мочевины
Математическое моделирование кинетики мочевины широко используется в нефрологическорй практике для оценки качества внепочечного очищения крови методами диализа с расчетом коэффициента Kt/V. При этом фактически недельный Kt/V рассчитывается по следующей формуле:
где:
Urd — мочевина диализата, ммоль/л
D24 — суточный объем диализата, л
Urs — мочевина сыворотки крови, ммоль/л;
W — масса тела пациента, кг;
К — коэффициент, равный 0,6 у мужчин и 0,55 у женщин.
Адекватный ПАПД определяется Kt/V не менее 1,7 в неделю. Меньшая величина Kt/V по сравнению с гемодиализом обусловлена непрерывностью удаления метаболитов при перитонеальном диализе. Существует три возможности повысить Kt/V у пациентов на ПАПД.
А. Увеличение объема заливки. Обычно это приводит к незначительному уменьшению выравнивания концентраций мочевины и креатинина, особенно у пациентов с большой массой тела. Однако у небольших пациентов при переходе на контейнеры с 2,5 — 3,0 л раствора может произойти существенное снижение степени выравнивания концентраций метаболитов в плазме и диализате. Главным недостатком увеличения объема заливок служит появление болей в спине, чувство перерастянутости живота и затруднения дыхания. Можно предполагать рост частоты образования грыж и протечек ввиду роста внутрибрюшного давления.
Б. Увеличение частоты дневных обменов. Большинство пациентов с ХПН, начавших ПАПД, выполняют четыре обмена в сутки. Переход от четырех к пяти или шести обменам в сутки обычно не оказывает заметного эффекта на выравнивание метаболитов. Однако, если сократить время интервалов между обменами до 2-3 часов, то следовательно градиент концентрации будет постоянно высок и эффективность диффузии и ультрафильтрации может повыситься, хотя и не в такой степени как при увеличении объема. Оптимальным для повышения эффективности ПАПД сочетать увеличение объема и рост частоты обмена, показанием к чему является большая масса пациента, ухудшение транспортных свойств брюшины и гиперазотемия. Увеличение числа обменов наряду со снижением объемов может потребоваться при развитии перитонита с выраженным болевым синдромом, в связи с чем снижение объема частично компенсируется частой сменой раствора.
В. Увеличение осмолярности диализных растворов. Использование гиперосмолярных растворов ведет не только к росту ультрафильтрации, но и подъему клиренсов метаболитов. Отрицательной стороной этого метода является рост гипергликемии и гиперлипидемии, что способствует ожирению и ухудшению транспортных свойств брюшины. Как уже говорилось выше, абсорбция декстрозы (глюкозы) брюшиной быстро ведет к падению осмолярности раствора и снижению осмотического градиента. В этой связи сроки нахождения гиперосмолярного раствора в брюшной полости не должны превышать 2-3 часа.
Если лечение больного методом ПАПД не приносит желаемого эффекта, состояние не улучшается, Kt/V остается низким, то возникают показания для перевода больного с перитонеального на программный гемодиализ. Такие показания встречаются при:
невозможности доступными режимами достигнуть адекватного ПАПД и при отсутствии противопоказаний для гемодиализа; плохой переносимости ПАПД; выраженных нарушениях белкового питания; тяжелой неконтролируемой гипертриглицеридемии; несоблюдении пациентам режима ПАПД;
осложнениях ПАПД, препятствующих его продолжению (рецидивирующий перитонит, рефрактерная туннельная инфекция, гидроторакс, склероз брюшины);
желание больного перейти на программный гемодиализ.
46. Осложнения ПАПД и их лечение Перитониты
Перитонит при ПАПД — это воспалительная реакция брюшины на попадание микроорганизмов в брюшную полость, которое происходит, чаще всего, в моменты смены раствора и открытия просвета брюшного катетера. Рецидивирующий перитонит является главным серьезным осложнением методики ПАПД, ограничивающим его применение в некоторых странах и регионах из-за снижения адекватности перитонеального диализа, необходимости удаления брюшного катетера и перевода больного на программный гемодиализ.
Благодаря развитию техники для ПАПД частота перитонита в среднем составляет один эпизод на 12-18 месяцев на больного. При АЛД из-за более редкого открытия катетера частота перитонита меньше и достигает 1 эпизода за 18-24 месяца на больного.
Особенностью перитонита при ПАПД является то, что даже небольшое количество бактерий быстро распространяется по брюшине и вызывает реакцию воспаления. В тоже время, в отличие от хирургических перитонитов, при этом нет субстратов для удаления или ушивания дефектов кишечника и перитониты при перитонеальном диализе лечатся консервативными мероприятиями.
Этиология перитонитов и пути инфицирования полости брюшины
Большинство перитонитов при перитонеальном диализе вызываются патогенными бактериями. По данным литературы 50-80% из них обусловлены Грам-положительной флорой, 15-20% — Грам-отрицательной флорой. В небольшом количестве случаев причиной его являются грибковые поражения. Смешанная инфекция (сочетание Грам- отрицательных и Грам-положительных микроорганизмов) наблюдается приблизительно в 4% случаев.
Установлено, что наибольший риск развития перитонита при ПАПД обусловлен собственной флорой больного по сравнению с микрофлорой окружающей среды. Существует связь между путем проникновения инфекции и микрофлорой, вызывающей перитонит (таблица17).
| Путь инфициро вания | Способствующий фактор | Микроорганизм | Частота |
| 1 | 2 | 3 | 4 |
| Интракате- терный | Нарушение асептики соединения и рассоединения магистралей, контейнеров с диализатом и перитонеальных катетеров | St. epidermidis, Acinetobacter | 30-40% |
| Перикате- терный | Нарушение техники установки катетера, инфекция наружного выхода катетера или катетерного туннеля | St. Epidermidis, St. Aureus, Pseudomonas, дрожжи | 20-30% |
| Трансму ральный | Нарушение проницаемости полых органов живота с выходом бактерий из кишечника в полость брюшины | Кишечная грам- флора, анаэробы | 25-30% |
| Гематоген ный | Перенос бактерий кровью из внебрюшинного очага | Стрептококки, микобактерии туберкулеза | 5-10% |
| Трансваги-нальный | Перенос инфекции из влагалища через маточные трубы | Дрожжи. лактобактерии | 2-5% |
47. Диагностические критерии перитонита
Для установления диагноза перитонита должны присутствовать два из трех основных признаков (таблица 5): а) симптомы и признаки перитонеального воспаления; б) мутная перитонеальная жидкость с увеличенным цитозом (более 100 клеток на 1 мкл), преимущественно (более 50%) нейтрофильным, и выявление бактерий в сливаемой перитонеальной жидкости окраской по Граму или посеве.
Источник