Атомы и электроны
Атомно-молекулярное учение
Мы приступаем к изучению химии — мира молекул и атомов. В этой статье мы рассмотрим базисные понятия и разберемся с электронными формулами элементов.
Атом (греч. а — отриц. частица + tomos — отдел, греч. atomos — неделимый) — электронейтральная частица вещества микроскопических размеров и массы, состоящая из положительно заряженного ядра (протонов) и отрицательно заряженных электронов (электронные орбитали).
Описываемая модель атома называется «планетарной» и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом
Протон (греч. protos — первый) — положительно заряженная (+1) элементарная частица, вместе с нейтронами образует ядра атомов элементов. Нейтрон (лат. neuter — ни тот, ни другой) — нейтральная (0) элементарная частица, присутствующая в ядрах всех химических элементов, кроме водорода.
Электрон (греч. elektron — янтарь) — стабильная элементарная частица с отрицательным электрическим зарядом (-1), заряд атома — порядковый номер в таблице Менделеева — равен числу электронов (и, соответственно, протонов).
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20) в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.
Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило: порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим электроны занимают различные энергетические уровни.
Энергетические уровни подразделяются на несколько подуровней:
- Первый уровень
Состоит из s-подуровня: одной «1s» ячейки, в которой помещаются 2 электрона (заполненный электронами — 1s 2 )
Состоит из s-подуровня: одной «s» ячейки (2s 2 ) и p-подуровня: трех «p» ячеек (2p 6 ), на которых помещается 6 электронов
Состоит из s-подуровня: одной «s» ячейки (3s 2 ), p-подуровня: трех «p» ячеек (3p 6 ) и d-подуровня: пяти «d» ячеек (3d 10 ), в которых помещается 10 электронов
Состоит из s-подуровня: одной «s» ячейки (4s 2 ), p-подуровня: трех «p» ячеек (4p 6 ), d-подуровня: пяти «d» ячеек (4d 10 ) и f-подуровня: семи «f» ячеек (4f 14 ), на которых помещается 14 электронов
Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: «s», «p» и «d», которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или атомным орбиталям, движутся электроны, создавая определенный «рисунок».
S-орбиталь похожа на сферу, p-орбиталь напоминает песочные часы, d-орбиталь — клеверный лист.
Правила заполнения электронных орбиталей и примеры
Существует ряд правил, которые применяют при составлении электронных конфигураций атомов:
- Сперва следует заполнить орбитали с наименьшей энергией, и только после переходить к энергетически более высоким
- На орбитали (в одной «ячейке») не может располагаться более двух электронов
- Орбитали заполняются электронами так: сначала в каждую ячейку помещают по одному электрону, после чего орбитали дополняются еще одним электроном с противоположным направлением
- Порядок заполнения орбиталей: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Без практики теория мертва, так что приступает к тренировке. Нам нужно составить электронную конфигурацию атомов углерода и серы. Для начала определим их порядковый номер, который подскажет нам число их электронов. У углерода — 6, у серы — 16.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.
Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил. А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся одним электроном дополнили первую ячейку.
Таким образом, электронные конфигурации наших элементов:
- Углерод — 1s 2 2s 2 2p 2
- Серы — 1s 2 2s 2 2p 6 3s 2 3p 4
Внешний уровень и валентные электроны
Количество электронов на внешнем (валентном) уровне — это число электронов на наивысшем энергетическом уровне, которого достигает элемент. Такие электроны называются валентными: они могут быть спаренными или неспаренными. Иногда для наглядного представления конфигурацию внешнего уровня записывают отдельно:
- Углерод — 2s 2 2p 2 (4 валентных электрона)
- Сера -3s 2 3p 4 (6 валентных электронов)
Неспаренные валентные электроны способны к образованию химической связи. Их число соответствует количеству связей, которые данный атом может образовать с другими атомами. Таким образом неспаренные валентные электроны тесно связаны с валентностью — способностью атомов образовывать определенное число химических связей.
- Углерод — 2s 2 2p 2 (2 неспаренных валентных электрона)
- Сера -3s 2 3p 4 (2 неспаренных валентных электрона)
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных электронов. Ниже будет дано наглядное объяснение этой задаче.
Запишем получившиеся электронные конфигурации магния и фтора:
- Магний — 1s 2 2s 2 2p 6 3s 2
- Скандий — 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 1
Источник
Каким способом можно возбудить атом
Атомом называется наименьшая частица химического элемента, обладающая его химическими свойствами. Атом ( см) состоит из положительного ядра ( см) и электронов, движущихся в кулоновском поле. Заряд ядра равен суммарному заряду его электронов. Простейшим атомом является атом водорода. Атом водорода имеет протон (ядро), вокруг которого движется один электрон. Водородоподобными атомами являются ионы , , и т.д.
В основу теории атома водорода положены два постулата Бора. Первый постулат. Электроны могут двигаться только по определенным орбитам, находясь на которых, они, несмотря на наличие у них ускорения, не излучают. Эти орбиты соответствуют условиям:
Уравнение (23) называют также условием квантования.
Второй постулат. Атом излучает (поглощает) квант электромагнитной энергии, когда электрон переходит с орбиты с большим (меньшим) радиусом на орбиту с меньшим (большим) радиусом. Энергия кванта равна разности энергий электрона на орбитах до и после перехода.
где — частота кванта, возникающего или поглощаемого при переходе.
В стационарном состоянии с (основное состояние) атомы могут находиться сколь угодно долго. Если электрон в атоме, находящемся в основном состоянии, получил извне энергию и перешел на другую орбиту с 1$»>, то атом перешел в возбужденное состояние. В возбужденном состоянии атом имеет большую энергию, чем в основном. Возбужденное состояние неустойчиво, через электрон скачком (мгновенно) переходит в стационарное состояние с меньшей энергией. Излишек энергии излучается в пространство в виде монохроматического излучения, то есть какой-то одной спектральной линии.
Частота излучения атома подчиняется условию:
Для каждого перехода электрона излучается своя спектральная линия, таким образом, спектр такого излучения представляет собой отдельные линии.
Постулаты Бора не следуют ни из каких положений классической физики, они получают объяснение на основе квантовой теории. Из постулатов Бора вытекает наличие в атоме уровней энергии , , , . . Эти значения соответствуют различным возбужденным состояниям атома. Испускание или поглощение кванта энергии сопровождается переходом атома из одного состояния в другое. Наличие в атоме дискретных уровней энергии подтверждают опыты Франка и Герца.
Непосредственные экспериментальные доказательства существования дискретных уровней энергии в атоме были получены при определении потенциалов возбуждения и ионизации атомов газа. Для того, чтобы атом мог излучать энергию, необходимо перевести его в возбужденное состояние, то есть переместить электрон в атоме с основной орбиты на одну из внешних орбит, этот процесс называется возбуждением атома. Возбуждение может быть вызвано различными способами: нагреванием до высоких температур, неупругим столкновением атомов с быстрым свободным электроном и др.
Разберем случай прохождения свободного электрона через газ. Столкновения электронов с атомами могут происходить двумя способами. В одном случае электрон может передать часть своей энергии атому, при этом потенциальная энергия атома не изменится. Такие столкновения называют упругими . Столкновения другого рода ведут либо к ионизации, либо к возбуждению атома, то есть электрон, столкнувшись с атомом, передает электрону атома такое количество кинетической энергии, что он может либо оторваться от атома, либо перейти на более высокий уровень. Такие столкновения называются неупругими . Часть кинетической энергии при этом преобразуется в потенциальную.
Напишем законы сохранения энергии и импульса при упругом соударении:
Источник
Каким способом можно возбудить атом
Селивёрстова Алиса Андреевна
- alisa@onlineclass.spaceГруппа ВКонтактеBioChem Сhannel
- Profi.RU
- Яндекс.Дзенportfoliosite.comgithub.com/username@twittername —>
Подготовка к:
OnLine
Материал по химии
Данные понятия стоит изучить для выполнения типовых тестовых заданий №1 и №3, так же это поможет понять тему «Ковалентные связи», которая часто встречается в задании №4 ЕГЭ по химии.
Валентность – это количество связей, которые способен образовать химический элемент за счёт объединения своих неспаренных электронов с неспаренными электронами других элементов.
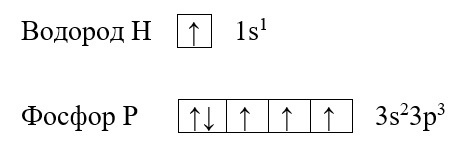
Для наилучшего понимания этой темы необходимо изобразить структуру атомов нескольких элементов, например, фосфора и водорода:
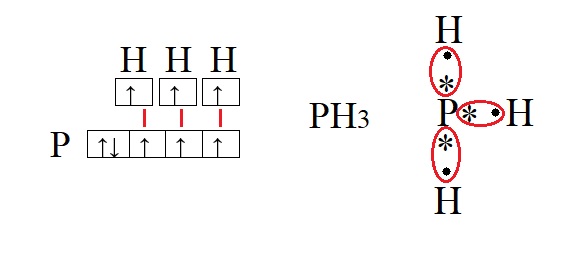
Обе предложенные схемы описывают образование химической связи между фосфором и водородом. Раз фосфору необходимо приобрести пару для целых трёх своих электронов. А водород может «предложить» только один электрон, то к одному атому фосфора может присоединиться три атома водорода. На рисунке справа знаком «*» обозначены неспаренные электроны фосфора, а точками – неспаренные электроны водорода, между которыми и образуется связь (обозначена красным цветом). Связь, при которой происходит объединение электронов в общие пары называется ковалентной, эта связь достаточно прочная и является одной из самых распространённых связей.
Водород содержит один неспаренный электрон, до завершения внешней электронной оболочки ему не хватает всего одного электрона (так как водород имеет только один энергетический уровень, его первый уровень одновременно является и последним, на первом уровне может поместиться только два электрона). Фосфору для полной внешней электронной оболочки не хватает трех электронов, на схеме выше видно, что у него три неспаренных электрона. В таких случаях элементы могут вступать в своеобразных химический «симбиоз»: объединять электроны в общее пользование. При этом неспаренные электроны будут принадлежать одновременно обоим элементам. Данный процесс можно изобразить следующим образом:
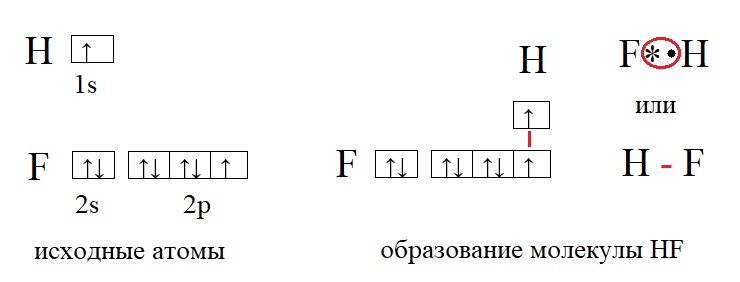
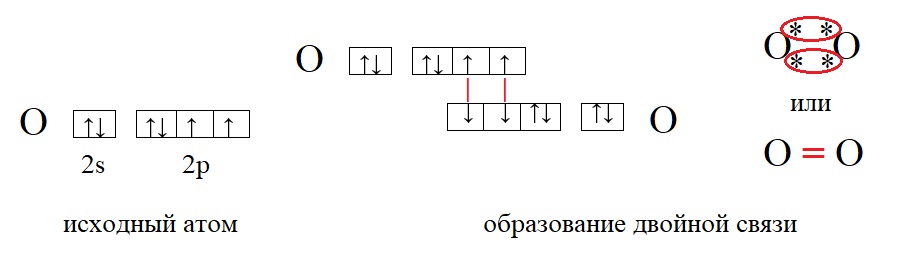
В качестве примеров образования таких связей приведём еще несколько молекул:
У фтора и у водорода по одному неспаренному электрону, поэтому их валентность равна единице. Валентность записывают римскими цифрами, она не имеет заряда, а отражает лишь количество связей, которые способен образовать элемент. Так валентность фтора I, валентность водорода тоже I. Между такими элементами образуется одна связь. Но есть элементы, способные образовывать гораздо большее количество связей, а значит иметь большую валентность, например:
У кислорода в данном примере валентность равна II, это значит, что каждый атом кислорода способен образовать две связи.
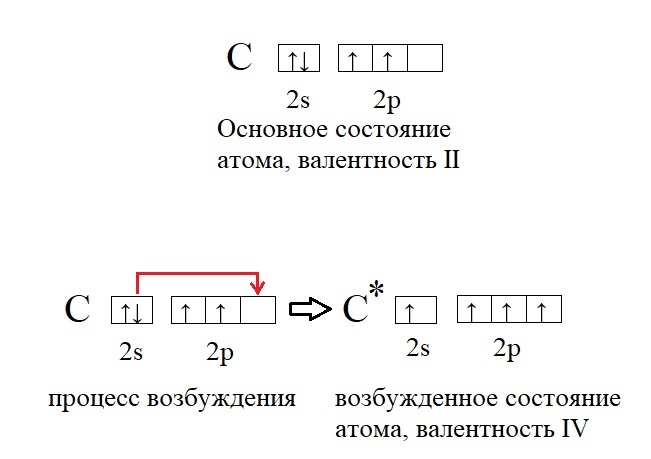
Возбуждённое состояние атома.
Углерод – один из самых важных элементов на планете Земля, без него невозможна жизнь. Каждая молекула органического вещества содержит четырехвалентный углерод. В чем же подвох? Дело в том, что в основном своём состоянии углерод содержит лишь два неспаренных электрона и способен проявлять валентность II, а не IV, как в органических молекулах или углекислом газе. Однако существует процесс «распаривания» электронов – перенос одного из электронов пары на другую орбиталь, при это валентность повышается:
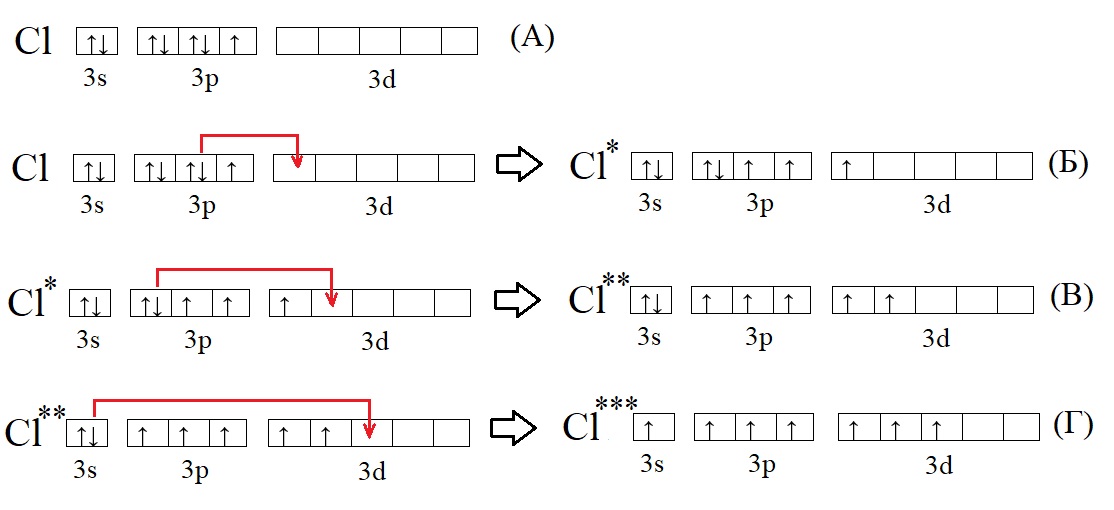
Не только углерод, но и многие другие элементы способны переходить в возбужденное состояние. У большинства элементов, точнее у тех элементов, что имеют три и более энергетических уровня (то есть находятся ниже второго периода в ПС) на внешнем уровне есть свободная d-орбиталь, на ней в основном состоянии нет электронов, но она может принимать их при возбуждении:
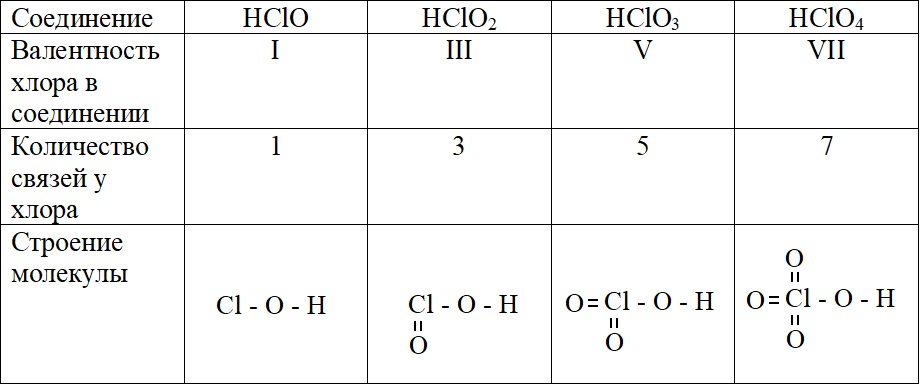
А – основное состояние атома хлора, есть один неспаренный электрон, такая структура соответствует валентности I. Первую валентность хлор имеет в соединениях HCl и HClO.
Б – первое возбужденное состояние хлора, есть три неспаренных электрона, это соответствует валентности III (HClO2).
В – второе возбужденное состояние, пять неспаренных электронов определяют способность проявлять в таком состоянии валентность V (HClO3).
Г – третье валентное состояние, есть семь неспаренных электронов, в таком состоянии хлор может образовывать семь ковалентных связей (HClO4)
Высшая валентность определяется номером группы, в которой стоит элемент, но есть исключения: азот, кислород и фтор. Для этих элементов не характерна высшая валентность, соответствующая номеру группы. Это объясняется тем, что у этих элементов электроны располагаются на двух энергетических уровнях, а свободная d-орбиталь, которая может принять электроны при их распаривании есть у элементов, имеющих три и более энергетических уровня.
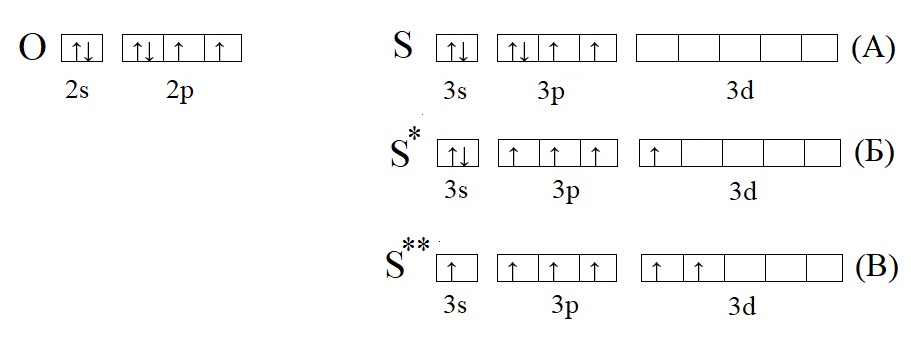
Сравним кислород с серой, у которой есть свободная d-орбиталь:
Кислород из-за отсутствия свободной орбитали не способен проявлять валентность выше II, тогда как у серы есть три валентных состояния: основное, соответствует валентности II (H2S); первое возбужденное, соответствует валентности IV (H2SO3 и SO2); второе возбужденное состояние, соответствует валентности VI (H2SO4, SO3).
Решение задания №3 ЕГЭ по химии
Пример 1.
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Определите, атомы каких из указанных элементов в возбужденном состоянии имеют конфигурацию внешнего энергетического уровня ns 1 np 3 nd 1 .
Решение: Электроны могут перераспределяться только внутри одного уровня, общая сумма электронов внешнего уровня, в приведенной в задании формуле, равно пяти, следовательно элемент относится к VА-группе. Это фосфор, азот и мышьяк. Азот не имеет свободную d-орбиталь (см. выше), поэтому выпадает из ответа.
Источник