- Каким способом можно сделать насыщенный раствор пересыщенным без добавления растворенного вещества
- Каким способом можно сделать насыщенный раствор пересыщенным без добавления растворенного вещества
- Как написать хороший ответ?
- ИНФОФИЗ — мой мир.
- Как сказал.
- Вопросы к экзамену
- Я учу детей тому, как надо учиться
- Урок 23 (дополнительный материал) Лабораторная работа Наблюдение роста кристаллов из раствора
- Ненасыщенные, насыщенные и пересыщенные растворы.
- Насыщенные ненасыщенные пересыщенные растворы
- Насыщенные растворы
- Пример получения насыщенного раствора
- Ненасыщенный раствор
- Пример получения ненасыщенного раствора
- Пересыщенный растворы
- Пример получения пересыщенного раствора
- Похожие страницы:
Каким способом можно сделать насыщенный раствор пересыщенным без добавления растворенного вещества
Вылейте кристаллы сахара в воду и размешайте, и сахар растворится. Продолжайте наливать и перемешивать, и в определенный момент больше не будет растворяться, и кристаллы упадут на дно стакана. В этот момент решение называется насыщенным. Но подождите — вы можете заставить больше кристаллов сахара растворяться, нагревая воду. Когда вы достигли точки насыщения, и больше сахара растворяется, вы получаете перенасыщенный раствор. Вы можете сделать это с солью, сахаром, кристаллами ацетата натрия и всем остальным, что растворяется в воде. На самом деле, вам даже не нужна вода для создания пересыщенного раствора. Вы можете сделать это с помощью спирта, растворителя или любого другого растворителя. Однако проще всего делать это с водой, потому что вода — лучший растворитель в мире.
Что такое насыщенный раствор?
Вода является одним из самых интересных и важных химических соединений, которые есть. Каждая молекула воды состоит из двух положительно заряженных атомов водорода и отрицательно заряженного атома кислорода. Атомы водорода располагаются на гораздо большем атоме кислорода, чтобы создать чистую полярность от одной стороны молекулы к другой. Из-за этого молекулы воды образуют связи друг с другом в процессе, называемом водородной связью.
Когда вы вводите растворенное вещество, такое как сахар или соль, молекулы воды притягиваются к растворенным атомам и молекулам сильнее, чем они притягиваются друг к другу. Они окружают молекулы растворенного вещества, и, поскольку они делают, растворенное вещество постепенно распадается. Составляющие его атомы и молекулы уходят, каждый из которых окружен молекулами воды, и растворенное вещество растворяется. Если вы продолжаете помешивать в большем количестве растворенного вещества, у вас, в конце концов, кончаются молекулы воды, чтобы выполнить эту работу, и в этот момент раствор насыщается.
Как сделать пересыщенный раствор
Способ сделать пересыщенный раствор состоит в том, чтобы добавить тепло, но небольшое нагревание не справится с работой. Вы должны нагреть воду близко к точке кипения. Когда вода становится такой горячей, молекулы воды имеют больше свободы для перемещения, и между ними появляется больше места для растворенных молекул. Вы можете продолжать помешивать в соли, сахаре или любом другом растворенном веществе, и оно будет продолжать растворяться, даже если точка насыщения достигнута. Уберите тепло и дайте раствору постепенно остыть, и раствор останется растворенным, по крайней мере, на некоторое время. По сути, это перенасыщенное определение. Пересыщенный раствор крайне нестабилен, и могут происходить странные вещи.
Горячий лед, горная леденец и кристаллическая формация
Вы когда-нибудь слышали о горячем льде? Его получают из пересыщенного раствора воды и кристаллов ацетата натрия. Когда вы вводите один кристалл ацетата натрия в такой раствор, это как триггер, который инициирует внезапную реакцию, в результате которой весь избыток ацетата натрия в растворе быстро кристаллизуется. Это экзотермический процесс, при котором выделяется тепло, поэтому в процессе реакции образуются ледяные кристаллы, но также выделяется тепло, отсюда и название горячий лед. Чтобы увидеть драматическую демонстрацию образования кристаллов, медленно наливайте перенасыщенный раствор в несколько нерастворенных кристаллов. Кристаллизация происходит так быстро, что кристаллическая башня образуется, когда вы льете.
Аналогичный процесс происходит, когда вы нагреваете воду до температуры кипения, добавляете сахар, дайте раствору остыть и суспендируете в растворе нитку. Сахар постепенно слипается в нити и образует большой кристалл, который вы можете наслаждаться как леденец. Слово для мудрых: наслаждайтесь леденцами в умеренных количествах и обязательно почистите зубы. Сахар способствует образованию полостей.
Источник
Каким способом можно сделать насыщенный раствор пересыщенным без добавления растворенного вещества
Вопрос по физике:
Физика 10 класс. ТЕМА:наблюдение роста кристаллов Помогите срочноо Каким способом насыщенный раствор можно сделать пересыщенным без добавления растворенного вещества ?
Ответы и объяснения 2
Убрать часть жидкости, в котором растворено это вещество
для такого количества жидкости раствор станет перенасыщенным
Например, понижая температуру. Правда, это работает только для чистых веществ, любое загрязнение тут же приведет к осадку или кристализации.
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Физика.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Физика — область естествознания: естественная наука о простейших и вместе с тем наиболее общих законах природы, о материи, её структуре и движении.
Источник
ИНФОФИЗ — мой мир.
Весь мир в твоих руках — все будет так, как ты захочешь
Весь мир в твоих руках — все будет так, как ты захочешь
Как сказал.
Вопросы к экзамену
Для всех групп технического профиля

Я учу детей тому, как надо учиться
Часто сталкиваюсь с тем, что дети не верят в то, что могут учиться и научиться, считают, что учиться очень трудно.
Урок 23 (дополнительный материал) Лабораторная работа Наблюдение роста кристаллов из раствора
Тема: «Наблюдение роста кристаллов из раствора»
Цель: научиться создавать кристаллы, пронаблюдать за ростом кристалла
Теоретические сведения
Существуют два простых способа выращивания кристаллов из раствора: охлаждение насыщенного раствора соли и его выпаривание. Первым этапом при любом из двух способов является приготовление насыщенного раствора. В условиях школьного физического кабинета проще всего выращивать кристаллы алюмокалиевых квасцов. В домашних условиях можно выращивать кристалл медного купороса или обычной поваренной соли.
Растворимость любых веществ зависит от температуры. Обычно с повышением температуры растворимость увеличивается, а с понижением температуры уменьшается.
При охлаждении горячего (примерно 40°С) насыщенного раствора до 20°С в нем окажется избыточное количества соли на 100 г воды. При отсутствии центров кристаллизации это вещество может оставаться в растворе, т.е. раствор будет пересыщенным.
С появлением центров кристаллизации избыток вещества выделяется из раствора, при каждой данной температуре в растворе остается то количество вещества, которое соответствует коэффициенту растворимости при этой температуре. Избыток вещества из раствора выпадает в виде кристаллов; количество кристаллов тем больше, чем больше центров кристаллизации в растворе. Центрами кристаллизации могут служить загрязнения на стенках посуды с раствором, пылинки, мелкие кристаллики соли. Если предоставить выпавшим кристалликами возможность подрасти в течение суток, то среди них найдутся чистые и совершенные по форме экземпляры. Они могут служить затравками для выращивания крупных кристаллов.
Чтобы вырастить крупный кристалл, в тщательно отфильтрованный насыщенный раствор нужно внести кристаллик — затравку, заранее прикрепленный на волосе или тонкой леске, предварительно обработанной спиртом.
Можно вырастить кристалл без затравки. Для этого волос или леску обрабатывают спиртом и опускают в раствор так, чтобы конец висел свободно. На конце волоса или лески может начаться рост кристалла.
Если для выращивания приготовлен крупный затравочный кристалл, то его лучше вносить в слегка подогретый раствор. Раствор, который был насыщенным при комнатной температуре, при температуре на 3-5°С выше комнатной будет ненасыщенным. Кристалл-затравка начнет растворяться в нем и потеряет при этом верхние, поврежденные и загрязненные слои. Это приведет к увеличению прозрачности будущего кристалла. Когда температура понизится до комнатной, раствор вновь станет насыщенным, и растворение кристалла прекратится. Если стакан с раствором прикрыть так, чтобы вода из раствора могла испаряться, то вскоре раствор станет пересыщенным и начнется рост кристалла. Во время роста кристалла стакан с раствором лучше всего держать в теплом сухом месте, где температура в течение суток остается постоянной. На выращивание крупного кристалла в зависимости от условий эксперимента может потребоваться от нескольких дней до нескольких недель.
Ход работы
1. Тщательно вымойте стакан и воронку, подержите их над паром.
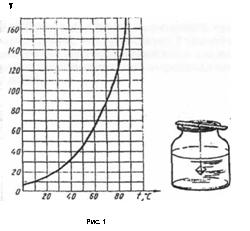
2. Налейте 100, г дистиллированной (или дважды прокипяченной) воды в стакан и нагрейте её до 30°С-40°С. Используя кривую растворимости, приведенную на рисунке 1, определите марсу соли, необходимую для приготовления насыщенного раствора при 30°С.
Приготовьте насыщенный раствор и слейте его через ватный фильтр в чистый стакан. Закройте стакан крышкой или листком бумаги. Подождите, пока раствор остынет до комнатной температуры. Откройте стакан. Через некоторое время начнут выпадать первые кристаллы.
3. Через сутки слейте раствор через ватный фильтр в чистый, вновь вымытый и попаренный стакан. Среди множества кристаллов, оставшихся на дне первого стакана, выберите самый чистый кристалл правильной формы. Прикрепите кристалл-затравку к волосу или леске и опустите его в раствор. Волос или леску предварительно протрите ватой, смоченной спиртом. Можно также положить кристалл-затравку на дно стакана перед запивкой в него раствора. Поставьте стакан в теплое чистое место. В течение нескольких суток или недель не трогайте кристалл и не переставляйте стакан. В конце срока выращивания выньте кристалл из раствора, тщательно осушите бумажной салфеткой и уложите в специальную коробку. Руками кристалл не трогайте, иначе он потеряет прозрачность.
Видеоопыт.
Опыт 1. Выращивание кристалла из медного купороса.
Опыт 2. Выращивание кристалла из поваренной соли.
Контрольные вопросы
1. Что может служить центром кристаллизации?
2. Чем объясняется неодинаковая скорость роста различных граней одного и того
же кристалла?
3. Каким способом можно насыщенный раствор сделать пересыщенным без
добавления растворенного вещества?
Источник
Ненасыщенные, насыщенные и пересыщенные растворы.
При растворении твердого или газообразного вещества в растворителе при постоянном давлении и температуре (р = const, Т = const) концентрация раствора не стремится к бесконечности.
Ненасыщенный раствор – это раствор, в котором при данной температуре вещество ещё может растворяться.
В некоторый момент растворяемое вещество перестает растворяться, т.к. достигнута определенная его концентрация, которая уже более не меняется и остается величиной постоянной, т.е. раствор достиг фазового равновесия:
растворяемое вещество 
Насыщенный раствор – раствор, в котором растворяемое вещество при данной температуре больше не растворяется, т.е. раствор, находится в равновесии с растворяемым веществом.
При изменении температуры или давления можно продлить процесс растворения. При этом получим раствор, содержащий растворенного вещества больше, чем его должно быть в обычных условиях в насыщенном растворе. Такой раствор называется пересыщенным. Пересыщенные растворы – это неустойчивые, неравновесные системы, которые, например, при лёгком сотрясении сосуда или введении в раствор кристаллов вещества, находящегося в растворе, переходят в равновесное состояние, выделяя избыток растворенного вещества, и раствор становится насыщенным.
Насыщенные растворы в зависимости от значения растворимости веществ разделяются на:
- концентрированные, в которых массы растворённого вещества и растворителя сравнимы между собой;
- разбавленные, в которых масса растворённого вещества в несколько раз меньше, чем масса растворителя.
Источник
Насыщенные ненасыщенные пересыщенные растворы
Насыщенные ненасыщенные пересыщенные растворы это растворы которые при нормальных условиях обладают определенными для них свойствами.
Повышение или понижение температуры влияет на образование этих растворов, поэтому ввели понятие (при нормальных условиях).
Национальный институт стандартов и технологий США (англ. National Institute of Standards and Technology, NIST) использует температуру +20 °C (293,15 K) и давление 101 325 Па (1 атм).
Примером ненасыщенного раствора может служить моря и океаны, а перенасыщенного озера в которых добывают соль.
Что такое насыщенные ненасыщенные пересыщенные растворы
Насыщенные растворы
Это растворы определенных веществ при растворении которых при нормальной температуре не осталось осадка на дне сосуда и оно больше не растворяется.
Значение насыщенный иногда применяется формально так как существуют и другие его значения (не достаточно насыщенный или недостаточно пересыщенный).
Если насыщенный раствор охладить то образуется пересыщенный раствор для данной температуры, а если нагреть то раствор станет ненасыщенный так как он растворить какое то количество вещества.
Пример получения насыщенного раствора
Для образования насыщенного раствора нужно взять 34,4 г соли хлорида калия KCl и растворить его при температуре (20 °С) в в 100 гр. воды.
Балас температуры приведет к тому, что хлорид калия будет больше растворяться в воде, а понижение температуры приведёт к тому , что некоторая соль выпадет в осадок или на стенки сосуда.
Иногда такое свойства некоторых солей применяется для их получения из комплекса солей, примером служит получение хлората калия.
Ненасыщенный раствор
Это раствор в котором при обычной температуре находиться меньше растворенной соли (вещества), чем в в его насыщенном состоянии.
Примером ненасыщенного раствора можно считать реки, моря, океаны, а также вода налитая в стакан так как в воде (растворитель) содержится некоторое количество солей таких как хлорид натрия, хлорид калия и других солей.
Пример получения ненасыщенного раствора
Для того, чтобы получить ненасыщенный раствор нужно при температуре (20 °С) добавить в 100 гр. растворителя (вода) меньше чем 34,4 гр. хлорида калия.
Изменение температуры жидкости может привести к тому, что для данной пониженной температуры образуется насыщенный и даже пересыщенный раствор, но при одном условии если концентрация соли близка к насыщенному раствору.
Пересыщенный растворы
Это раствор в котором при обычных условиях растворено больше соли чем этого потребовалось для получения насыщенного раствора.
Примером служат озера в которых хлорид натрия растворен на столько, что образует кристаллы на дне и во круг водоема, некоторые такие водоемы пересохли образовав соленые пустыни (Ую́ни — солончак, высохшее солёное озеро на юге пустынной равнины Альтиплано).
Рис. Зависимость растворение солей от температуры.
Пример получения пересыщенного раствора
Для этого нужно взять больше чем 34,4 гр. хлорида калия и растворить в горячей воде, если образовался осадок его нужно осторожно отфильтровать, чтобы не было загрязнения раствора.
После остывания при комнатной температуре раствор может находиться долгое время без образования каких либо кристаллов солей на стенках сосуда, но если встряхнуть или внести на стеклянной палочке кристалл хлорида калия сразу начнется процесс кристаллизации.
Пересыщенные растворы являются неустойчивыми системами, способными к существованию только при отсутствии в растворе твердых частиц растворенного вещества.
Возможность длительного существования таких растворов объясняется трудностью первоначального возникновения мельчайших «зародышевых» кристалликов, так называемых центров кристаллизации, от которых кристаллизация распространяется на всю массу раствора.
Похожие страницы:
Понравилась статья поделись ей
Источник