- Изотермический процесс
- Из Википедии — свободной энциклопедии
- Первый закон термодинамики.
- Применение первого закона термодинамики к различным процессам .
- Изохорный процесс.
- Что такое изотермический процесс? (Примеры, упражнения)
- Содержание:
- Примеры изотермических процессов
- Цикл Карно
- Расчет работы, проделанной в изотермическом процессе
- — Упражнение 1
- Решение
- — Упражнение 2.
- Решение
- Ссылки
- Первый закон термодинамики — формулы и определение с примерами
- Изохорный процесс
- Изотермический процесс
- Изобарный процесс
Изотермический процесс
Из Википедии — свободной энциклопедии
| Статья является частью одноименной серии. |
| Тепловые процессы |
|---|
| Изотермический [1] или изотермный [2] процесс (от др.-греч. ἴσος «равный» и θέρμη «жар») — термодинамический изопроцесс, происходящий в физической системе при постоянной температуре. Для осуществления изотермического процесса систему обычно помещают в термостат (массивное тело, находящееся в тепловом равновесии), теплопроводность которого велика, так что теплообмен с системой происходит достаточно быстро по сравнению со скоростью протекания процесса, и, температура системы в любой момент практически не отличается от температуры термостата. Можно осуществить изотермический процесс иначе — с применением источников или стоков тепла, контролируя постоянство температуры с помощью термометров. К изотермическим процессам относятся, например, кипение жидкости или плавление твёрдого тела при постоянном давлении [K 1] . Графиком изотермического процесса является изотерма. В идеальном газе при изотермическом процессе для неизменной массы газа произведение давления на объём постоянно (закон Бойля-Мариотта): P ∗ V = c o n s t . <\displaystyle P*V=const.> откуда при изменении объёма или давления, имеем: P 1 ∗ V 1 = P 2 ∗ V 2 <\displaystyle P_<1>*V_<1>=P_<2>*V_<2>> Изотермы идеального газа в координатах p , V <\displaystyle p,V> В общем случае при изотермическом процессе системе сообщается некоторое количество теплоты Q <\displaystyle Q> В твёрдом теле и большинстве жидкостей изотермические процессы очень мало изменяют объём тела, если только не происходит фазовый переход. Первый закон термодинамики для изотермического процесса записывается в виде: где учитывается, что внутренняя энергия системы в изотермическом процессе не изменяется. Таким образом, в изотермическом процессе вся теплота, полученная системой, расходуется на совершение системой работы над внешними телами. Источник Первый закон термодинамики.Первое начало (первый закон) термодинамики — это закон сохранения и превращения энергии для термодинамической системы. Согласно первому началу термодинамики, работа может совершаться только за счет теплоты или какой-либо другой формы энергии. Следовательно, работу и количество теплоты измеряют в одних единицах — джоулях (как и энергию). Первое начало термодинамики было сформулировано немецким ученым Ю. Л. Манером в 1842 г. и подтверждено экспериментально английским ученым Дж. Джоулем в 1843 г. Первый закон термодинамики формулируется так: Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе: где ΔU — изменение внутренней энергии, A — работа внешних сил, Q — количество теплоты, переданной системе. При любых процессах, происходящих в изолированной системе, ее внутренняя энергия остается постоянной. Если работу совершает система, а не внешние силы, то уравнение (ΔU = A + Q) записывается в виде:
где A’ — работа, совершаемая системой (A’ = -A). Количество теплоты, переданное системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами. Первое начало термодинамики может быть сформулировано как невозможность существования вечного двигателя первого рода, который совершал бы работу, не черпая энергию из какого-либо источника (т. е. только за счет внутренней энергии). Действительно, если к телу не поступает теплота (Q — 0), то работа A’, согласно уравнению Следует помнить, что как работа, так и количество теплоты, являются характеристиками процесса изменения внутренней энергии, поэтому нельзя говорить, что в системе содержится определенное количество теплоты или работы. Система в любом состоянии обладает лишь определенной внутренней энергией. Применение первого закона термодинамики к различным процессам .Рассмотрим применение первого закона термодинамики к различным термодинамическим процессам. Изохорный процесс.Зависимость р(Т) на термодинамической диаграмме изображается изохорой. Изохорный (изохорический) процесс — термодинамический процесс, происходящий в системе при постоянном объеме. Изохорный процесс можно осуществить в газах и жидкостях, заключенных в сосуд с постоянным объемом. При изохорном процессе объем газа не меняется (ΔV= 0), и, согласно первому началу термодинамики т. е. изменение внутренней энергии равно количеству переданного тепла, т. к. работа (А = рΔV=0) газом не совершается. Источник Что такое изотермический процесс? (Примеры, упражнения)Содержание:В изотермический процесс или изотермический — это обратимый термодинамический процесс, при котором температура остается постоянной. В газе бывают ситуации, когда изменение в системе не приводит к изменению температуры, а вызывает изменение физических характеристик. Эти изменения представляют собой фазовые переходы, когда вещество переходит из твердого состояния в жидкое, из жидкого в газообразное или наоборот. В таких случаях молекулы вещества меняют свое положение, добавляя или извлекая тепловую энергию. Тепловая энергия, необходимая для возникновения фазового перехода в веществе, называется скрытой теплотой или теплотой превращения. Один из способов сделать процесс изотермическим — это поместить вещество, которое будет изучаемой системой, в контакт с внешним тепловым резервуаром, который представляет собой другую систему с большой теплотворной способностью. Таким образом происходит настолько медленный теплообмен, что температура остается постоянной. Этот тип процесса часто встречается в природе. Например, у людей, когда температура тела повышается или понижается, мы чувствуем себя больными, потому что в нашем теле многие химические реакции, поддерживающие жизнь, происходят при постоянной температуре. Это справедливо для теплокровных животных в целом. Другие примеры — лед, который тает от жары, когда приходит весна, и кубики льда, которые охлаждают напиток. Примеры изотермических процессов— Обмен веществ у теплокровных животных осуществляется при постоянной температуре. — Когда вода закипает, происходит фазовый переход от жидкости к газу, а температура остается постоянной примерно на уровне 100 º C, поскольку на значение могут влиять другие факторы. -Таяние льда — еще один распространенный изотермический процесс, так же как и помещение воды в морозильную камеру для изготовления кубиков льда. -Автомобильные двигатели, холодильники, а также многие другие виды техники исправно работают в определенном температурном диапазоне. Для поддержания нужной температуры устройства называли термостаты. В его конструкции использованы различные принципы работы. Цикл КарноДвигатель Карно — идеальная машина, работа которой достигается благодаря полностью обратимым процессам. Это идеальная машина, потому что она не учитывает процессы, рассеивающие энергию, такие как вязкость вещества, выполняющего работу, или трение. Цикл Карно состоит из четырех стадий, две из которых точно изотермические, а две другие адиабатические. Изотермические стадии — это сжатие и расширение газа, который производит полезную работу. Двигатель автомобиля работает по аналогичным принципам. Движение поршня внутри цилиндра передается другим частям автомобиля и вызывает движение. Он не имеет поведения идеальной системы, такой как двигатель Карно, но термодинамические принципы являются общими. Расчет работы, проделанной в изотермическом процессеЧтобы рассчитать работу, совершаемую системой при постоянной температуре, мы должны использовать первый закон термодинамики, который гласит: Это еще один способ выражения сохранения энергии в системе, представленный через ΔU или изменение энергии, Q по мере поступления тепла и, наконец, W, что и есть работа, проделанная указанной системой. Предположим, что рассматриваемая система представляет собой идеальный газ, содержащийся в цилиндре подвижного поршня площадью К, который работает, когда его объем V смена V1 к V2. Уравнение состояния идеального газа: PV = nRT, которая связывает объем с давлением п и температура Т. Значения n и R постоянны: n — количество молей газа, а R — постоянная газов. В случае изотермического процесса продукт PV это постоянно. Итак, проделанная работа рассчитывается путем интегрирования небольшой дифференциальной работы, в которой сила F производит небольшое смещение dx: Как Adx это именно изменение объема dV, так: Чтобы получить полную работу в изотермическом процессе, проинтегрируем выражение для dW: Давление п и объем V изображены на диаграмме P-V как показано на рисунке, а проделанная работа равна площади под кривой: Как ΔU = 0 поскольку температура остается постоянной, в изотермическом процессе необходимо: — Упражнение 1Цилиндр с подвижным поршнем содержит идеальный газ при 127ºC. Если поршень движется, чтобы уменьшить начальный объем в 10 раз, сохраняя постоянную температуру, найдите количество молей газа, содержащегося в цилиндре, если работа, проделанная с газом, равна 38 180 Дж. Факт: R = 8,3 Дж / моль. K РешениеВ заявлении говорится, что температура остается постоянной, поэтому мы находимся в наличии изотермического процесса. Для работы, проделанной с газом, мы имеем ранее выведенное уравнение: 127 º C = 127 + 273 K = 400 K Решите относительно n количество родинок: n = W / RT ln (V2 / V1) = -38 180 Дж / 8,3 Дж / моль K x 400 K x ln (V2/ 10 В2) = 5 моль Работе предшествовал отрицательный знак. Внимательный читатель заметит в предыдущем разделе, что W было определено как «работа, выполняемая системой» и имеет знак +. Так что «проделанная работа над системой» имеет отрицательный знак. — Упражнение 2.У вас есть воздух в цилиндре с поршнем. Изначально есть 0,4 м 3 газа под давлением 100 кПа и температурой 80ºC. Воздух сжимается до 0,1 м 3 обеспечение постоянной температуры внутри цилиндра во время процесса. Определите, сколько работы было сделано во время этого процесса. РешениеМы используем ранее полученное уравнение для работы, но количество молей неизвестно, которое можно рассчитать с помощью уравнения идеального газа: 80 º C = 80 + 273 K = 353 K. п1V1 = n.R.T → n = P1V1 / RT = 100000 Па x 0,4 м 3 /8,3 Дж / моль. K x 353 K = 13,65 моль W = n.R.T ln (V2/ V1) = 13,65 моль x 8,3 Дж / моль. K x 353 K x ln (0,1 / 0,4) = -55,442,26 Дж Опять же отрицательный знак указывает на то, что в системе были выполнены работы, что всегда происходит при сжатии газа. Ссылки
4 самые важные части почек и их функции Положительные слезы: что это такое и почему плакать тоже может быть хорошо Источник Первый закон термодинамики — формулы и определение с примерамиСодержание: Первый закон термодинамики: При изучении физики в 9 классе вы узнали, что полная механическая энергия замкнутой системы тел сохраняется только при отсутствии трения, а при наличии трения она уменьшается. Куда девается механическая энергия? Если бутылку, заполненную до половины водой при комнатной температуре, встряхивать в течение нескольких минут, то окажется, что вода нагрелась на 1—2 °С. Каким образом нагрелась вода? В середине XIX века известный английский физик Дж. Джоуль (1818— 1889), проведя многочисленные опыты, показал, что совершённая при перемешивании воды механическая работа практически равна увеличению её внутренней энергии. Опыты Джоуля, а также исследования немецкого врача и естествоиспытателя Р. Майера (1814—1878), немецкого профессора физиологии и одного из самых знаменитых физиков второй половины XIX века Г. Гельмгольца (1821 —1894) позволили сформулировать закон сохранения и превращения энергии, распространив его на все явления природы. Согласно этому закону при любых взаимодействиях материальных объектов энергия не исчезает и не возникает из ничего, она только передаётся от одних объектов к другим или превращается из одной формы в другую. Для термодинамических систем (в термодинамике обычно рассматривают макроскопически неподвижные системы) закон сохранения и превращения энергии называют первым законом термодинамики. Согласно первому закону термодинамики, приращение внутренней энергии термодинамической системы при переходе из одного состояния в другое равно алгебраической сумме работы, совершённой внешними силами, и количества теплоты, полученного или отданного системой при взаимодействии с внешними телами: Поскольку работа внешних сил равна работе, совершаемой термодинамической системой, взятой с противоположным знаком ( Если система представляет собой действующее устройство, периодически возвращающееся в исходное состояние, то при этом AU-0 и A-Q. Механизм, который мог бы совершать работу без изменения состояния составляющих его тел и без теплопередачи от внешних тел, называют «вечным двигателем первого рода». Поэтому первый закон термодинамики можно сформулировать и следующим образом: невозможен вечный двигатель первого рода, т. е. такой двигатель, который при неизменном значении собственной внутренней энергии совершал бы работу большую, чем энергия, получаемая им извне. Применим первый закон термодинамики к различным изопроцессам, происходящим с идеальным одноатомным газом. Изохорный процессПусть идеальный одноатомный газ находится в цилиндрическом сосуде, закрытом неподвижным поршнем (V = const). Нагреем сосуд с газом. Объём газа остаётся практически постоянным (тепловым расширением сосуда пренебрегаем) (рис. 60), следовательно, работа силы давления газа А= 0. Тогда первый закон термодинамики примет вид Это означает, что всё передаваемое газу количество теплоты идёт на увеличение его внутренней энергии. При этом приращение внутренней энергии газа процессе отдаёт количество теплоты, то его внутренняя энергия убывает:
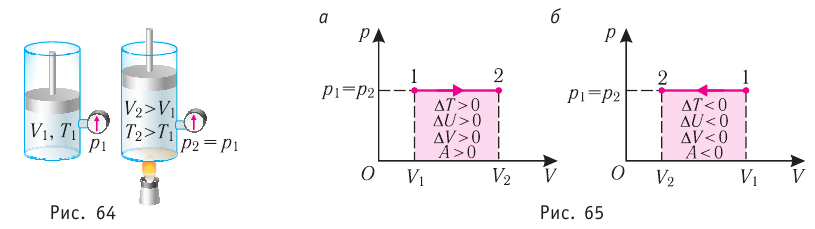
Изотермический процессПусть цилиндрический сосуд с газом под поршнем находится в термостате — устройстве, в котором поддерживается постоянная температура. В этом случае внутренняя энергия идеального одноатомного газа Какие выводы следуют из этого? Если с помощью внешнего устройства медленно перемещать поршень в сосуде так, чтобы объём газа увеличивался ( Если же внешнее устройство обеспечивает медленное уменьшение объёма газа в сосуде ( Изобарный процессПусть газ находится в цилиндрическом сосуде, закрытом поршнем, который может свободно или под постоянной нагрузкой перемещаться (рис. 64). Нагреем газ, передав ему некоторое количество теплоты (Q > 0). Согласно первому закону термодинамики (11.2) переданное газу количество теплоты частично расходуется на увеличение внутренней энергии При изобарном процессе работа расширения (сжатия) газа
При изобарном сжатии газа внешние силы совершают работу А’ > 0. Чтобы давление газа при этом оставалось постоянным, газ необходимо охлаждать, т. е. он должен отдавать в окружающую среду некоторое количество теплоты (Q При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи Сайт пишется, поддерживается и управляется коллективом преподавателей Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC. Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг. Источник |




 ,
,
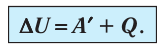
 (11.З)
(11.З)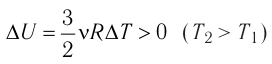 (рис. 61, а). А если газ при изохорном
(рис. 61, а). А если газ при изохорном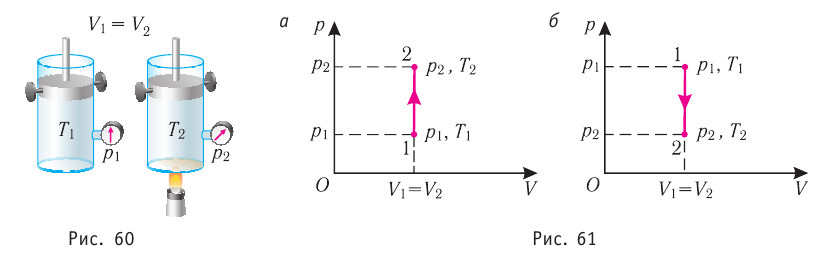
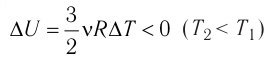 (рис. 61, б).
(рис. 61, б).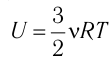 остаётся постоянной, а её изменение
остаётся постоянной, а её изменение 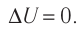 Тогда первый закон термодинамики примет вид
Тогда первый закон термодинамики примет вид 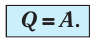 (11.4)
(11.4)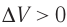 , поскольку
, поскольку 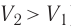 ) (рис. 62), то работа силы давления расширяющегося газа А > 0 (рис. 63, а). При одинаковой первоначальной температуре термостата и газа теплопередачи не происходит. Положительная работа силы давления расширяющегося газа совершается за счёт уменьшения его внутренней энергии, а значит, и температуры. Тут же возникает теплопередача от термостата газу. При медленном перемещении поршня в сосуде температура газа успевает выравняться, а реально происходящий процесс близок к изотермическому процессу, при котором расширяющийся газ получает некоторое количество теплоты (Q > 0) от термостата.
) (рис. 62), то работа силы давления расширяющегося газа А > 0 (рис. 63, а). При одинаковой первоначальной температуре термостата и газа теплопередачи не происходит. Положительная работа силы давления расширяющегося газа совершается за счёт уменьшения его внутренней энергии, а значит, и температуры. Тут же возникает теплопередача от термостата газу. При медленном перемещении поршня в сосуде температура газа успевает выравняться, а реально происходящий процесс близок к изотермическому процессу, при котором расширяющийся газ получает некоторое количество теплоты (Q > 0) от термостата.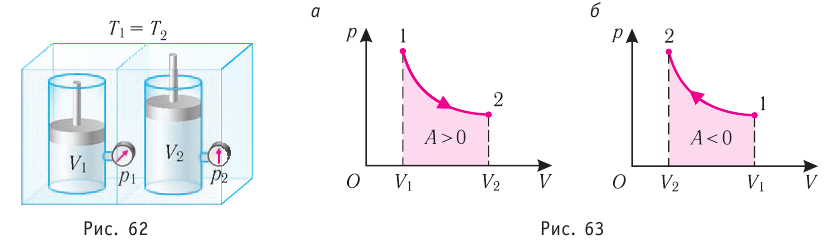
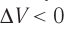 , так как
, так как 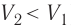 ), то работа силы давления при сжатии газа А 0.
), то работа силы давления при сжатии газа А 0.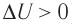 ) системы и частично идёт на совершение работы силой давления газа при его расширении (A>0)(рис. 65, a):
) системы и частично идёт на совершение работы силой давления газа при его расширении (A>0)(рис. 65, a):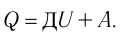
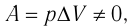 , и первый закон термодинамики принимает вид
, и первый закон термодинамики принимает вид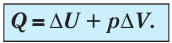 (11.5)
(11.5)