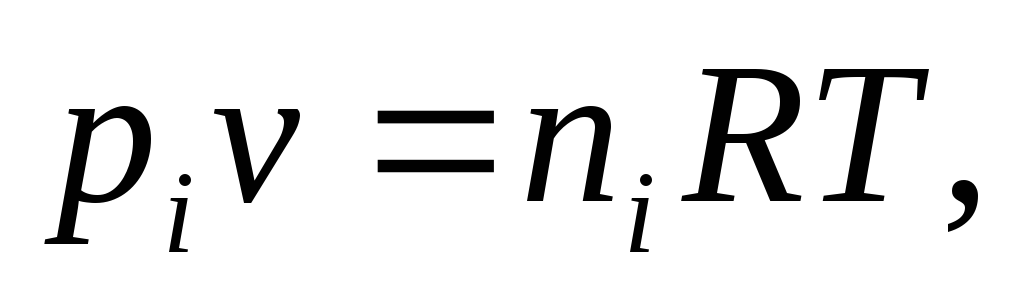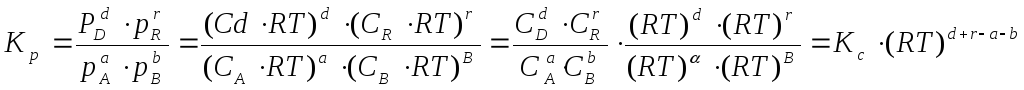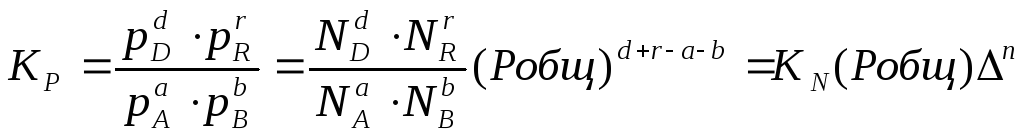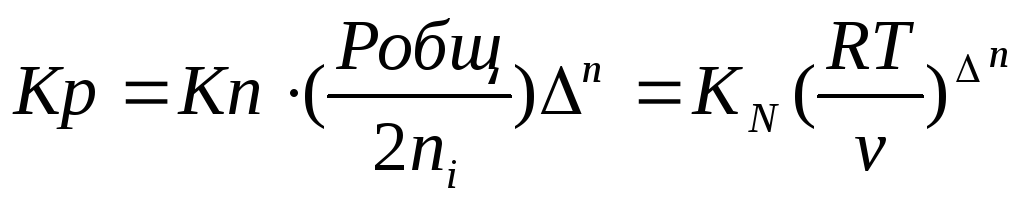2.3. Способы выражения константы равновесия
Константа равновесия может быть выражена различными способами. Если концентрации веществ, участвующих в реакции, выражены в молярных единицах молярности , т.е. в моль/л, то она обычно обозначается Кс и для равновесия обратимой реакции
записывается в виде:

Для гомогенной газовой реакции константу равновесия удобнее выразить через парциальные давления веществ:
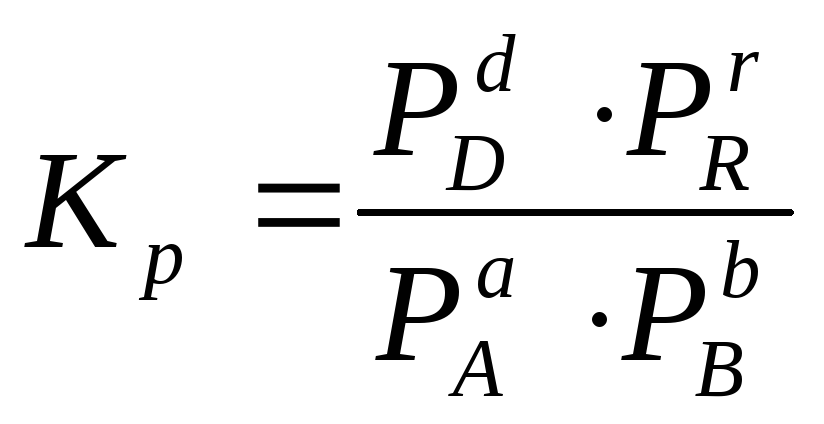
Иногда константу равновесия удобно выразить не через парциальные давления и концентрации, а через количества веществ:
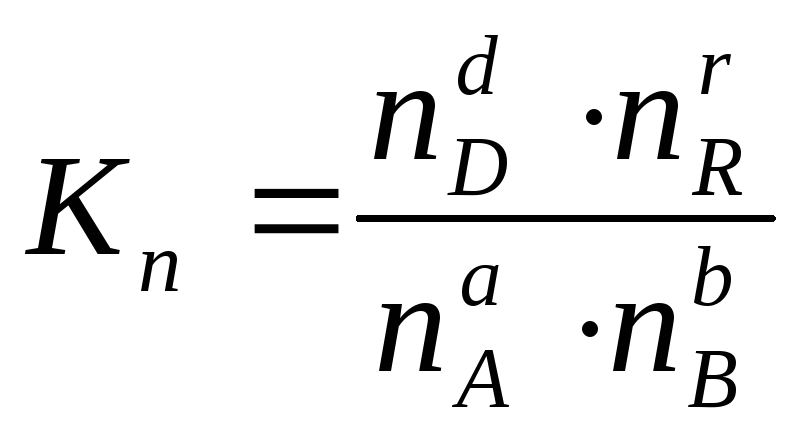
или через соответствующие мольные доли:
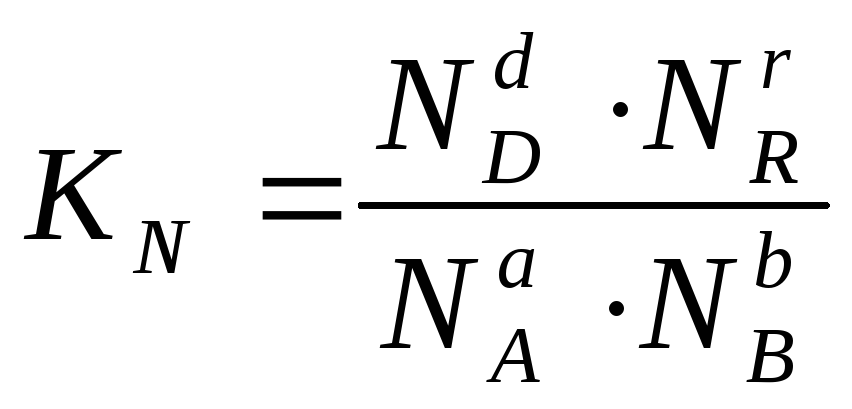
В общем случае константы равновесия Кс, Кр, Кn и КN различны по значениям. Установим связь между ними.
В газовых системах, для характеристики которых применимо уравнение состояния идеальных газов Менделеева – Клайперона, значение парциального давления любого компонента можно вычислить следующим образом:
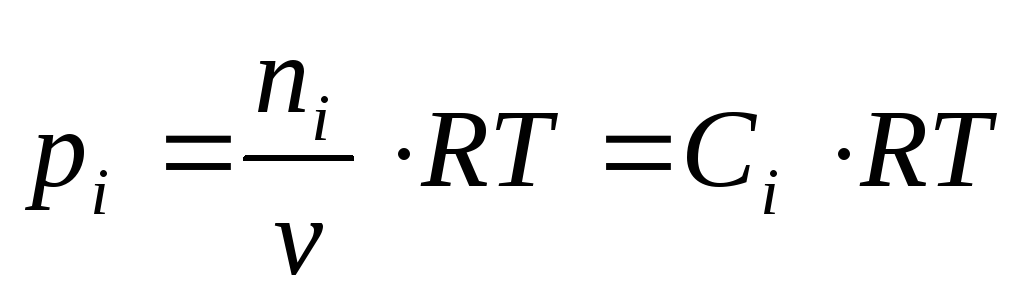
где C – концентрация i-го компонента, выраженная в моль/л. Подставим значение р из уравнения (2.8) в уравнение (2.5) и получим соотношение, которым определяется связь Кс и Кр:
или 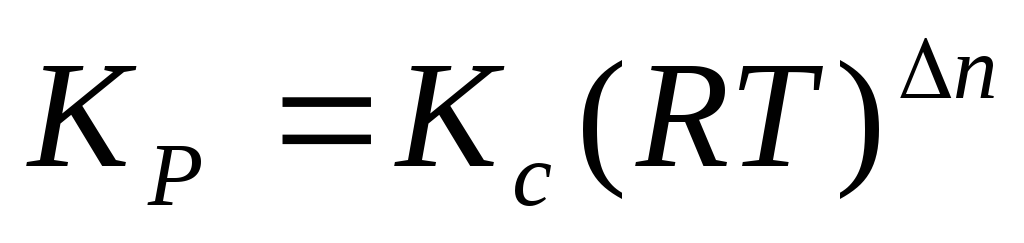
где 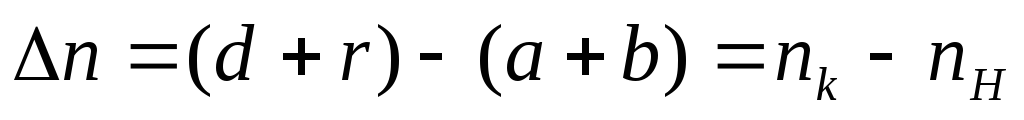
Для идеальных газов парциальные давления связаны с общим давлением Робщ и мольной долей Ni данного компонента в смеси согласно законам Дальтона следующим равенством:
где рi – парциальное давление компонента; Ni – мольная доля этого компонента в смеси; Робщ – общее давление.
Подставим значение рi в уравнение (2.5), получим:
Воспользовавшись соотношением Pi = Ni∙ Робщ =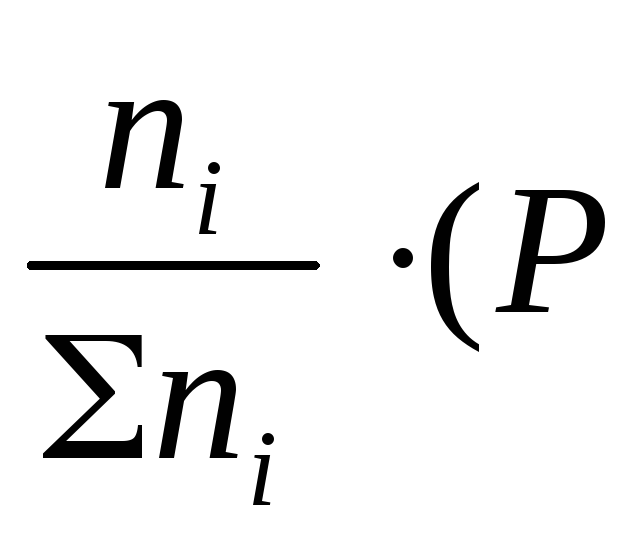
где ni – число моль компонента i в смеси, а ni – число моль всех компонентов в смеси, получаем:
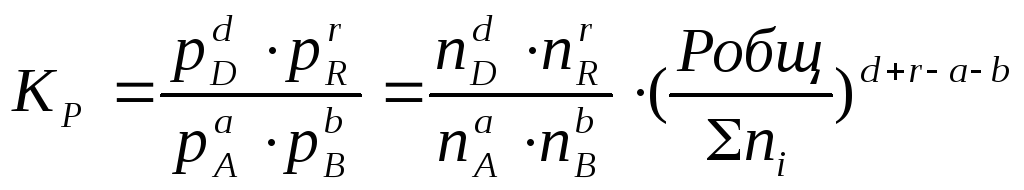
Таким образом, если n≠ 0, т.е. если реакция сопровождается изменением числа моль, то имеет место соотношение:
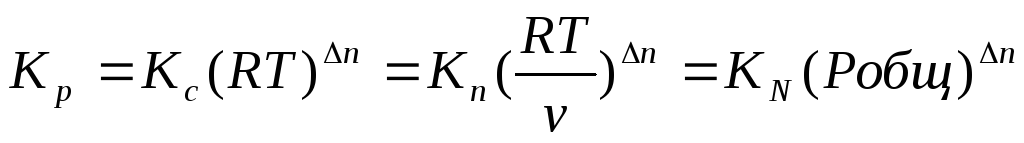
Если же ∆n=0 (реакция не сопровождается изменением числа моль), то Кр = Кс = Кn = KN , т.е. значения всех видов констант равновесия совпадают.
2.4. Смещение химического равновесия
При постоянных условиях химическое равновесие сохраняется как угодно долго. Однако внешние условия не могут бесконечно оставаться неизменными, а изменение хотя бы одного из них нарушает состояние равновесия, т.е. скорос-
ти прямой и обратной реакций не будут равны между собой (v1 v2). Но, так как все физико-химические системы самопроизвольно стремятся к состоянию равновесия, то с течением времени оно вновь установится. Однако, это будет новое равновесие, с другими значениями равновесных концентраций, отвечающими другим, изменившимся условиям.
В каком направлении сместится равновесие при том или ином внешнем воздействии? Ответ на этот вопрос дает принцип Ле-Шателье Брауна, который можно сформулировать следующим образом: если на систему, находящуюся в состоянии равновесия, оказывается какое – либо внешнее воздействие, то система отвечает таким образом, чтобы это воздействие ослабить. При этом, если в результате нарушения равновесия скорость прямой реакции будет больше скорости обратной реакции, то говорят, что равновесие смещено вправо (v1 v2), и соответственно, если преобладает скорость обратной реакции, говорят, что равновесие смещено влево (v1 v2 ).
Важнейшими условиями, определяющими состояние химического равновесия, являются:
1) концентрация реагирующих веществ
3) давление (для реакций, протекающих с изменением давления).
Изменение хотя бы одного из них приведет к нарушению равновесия.
Источник
Какие способы выражения константы равновесия
Большинство химических реакций протекают одновременно в двух направлениях: в сторону образования продуктов реакции (прямая реакция) и в сторону разложения последних (обратная реакция). Вследствие химической обратимости реакции не доходят до конца. Скорость прямой реакции уменьшается, а скорость обратной, напротив, возрастает. Когда эти скорости выравниваются наступает состояние химического равновесия.
Так как химически обратимые реакции до перехода в равновесное состояние протекают с конечными скоростями, то с точки зрения термодинамики они не обратимы. Однако можно мысленно представить, что эти реакции идут бесконечно медленно через смежные равновесные состояния. Тогда к ним можно применить общие условия термодинамического равновесия.
Для гомогенных обратимых реакций экспериментально Гульбергом и Ваге был установлен закон действующих масс. При постоянной температуре отношение произведения равновесных концентраций (или парциальных давлений) продуктов реакции к произведению равновесных концентраций (или парциальных равновесий) исходных веществ есть величина постоянная.
Этот экспериментально установленный закон может быть получен методом термодинамических потенциалов. Рассмотрим реакцию в газовой фазе:
аА(г) + b В ↔ сС + dD
Когда система достигает термодинамического равновесия, то термодинамический потенциал при фиксированных естественных переменных достигает минимума. Равновесие, таким образом, можно охарактеризовать выражением химических потенциалов, когда потенциалы продуктов реакции сравняются с потенциалами исходных веществ:
с μ ( с ) + d μ (D) – a μ (a) — b μ (b) = 0 (6 – 1)
Если естественными переменными являются p и T , то 


Отсюда для систем, подчиняющихся закону идеальных газов, можно получить выражения для μ i
μ i = μ i ° + RTlnCi (6 – 2) 
где μ i ° — стандартный химический потенциал.
Подставляется (6 – 2) в (6 – 1) и перенося постоянные величины в левую часть, получаем
сμ C ° + d μ D ° — a μ A ° — b μ B ° = — RTln 

Поскольку в левой части выражение не зависит от концентраций, то выражение под логарифмом является постоянной величиной при постоянной температуре:


Для идеального газа парциальные давления пропорциональны концентрациям, поэтому константа равновесия может быть всегда выражена через равновесные парциальные давления:

Аналогично может быть записано выражение через мольные доли:

Для идеальных газов эти константы связаны между собой соотношением:

где 
Следует обратить внимание, что в полученных соотношениях только KN зависит от общего давления. Она позволяет нам оценивать сдвиг равновесия в газовых реакциях при изменении общего давления. Следует иметь в виду, что давление в этих выражениях складывается из парциальных давлений компонентов системы и не учитывает влияние инертных газов, если они присутствуют в реакционной смеси. Естественно инертный газ «разбавляет» компоненты реакционной смеси и поэтому влияет на KN .
Из уравнения (6 – 3) вытекает связь константы равновесия с ∆ rG °:

Это уравнение было впервые получено Вант – Гофором методом циклов и получило название уравнения изотермической химической реакции. Очевидно, в этом уравнении ∆ rGT ° относится к этой температуре, при которой определена Кр. Уравнение изотермической химической реакции позволяет определить константу равновесия при заданных условиях не прибегая к исследованию равновесия. Величина ∆ rGT ° может быть рассчитана на основе термических констант для индивидуальных веществ.
Если заданы концентрации (парциальные давления) отличные от равновесных, то можно записать более общий вид уравнения изотермической химической реакции:

Это выражение позволяет определить направление самопроизвольного процесса.
Уравнение изотермы химической реакции позволяет получить выражение для температурной зависимости константы равновесия.
Запишем уравнение Гиббса – Гельмгольца:

Подставим выражение для 

Дифференцируем уравнение (6 – 5)


Из уравнения (6 — 5´) получаем уравнение изобары химической реакции:

Если проинтегрировать уравнение (6 – 6) в предположении, что ∆ rHT ° не зависит от температуры, то получим уравнение:

где С – константа интегрирования.
Уравнение (6 – 7) хорошо выполняется в узких интервалах температур и позволяет определить ∆ rGT °.
Для широких интервалов температур ln K р представляют в виде степенных рядов или других аналитических формах:

Такие выражения позволяют рассчитать все термодинамические функции для процессов, для которых данные зависимости получены.
Выражения для термодинамических потенциалов, полученные для идеального газа. Для реальных газов, а особенно для газовых растворов возникают затруднения. Это связано с тем, что расчет концентраций и давлений должен быть проведен исходя из уравнения состояния. Однако для реальных систем единое достаточно простое уравнение состояния получить не удалось.
В связи с этим в термодинамике реальных систем применяется эмпирический метод, предложенный Льюисом. Льюис предложил в уравнениях термодинамики, полученных для идеальных систем заменить давления p на величину летучести f , а концентрации С на активности a .
При такой замене выражения для констант равновесия не меняются по форме. Но этот прием позволяет связать экспериментально найденные свойства реального газа с термодинамическими параметрами.
Летучести и активности – это экспериментальные величины, которые находятся из условия, что для раствора при бесконечном разбавлении или газа при давлении стремящимся к 0 активность приближается к аналитической концентрации, а летучесть к реальному давлению идеального газа. Исходя из этой посылки рассчитываются активности и летучести.
При 1273 К и общем равновесии 30 атм. В равновесной системе




В соответствии с законом Авогадро, объёмный процент равен мольному проценту. Следовательно, 

Отсюда находим 

В отличие от 





Для 25% 

Следовательно, 
При 2000°С и общем давлении 1 атм. 2% воды диссоцииовано на водород и кислород. Рассчитайте константу равновесия реакции 
Источник