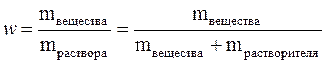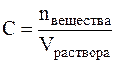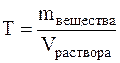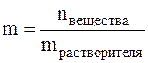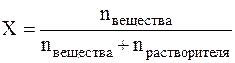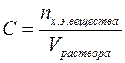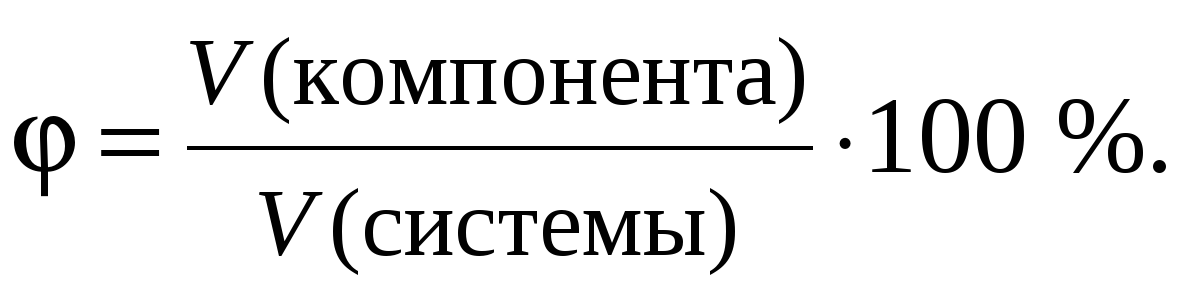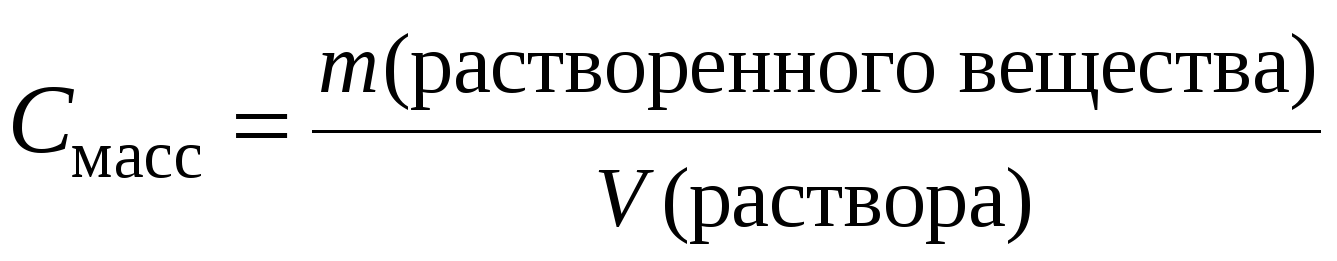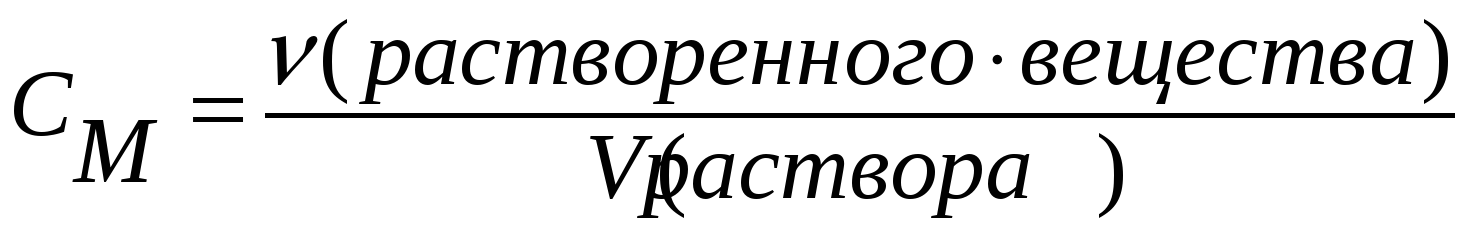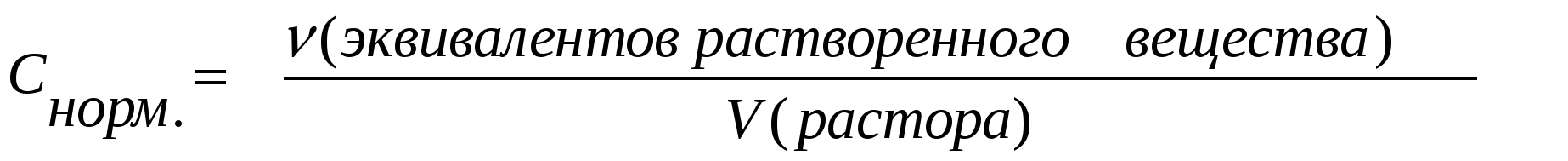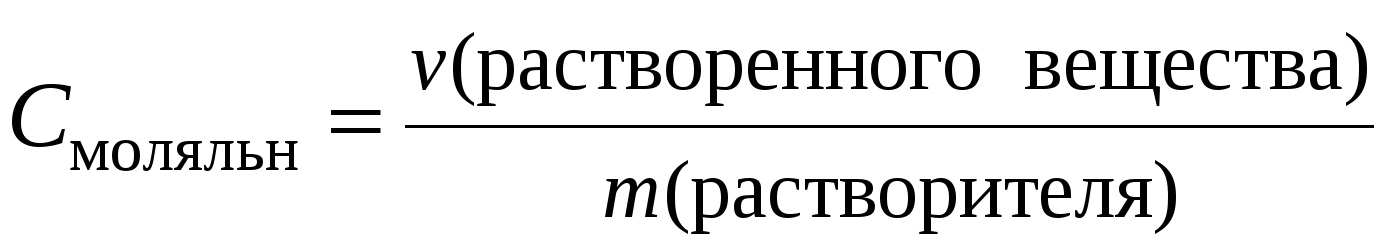Способы выражения количественного состава растворов
Массовая доля – ω%, равна отношению массы растворенного вещества к массе раствора, выраженная в процентах: ω % = (m(x) / mр-ра) • 100%, массу раствора можно выразить через объем и плотность mр-ра = Vр-ра• ρ р-ра, тогда ω % = (m(x) / Vр-ра • ρ р-ра) • 100%. Массовая доля показывает количество грамм растворенного вещества, содержащегося в 100 г раствора.
0,9% раствор натрия хлорида означает, что в 100 граммах данного раствора содержится 0,9 г NaCl и 99,1 г воды. В медицине и фармации используется выражение – процентная концентрация – как синоним массовой доли.
Молярная концентрация – С(х), равна отношению количества вещества к объему раствора: С(х) = n(x) / Vр-ра, моль/л. Молярная концентрация показывает количество молей растворенного вещества в 1литре раствора. Зная, что n(x) = m(x) / М(х), формулу для расчета молярной концентрации можно представить следующим образом: С(х) = m(x) / М(х)•Vр-ра. Если использовать выражение массовой доли, тоС(х) = ω % • 10 • ρ р-ра / М(х).
С(NaCl) = 0,5 моль/л говорит о том, что в 1 литре раствора содержится 0,5 молей или 0,5 моль•58,5 г/моль = 29,25 г хлорида натрия. Молярную концентрацию раствора также называют молярностью, обозначают – М. Для раствора С(NaCl) = 0,5 моль/л обозначение молярности – 0,5 М.
Молярная концентрация эквивалента– С(1/z x), равна отношению количества вещества эквивалента к объему раствора: С(1/z х) = n(1/z x) / Vр-ра, моль/л.
Под эквивалентом (z) понимается некая реальная (молекула, атом, ион) или условная частица (УЧ) вещества, которая может присоединять, отдавать или быть каким-либо образом эквивалентна одному протону водорода в кислотно-основной реакции или одному электрону в окислительно-восстановительной реакции.
Например, молекула H2SO4 содержит два эквивалента вещества, z(H2SO4) = 2; молекула NaOH – один эквивалент, z(NaOH) = 1. Смысл понятия эквивалент заключается в том, что в реакции участвует равное число эквивалентов веществ. Так, в реакции: H2SO4 + 2NaOH = Na2SO4 + 2H2O с двумя эквивалентами серной кислоты будут взаимодействовать два эквивалента гидроксида натрия. Для расчетов чаще используют понятие фактора эквивалентности.
Фактор эквивалентности – fэкв(х) = 1/z, – число, обозначающее какая часть реальной частицы вещества х эквивалентна одному протону водорода в кислотно-основной реакции или одному электрону в окислительно-восстановительной реакции.
Расчет факторов эквивалентности:
По формуле вещества
fэкв(кислоты) = 1 / основность кислоты
fэкв(основания) = 1 / кислотность основания
fэкв(соли) = 1 / (количество атомов металла • степень окисления металла)
fэкв(оксида) = 1 / (количество атомов элемента • валентность элемента)
По уравнениям реакции
Для кислотно-основных реакций:
fэкв(H2SO4) = 1/2, так как в реакции участвовали два протона водорода, следовательно одному протону водорода эквивалентна ½ часть молекулы H2SO4; fэкв(NaOH) = 1, потому что одна молекула гидроксида натрия взаимодействует с одним протоном водорода или с одним эквивалентом кислоты.
Исходя из аналогичных рассуждений, значения факторов эквивалентности для реакций: H2SO4 + NaOH → NaHSO4 + H2O и Na2B4O7 + 2HCl + 5H2O → 4H3BO3 + 2NaCl будут следующими: fэкв(H2SO4) = 1; fэкв(NaOH) = 1; fэкв(Na2B4O7) = 1/2; fэкв(HCl) = 1
Для окислительно-восстановительных реакций:
fэкв(окислителя) = 1 / количество принятых электронов
fэкв(восстановителя) = 1 / количество отданных электронов
Зная способы расчета факторов эквивалентности, можно рассчитать количество вещества эквивалента n(1/z x) = z • n(x).Масса количества вещества эквивалента выражается молярной массой эквивалента вещества М(1/z х) = 1/z • М(х), г/моль.
Поскольку, С(1/z х) = n(1/z x) / Vр-ра, данную формулу можно представить следующим образом: С(1/z х) = n(x) • z / Vр-ра или С(1/z х) = m(x) • z / М(х) • Vр-ра.
Так как m(x) / М(х) • Vр-ра = С(х), то можно проследить взаимосвязь между молярной концентрацией эквивалента и молярной концентрацией:С(1/z х) = С(х) • z; С(х) = С(1/z х) / z.
Молярная концентрация эквивалента показывает количество вещества эквивалента в 1 литре раствора. Раствор серной кислоты с молярной концентрацией эквивалента 0,1 моль/л подразумевает, что в 1 л данного раствора содержится 0,1 моль эквивалента серной кислоты или m(H2SO4) = С(1/2 H2SO4) • М(H2SO4) • Vр-ра / 2 = 0,1 • 98 • 1/2 = 4,9 г.
Молярную концентрацию эквивалента называют нормальной или эквивалентной концентрацией. Обозначают буквами – н или N. Для раствора С(1/2 H2SO4) = 0,1 моль/л обозначение нормальной или эквивалентной концентрацией – 0,1 н или 0,1 N.
Моляльная концентрация вещества, или моляльность b(x), — величина, измеряемая отношением количества вещества к массе растворителя. b(x) = n(x) / mрастворителя, моль/кг.
Молярная доля вещества — χ,показывает отношение количества этого вещества к суммарному количеству вещества всех компонентов раствора.χi = ni / Σni. Для раствора, состоящего из трех компонентов А, В, С молярную долю, например, компонента А рассчитывают по формулеχ(А) = n(A) / (n(A)+n(B)+n(C)).
Титр – Т(x),величина, равная отношению массы растворенного вещества к 1 мл раствора. Единица измерения — г/мл. Значение титра можно рассчитать по формулам: Т(x) = m(x) / Vр-ра; Т(x) = С(x) • М(х) / 1000; Т(x) = С(1/z х) • М (1/z х) / 1000.
Т(НСl) = 0,00365 г/мл говорит о том, что в 1мл данного раствора содержится 0,00365 г НСl.
Массовая концентрация – γ(х) – отношение массы растворенного вещества, содержащегося в растворе к объему раствора.γ(х) = m(x) / Vр-ра, г/л, г/мл.
Миллиграмм процент – мг % —показывает количество миллиграммов растворенного вещества в 100 мл раствора.
Промиле – 0 /00 –показывает количество миллиграммов растворенного вещества в 1000 мл раствора.
Закон эквивалентов:Вещества, растворы которых имеют одинаковую молярную концентрацию эквивалента, реагируют в равных объемах, то есть в равных количествах вещества эквивалента.
Формула для расчета объема раствора для приготовления методом разбавления
Источник
Способы выражения состава растворов



Состав любого раствора может быть выражен как качественно, так и количественно. Обычно, при качественной оценке раствора применяют такие понятия как, насыщенный, ненасыщенный, пересыщенный (или перенасыщенный), концентрированный и разбавленный раствор.
Насыщенным называется раствор, в котором содержится максимально возможное при данных условиях (t, р) количество растворённого вещества. Насыщенный раствор часто находится в состоянии динамического равновесия с избытком растворённого вещества, при котором процесс растворения и процесс кристаллизации (выпадения вещества из раствора) протекают с одинаковой скоростью.
Для приготовления насыщенного раствора растворение вещества необходимо вести до образования осадка, не исчезающего при длительном хранении.
Ненасыщенным называется раствор, который содержит вещества меньше, чем его может раствориться при данных условиях.
Перенасыщенные растворы содержат в себе по массе больше растворённого вещества, чем его может раствориться в данных условиях. Образуются перенасыщенные растворы при быстром охлаждении насыщенных растворов. Они неустойчивы и могут существовать ограниченное время. Очень быстро лишнее растворённое вещество выпадает в осадок, а раствор превращается в насыщенный.
Следует отметить, что при изменении температуры насыщенный и ненасыщенный растворы могут легко обратимо превращаться друг в друга. Процесс выделения твёрдого вещества из насыщенного раствора при понижении температуры называется кристаллизацией. Кристаллизация и растворение играют огромную роль в природе: приводят к образованию минералов, имеют большое значение в атмосферных и почвенных явлениях. На основе кристаллизации в химии распространён метод очистки веществ, который называется перекристаллизацией.
Для приблизительного количественного выражения состава раствора используют понятия концентрированный и разбавленный растворы.
Концентрированным называется раствор, в котором масса растворённого вещества соизмерима с массой растворителя, т.е. не отличается от него более чем в 10 раз.
Если же масса растворённого вещества более чем в десять раз меньше массы растворителя, то такие растворы называются разбавленными.
Однако следует помнить, что деление растворов на концентрированные и разбавленные условно, и чёткой границы между ними нет.
Точный количественный состав растворов выражают при помощи массовой доли растворённого вещества, его молярной концентрации, а также некоторыми другими способами.
Массовая доля растворённого вещества (w) – это безразмерная физическая величина, равная отношению массы растворённого вещества к общей массе раствора,т.е.
Обычно выражается в долях единицы или в процентах. Массовая доля, выраженная в %, называется процентной концентрацией. Она показывает, какая масса вещества растворена в 100 г раствора.
Молярная концентрация (С) или молярность – это величина, равная отношению количества растворённого вещества к объему раствора (в литрах), т.е.
Молярность измеряется в моль/л и показывает сколько моль вещества растворено в одном литре раствора. Молярность обозначается обычно буквой М. Если в одном литре раствора содержится 1 моль вещества, то такой раствор называется одномолярным (1М), если 0,1 моль вещества – децимолярным (0,1М), если 0,01 моль вещества – сантимолярным (0,01М), если 0,001 моль вещества – миллимолярным (0,001М).
Титром (Т) называется отношение массы вещества в граммах к объёму раствора в мл, т.е.
Титр имеет размерность г/мл, он показывает, сколько грамм вещества растворено в 1 мл раствора.
Моляльная концентрация или моляльность (m) – это величина, равная отношению количества растворённого вещества к массе растворителя, выраженной в кг, т.е.
Моляльность имеет размерность моль/кг и показывает, какое количество вещества растворено в 1 кг растворителя.
Мольная доля (Х) – это величина, равная отношению количества растворённого вещества к общему количеству вещества в растворе:
Мольная доля – это безразмерная величина и измеряется в долях единицы или в %.
Молярная концентрация химического эквивалента вещества (С) или нормальная концентрация – это величина, равная отношению количества химического эквивалента растворённого вещества к объему раствора (в литрах), т.е.

Молярная концентрация химического эквивалента вещества измеряется в моль/л и показывает сколько моль эквивалента вещества растворено в одном литре раствора. Она обозначается обычно буквой н. Если в одном литре раствора содержится 1 моль химического эквивалентавещества, то такой раствор называется однонормальным (1н), если 0,1 моль вещества – децинормальным (0,1н), если 0,01 моль вещества – сантинормальным (0,01н), если 0,001 моль вещества – миллинормальным (0,001н).
Источник
Лекция по теме «Способы количественного выражения состава растворов»

Лекция содержит теоретический материал, вопросы для самоконтроля, вопросы и упражнения для самоподготовки студентов по теме.
Просмотр содержимого документа
«Лекция по теме «Способы количественного выражения состава растворов»»
Способы количественного выражения состава растворов
Раствор — однофазная система переменного состава, состоящая из двух или более компонентов. Растворы— гомогенные (однородные) системы, то есть каждый из компонентов распределён в массе другого в виде молекул, атомов или ионов.
Понятию «система» дается следующее определение:
система это тело или совокупность тел, обособленных от окружающей среды физическими или мысленными границами.
Химические вещества, входящие в состав системы, являются ее составными частями или компонентами.
Системы могут быть одно- или многокомпонентными. Если компоненты в системе равномерно распределены друг в друге (диспергированы), то такие системы называются дисперсными системами.
Совокупность одинаковых (по составу, структуре и свойствам) участков системы называется фазой. Однородные, однофазные системы называются гомогенными. Неоднородные многофазные системы называются гетерогенными.
Отдельные части гетерогенных систем (фазы) имеют поверхность раздела фаз.
Например, кристаллы льда, находящиеся в жидкой воде, образуют одну фазу, жидкая вода – вторую, а водяной пар – третью фазу. Эти фазы отделены друг от друга поверхностями раздела. Таким образом, в данном случае мы имеем дело с гетерогенной трехфазной (твердое тело, жидкость, газ), однокомпонентной (H2O) системой.
Основными компонентами растворов являются растворитель и растворенное вещество.
Растворенным веществом, независимо от его количества, считается тот компонент, который придает системе специфические свойства.
В зависимости от агрегатного состояния растворы могут быть твердыми (сплавы металлов, некоторые минералы) и жидкими (растворы щелочей, морская вода).
Подробнее остановимся на жидких растворах, в которых растворитель – жидкость.
По исходному агрегатному состоянию растворяемого вещества газ (г), жидкость (ж) или твердое тело (т) жидкие растворы можно разделять на 3 группы: (ж + г), (ж + ж) и (ж + т).
К первой из них относятся такие системы, как растворы соляной, сероводородной и сернистой кислот, представляющие собой водные растворы газообразных HCI, H2S, SO2.
К системе (ж + ж) относятся растворы спиртов, эфиров, уксусной и азотной кислот в воде.
Третья группа растворов является самой многочисленной, так как к ней относятся водные растворы большинства солей, щелочей, твердых кислот (например, борной, лимонной).
По типу взятого растворителя различают водные (растворитель – H2O) и неводные растворы (растворитель – бензол, хлороформ, ацетон и др.).
Все растворы относятся к дисперсным (раздробленным) системам.
По размеру диспергированных частиц все растворы подразделяются на истинные и коллоидные. Раствор является истинным (гомогенной системой), если растворенное вещество не образует отдельную фазу. Считается, что раствор будет истинным, если размер частиц растворенного вещества мал и не превышает 10А 0 (10 9 м), т.е. они представляют собой отдельные молекулы или ионы.
При увеличении размеров диспергированных частиц в растворе от 10 до 1000 А 0 (от 10 5 до 10 7 см) система приобретает специфические свойства, связанные с очень большой поверхностью раздела фаз. Такие системы называют микрогетерогенными или коллоидными.
Частицы коллоидных размеров называются мицеллами.
Гетерогенные дисперсные системы, содержащие частицы размером более 1000 А 0 (более 10 5 см), являются грубодисперсными. Они обычно неустойчивы и быстро разрушаются. К ним относятся, например, пены (дисперсные системы типа газ в жидкости), эмульсии (жидкость в жидкости) и суспензии (твердые вещества в жидкостях).
Прямой процесс растворения вещества в растворителе сопровождается обратным процессом выделения растворенного вещества из раствора. Для твердых веществ обратным процессом является кристаллизация вещества из раствора.
Вещество прекращает растворяться, когда наступает состояние динамического равновесия прямого и обратного процессов и скорость кристаллизации становится равной скорости растворения. Такой раствор называется насыщенным. При сохранении условий неизменными, концентрацию растворяемого вещества в нем повысить невозможно.
Если в растворе содержится растворенного вещества меньше, чем может раствориться при данных условиях, то он называется ненасыщенным.
В пересыщенном растворе растворено вещества больше, чем может раствориться при данных условиях растворения. Получают такие растворы осторожным охлаждением насыщенных при более высокой температуре растворов или при выпаривании части растворителя из насыщенного раствора. Пересыщенные растворы обычно нестабильны и избыток растворенного вещества легко выделяется из раствора.
Растворимость вещества измеряется концентрацией (см. далее) растворенного вещества в его насыщенном растворе.
Количественное значение растворимости обычно выражают максимальной массой вещества в граммах, которую можно растворить в 100 г растворителя при данной температуре. Это количество называется коэффициентом растворимости или просто растворимостью (S).
По растворимости вещества делятся на:
хорошо растворимые (коэффициент растворимости S I г в 100 г растворителя), например KJ , AgNO3,
малорастворимые (10 –3 г S I г в 100 г растворителя), например, Mg(ОH)2, СаSО4, СН4, N2, O2,
практически нерастворимые (коэффициент растворимости S 10 –3 г в 100 г растворителя), например Аg, BaSO4, стекло.
Не существует абсолютно нерастворимых веществ.
В настоящее время для выражения количественного состава растворов используются различные способы. Наиболее часто используются следующие:
1. Концентрированный раствор – раствор, содержащий относительно большое количество растворенного вещества. В этом случае масса растворенного вещества соизмерима с массой растворителя.
Например, в 100 г воды растворено 30 г хлорида натрия (30 г и 100 г – сравнимые величины). Такой раствор можно считать концентрированным.
2. Разбавленный раствор – это раствор, в котором содержание растворенного вещества мало по сравнению с массой растворителя.
Например, в 100 г воды растворено 0,1 г гидроксида натрия. Это разбавленный раствор, так как массы растворенного вещества и растворителя сильно отличаются друг от друга.
Термины концентрированный и разбавленный используются лишь для приблизительного выражения количественного состава растворов. Границы между этими понятиями достаточно условны.
Для точного выражения количественного состава растворов используют следующие способы:
1. Массовая доля (ранее использовался термин «процентная концентрация»).
Массовая доля показывает отношение массы данного компонента, содержащегося в системе (растворе), к общей массе этой системы (раствора).
Обычно массовая доля выражается в долях единицы или процентах и обозначается греческой буквой ω (омега):
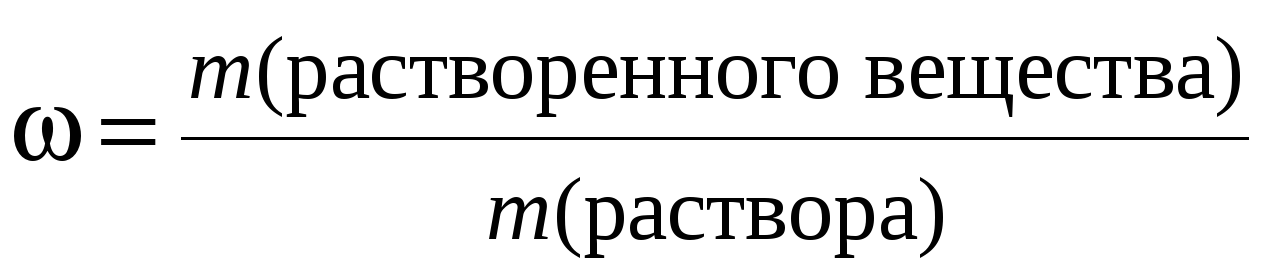
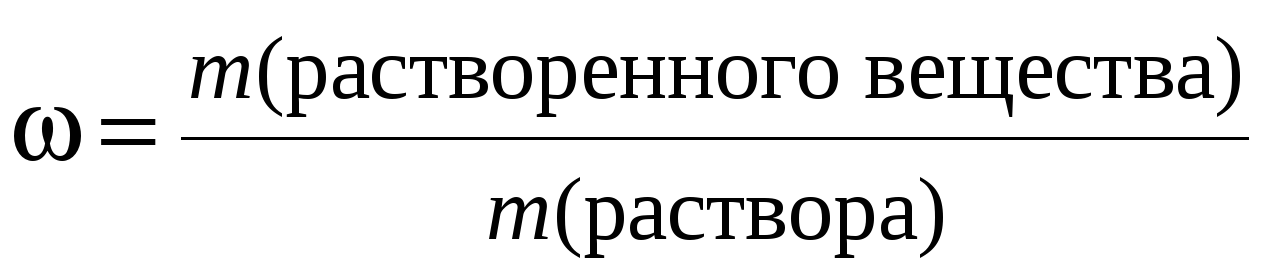
При выражении массовой доли раствора (в процентах), ее значение показывает массу растворенного вещества (в граммах), содержащееся в 100 г раствора.
Например, раствор с массовой долей KNO3 равной 24 % содержит в растворе массой 100 г: растворенное вещество (нитрат калия) массой 24 г и растворитель (воду) массой (100 – 24) = 76 г.
2. Объемная доля.
Этот способ выражения количественного состава представляет собой отношение объема компонента (растворенного вещества), содержащегося в системе (растворе), к общему объему системы (раствора). Объемная доля выражается либо в долях единицы, либо в процентах и обозначается греческой буквой (фи).

При выражении объемной доли (в процентах) ее значение показывает объем растворенного вещества (в соответствующих единицах объема), содержащийся в 100 аналогичных единицах объема раствора.
3. Мольная (молярная) доля.
Этот способ выражения количественного состава растворов представляет собой отношение количества вещества (в молях) компонента, содержащегося в данной системе, к сумме количеств всех веществ в системе. Выражается в долях единицы, либо в процентах и обозначается греческой буквой 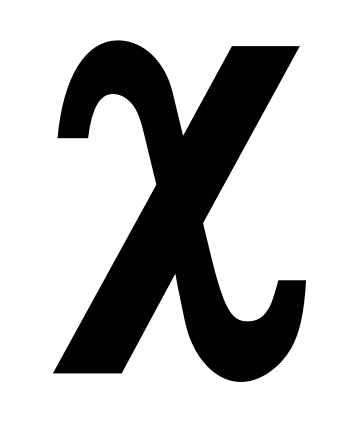
где ν – количество вещества в молях, ∑ν (раствора) – сумма количеств всех веществ в растворе.
Например, раствор с мольной долей = 2 % этанола содержит 2 моль этанола на 100 моль системы ( 2 моль этанола и 100 – 2 = 98 моль воды).
Если для количественной оценки состава раствора используют отношение массы вещества (m) или его количества (ν) к общему объему раствора (V), то применяют понятие «концентрация» (С).
4. Массовая концентрация.
Представляет собой отношение массы компонента, содержащегося в системе (растворе), к объему этой системы (раствора).
где m – масса растворенного вещества, V – объем раствора.
Наиболее часто используется массовая концентрация, имеющая размерности [ кг/м 3 ],[ г/л ], [г/см 3 ], [мг/л ].
Масса вещества в граммах, содержащегося в одном кубическом сантиметре или одном миллилитре раствора, называется титром раствора.
Например, раствор с титром Т = 0,05, содержит 0,05 г растворенного вещества в 1 мл раствора.
5. Молярная концентрация.
Представляет собой отношение количества растворенного вещества (в молях) к объему раствора (в литрах).
Значение молярной концентрации показывает число молей растворенного вещества, содержащихся в растворе объемом 1 литр, имеет размерность [моль/л] и обозначается СМ:
где ν – количество растворенного вещества (в молях); V – объем раствора (в литрах).
Например, раствор серной кислоты с молярной концентрацией СM(H2SO4) = 2 моль/л содержит в объеме, равном 1 литру, серную кислоту количеством вещества 2 моль.
6. Нормальная концентрация.
В настоящее время чаще употребляется термин «молярная концентрация эквивалента». Этот способ выражения количественного состава растворов представляет собой отношение количества эквивалентов растворенного вещества (в молях) к объему раствора (в литрах).

Размерность нормальной концентрации [моль/л].
Например, раствор гидроксида бария с молярной концентрацией эквивалента С( 1 /2 ВаCl2) = 4 моль/л (нормальной концентрацией СH(ВаCl2) = 4 моль/л) содержит четыре моль эквивалентов ВаСl2 в растворе объемом 1 литр.
Моляльность раствора характеризуется количеством растворенного вещества в молях, приходящихся на 1кг растворителя в данном растворе.
Размерность моляльности [моль/кг растворителя].
Наконец, характеризуя количественный состав системы, можно говорить об отношениях массы (или объема или количеств вещества) компонента к массе (или объему или количеству вещества) всей системы. В этом случае мы имеем дело с отношением, которое может быть, соответственно: массовым, объемным или молярным.
Например, если объемное отношение концентрированной серной кислоты и воды может быть равно:
то это значит, что для приготовления данного раствора необходимо к 1 объему концентрированной серной кислоты добавить 2 объема воды.
При решении задач на смешивание растворов одного и того же вещества или при решении задач на разбавление более концентрированных растворов более разбавленными растворами или водой удобно пользоваться «правилом смешения растворов» (квадратом Пирсона):
раствор с большей массовой долей
масса раствора с большей массовой долей
раствор с меньшей массовой долей
масса раствора с меньшей массовой долей

раствор с требуемой

В случае разбавления раствора с большей массовой долей растворенного вещества водой значение массовой доли более разбавленного раствора (в данном случае воды) принимается равным нулю (ω2 = 0).
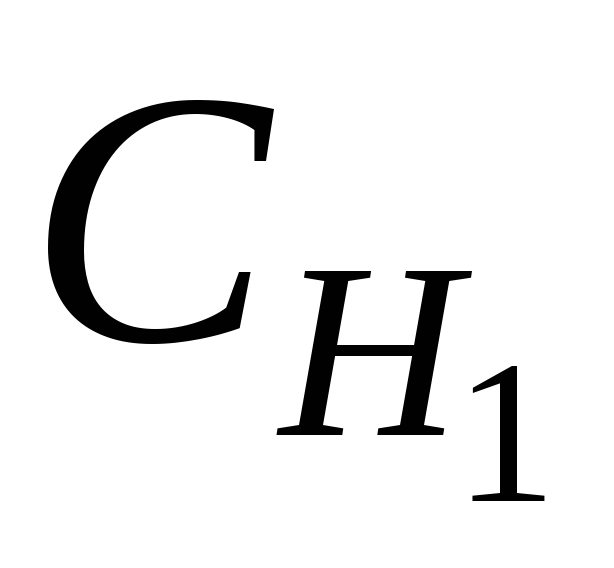
Для практического определения концентрации растворов удобно пользоваться методом титрования. Для расчетов с цель нахождения неизвестной концентрации раствора при использовании этого метода применяют так называемый закон эквивалентов для растворов:
произведение нормальной концентрации одного раствора на его объем равно произведению нормальной концентрации другого раствора на его объем, или
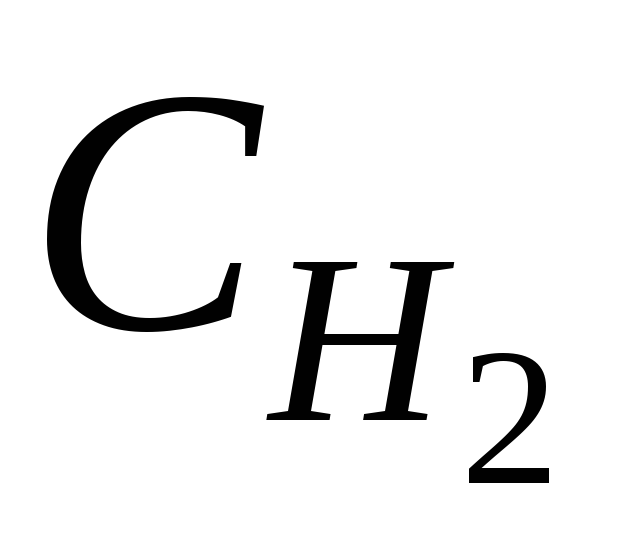

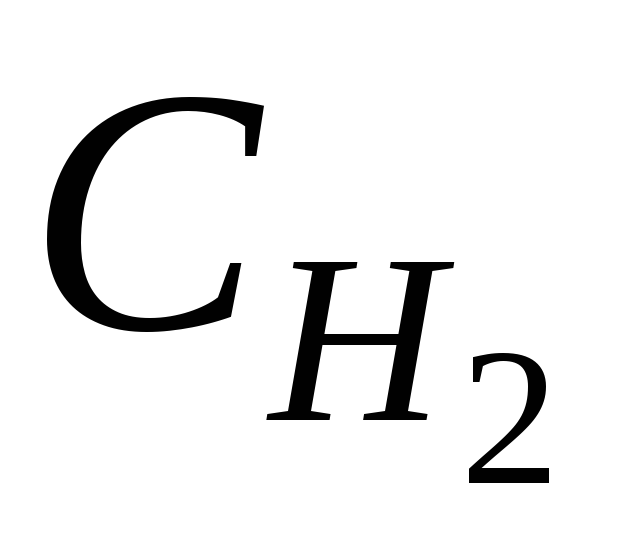
7.1. Вопросы для самоконтроля.
1. Дайте определение понятию «дисперсная система».
2. Как подразделяются все дисперсные системы в зависимости от размера частиц?
3. Какие дисперсные системы называются суспензиями?
4. Какие дисперсные системы называются эмульсиями?
5. Дайте определение понятию «раствор».
6. Какой компонент раствора считают растворенным веществом?
7. Какие растворы считаются истинными?
8. Что такое кристаллизация?
9. Что такое коэффициент растворимости?
10. Что такое насыщенный раствор?
11. Какие растворы называются ненасыщенными? Как можно получить насыщенный раствор из ненасыщенного раствора?
12. Что такое пересыщенные растворы? Как можно их получить?
13. Как подразделяются все вещества по растворимости?
14. От каких факторов зависит растворимость веществ?
15. Какие способы используют для выражения количественного состава растворов?
16. Что такое концентрированный и что такое разбавленный раствор? В каких случаях употребляются эти понятия?
17. Что такое массовая доля, молярная (мольная) доля, объемная доля растворенного вещества? Есть ли размерность у этих величин?
18. Дайте определение понятию «массовая концентрация».
19. Что такое «молярная концентрация»?
20. Что такое «нормальная концентрация»?
21. Как определяется молярная масса эквивалента для:
21. Дайте определение понятию «моляльность».
22. Какую лабораторную посуду следует использовать для приготовления растворов заданной концентрации?
23. Какой закон используется при расчетах результатов титрования?
7.2. Вопросы и упражнения для самоподготовки.
1. Укажите номер или сумму условных номеров, под которыми расположены вещества, при смешивании умеренного количества которых с водой образуется дисперсная система, называемая суспензией:
1) негашеная известь,
2. Укажите номер или сумму условных номеров, под которыми расположены вещества, при смешивании умеренного количества которых с водой образуется дисперсная система, называемая эмульсией:
4) порошок гашеной извести,
3. Укажите номер или сумму условных номеров, под которыми расположены вещества, при смешивании умеренного количества которых с водой образуется истинный раствор:
1) хлорид серебра,
4) порошок алюминия,
4. Под каким номером указано название дисперсной системы, образующейся при смешивании умеренного количества бензина с водой?
2) истинный раствор,
5. Под каким номером указано название дисперсной системы, образующейся при смешивании умеренного количества сульфата кальция с водой?
2) истинный раствор,
6. Под каким номером указано название дисперсной системы, представителем которой является известковая вода?
2) истинный раствор,
7. Под каким номером указано название дисперсной системы, которой является известковое молоко?
2) истинный раствор,
8. Укажите номер или сумму условных номеров, под которыми расположены справедливые утверждения:
1) насыщенный раствор может быть концентрированным,
2) насыщенный раствор может быть разбавленным,
4) насыщенный раствор может быть только концентрированным,
8) насыщенный раствор не может быть разбавленным.
9. Укажите номер или сумму условных номеров, под которыми расположены вещества, хорошо растворимые в воде:
1) метан, 2) оксид железа (III), 4) аммиак, 8) хлорид калия,
16) гидроксид бария, 32) сульфид меди (II).
10. Укажите номер, под которым расположено утверждение, справедливое для теплового эффекта процесса растворения твердых тел:
1) теплота всегда выделяется,
2) теплота всегда поглощается,
4) теплота может или выделяться, или поглощаться,
8) процесс не связан с тепловыми эффектами.
11. Хлорид натрия массой 5 г растворили в воде массой 45 г. Чему равна массовая доля в процентах хлорида натрия в этом растворе?
12. Чему равно значение объемной доли метана в смеси, содержащей 224 л метана (н.у.) и 30 моль пропана?
13. Найти массу в граммах хлорида цинка, необходимого для приготовления 150 г раствора этой соли с массовой долей растворенного вещества 12 %.
14. Какова масса воды, содержащейся в 200 г раствора хлорида натрия c массовой долей растворенного вещества 20 %?
15. Хлорид цинка массой 9 г растворили в воде массой 11 г. Вычислить массовую долю в процентах хлорида цинка в этом растворе.
16. Найти массовую долю в процентах азотной кислоты в растворе, в 1 литре которого содержится эта кислота массой 224 г. Плотность раствора кислоты равна 1,12 г/мл.
17. Найти массу в граммах гидроксида калия, необходимого для приготовления раствора массой 120 г с массовой долей растворенного вещества 20 %.
18. Чему равна масса воды, содержащейся в растворе серной кислоты массой 150 г с массовой долей растворенного вещества 48 %?
19. Какую массу в граммах FeCl3·6H2O надо взять, чтобы приго-товить раствор объемом 1 л, содержащий 0,1 моль хлорида железа (III)?
20. Сколько граммов кристаллогидрата CuSO4·5H2O надо взять, чтобы приготовить 1 л раствора, содержащего 0,1 моль сульфата меди?
21. Сколько граммов кристаллогидрата CrCl3·6H2O надо взять, чтобы приготовить 1 л раствора, содержащего 0,2 моль хлорида хрома (III)? Ответ округлите до целого числа.
22. Найти массу в граммах нитрата калия, содержащегося в растворe этой соли массой 0,7 кг c массовой долей растворенного вещества 7 %.
23. При выпаривании водного раствора некоторой соли массой 20 г было получена эта соль массой 4 г. Вычислите массовую долю, в процентах, соли в исходном растворе.
24. Какой объем воды в мл следует добавить к 100 мл раствора с массовой долей 20 % и плотностью 1,4 г/мл, чтобы получился раствор с массовой долей 7 %?
25. Какой объем воды в мл надо добавить к раствору массой 50 г с массовой долей 10 %, чтобы получился раствор с массовой долей 5 %?
26. Чему равна масса соли в граммах, которая образуется при пропускании хлороводорода объемом 56 л (н.у.) через раствор, содержащий гидроксид натрия массой 80 г?
27. При взаимодействии раствора серной кислоты массой 16 г с избытком раствора хлорида бария выделился осадок массой 5,7 г. Определите массовую долю серной кислоты (в процентах) в исходном растворе. Ответ округлите до целого числа.
28. Какое количество вещества серной кислоты в молях содержится в растворе объемом 1 литр, если 10 мл такого раствора нейтрализуют гидроксид натрия массой 4 г?
29. Какой объем в литрах раствора гидроксида натрия с массовой долей 2,5% (плотность 1,03 г/мл) можно приготовить из раствора NaOH объемом 800 мл c массовой долей 35% и плотностью 1,38 г/мл? Ответ округлите до целого числа.
30. Какой объем воды в мл необходимо добавить к раствору массой 100 г с массовой долей 10%, чтобы получился раствор с массовой долей 5%?
31. Какую массу раствора азотной кислоты c массовой долей 40 % нужно прибавить к раствору азотной кислоты массой 120 г с массовой долей 5%, чтобы образовался раствор кислоты с массовой долей 20%?
32. Какой объем воды в мл надо добавить к раствору объемом 200
мл с массовой долей 30 % и плотностью 1,4 г/мл, чтобы получился раствор с массовой долей 10 %?
33. Определите массовую долю в процентах раствора, полученного при сливании раствора массой 30 г c массовой долей 10 % и раствора массой 70 г с массовой долей растворенного вещества 20 %.
34. Воду какого объема в литрах нужно прибавить к раствору массой 1 кг и массовой долей растворенного вещества 50%, чтобы получить раствор с массовой долей 10%?
35. Какое количество вещества серной кислоты в молях содержится в литре раствора серной кислоты с массовой долей 59,24 % и плотностью 1,49 г/мл? Ответ округлите до целого числа.
36. Какой объем серной кислоты в мл с массовой долей 60% и плотностью 1,50 г/мл необходимо взять для приготовления раствора объемом 5 литров с массовой долей 12% и плотностью 1,08 г/мл?
37. Сожгли серу массой 3,2 г. Продукты сгорания окислили и растворили в воде. Масса раствора оказалась равной 0,98 кг. Какова массовая доля в процентах кислоты в полученном растворе?
38. При пропускании избытка сероводорода через раствор хлорида меди (II) массой 33,75 г, образовался осадок массой 2,4 г. Вычислите массовую долю в процентах хлорида меди в исходном растворе.
39. Вычислите массу в граммах раствора азотной кислоты с массовой долей 63%, которую можно получить из нитрата натрия массой 170 г.
40. Какую массу технического цинка (в граммах), содержащего 4 % примесей, необходимо израсходовать при взаимодействии с соляной кислотой для получения раствора хлорида цинка массой 0,9 кг с массовой долей 8%? Ответ округлите до целого числа.
41. Какой объем раствора серной кислоты (в мл) с массовой долей 76,1% и плотностью 1,64 г/мл необходимо взять для приготовления 1л раствора этой кислоты с массовой долей 6 % и плотностью 1,04 г/мл? Ответ округлите до целого числа и дайте в миллилитрах.
42. В каком объеме воды в мл нужно растворить хлороводород объемом 44,8 л (н.у.), чтобы получить раствор соляной кислоты с массовой долей 14,6%?
Источник