- Методы получения коллоидных растворов
- Коллоидные растворы: методы получения и использование
- Общая характеристика
- Свойства коллоидных растворов
- Структура мицелл
- Как происходит образование мицеллы
- Стабильность
- Скорость коагуляции
- Коагуляция коллоидных растворов с помощью электролитов
- Способы получения
- Солюбилизация
- Повсеместное распространение
- Использование в медицине
- Применение в быту и промышленности
Методы получения коллоидных растворов
Коллоидные растворы по размерам частиц занимают промежуточное положение между грубодисперсными и истинными. Поэтому выделяют две группы методов их получения:
1) дисперсионные (дробление грубодисперсных частиц до частиц коллоидной степени дисперсности);
2) конденсационные (укрупнение частиц истинных растворов в агрегаты коллоидных систем).
Эти группы методов, в свою очередь, делятся на физические и химические.
Самым распространённым из дисперсных химических методов получения золей является метод пептизации (процесс перевода осадка (гидроксида металла) в коллоидный раствор под действием диспергирующих средств).
В качестве пептизатора используют хорошо растворимую соль соответствующего металла. Например, мицелла золя гидроксида железа (III) Fe(OH)3 получается в присутствии пептизатора FeCl3 –сильного электролита:
nFeCl3 ↔ n Fe 3+ + 3nCl —
ядро адсорбционный слой диффузионный слой
гранула
мицелла
К конденсационным химическим методам относят:
1) метод обменной реакции, в ходе которой получается нерастворимое вещество, причём одно исходное вещество должно быть в избытке:
AgNО3 + KI → AgI ↓ + KNО3
nAgNО3 ↔ nAg + + n NO3‾
ядро адсорбционный слой дифф. слой
2) метод гидролиза, в результате которого получается нерастворимое соединение.
Fe(OH)3 + HCl → FeОCl + 2H2O
Продукт этой реакции – хлорокись железа(III) может диссоциировать и стабилизировать мицеллообразование.
FeOCl ↔ FeO + +Сl‾
3) метод окислительно-восстановительных реакций
5.4.Свойства коллоидных растворов
1. Молекулярно-кинетические свойства, общие для истинных и коллоидных растворов: осмос, осмотическое давление, диффузия, броуновское движение.
Но в коллоидных растворах эти процессы идут медленнее.
2. Оптические свойства – это специфические свойства, присущие только коллоидным растворам.
a) опалесценция — это явление рассеяния проходящего через коллоидный раствор света с изменением окраски золя.
b) эффект Фарадея-Тиндаля — явление изменения формы пучка проходящего через раствор света на конусовидную.
3. Электрические свойства
a) электрофорез — явление перемещения частиц дисперсной фазы в электрическом поле;
b) электроосмос — это явление перемещения частиц дисперсионной среды (растворителя) относительно неподвижной дисперсной фазы. Например, течение жидкости через капиллярные системы под влиянием разности потенциалов.
На этих свойствах основаны методы введения лекарственных препаратов через кожу.
4. Электрокинетические свойства характеризуют возникающие в мицелле потенциалы.
a) электротермодинамический (Е) потенциал — возникает на границе ядра и слоя потенциалопределяющих ионов. Величина этого потенциала постоянна и зависит от числа потенциалопределяющих ионов, у многих коллоидных растворов она достигает 1В.
b) электрокинетический ζ, (дзетта) потенциал — возникает на границе адсорбционного и диффузионного слоев. Величина ζ — потенциала пропорциональна числу ионов диффузионного слоя и ионной силе раствора.
Концентрация противоионов в диффузионном слое убывает от центра к периферии, ζ-потенциалв этом направлениитак же падает до нуля. Если все противоионы перейдут в адсорбционный слой, то ζ-потенциал станет равен 0.
Состояние системы, когда общий заряд её равен нулю, называется изоэлектрическим состоянием.
Коллоидные растворы являются термодинамически неустойчивыми.
Источник
Коллоидные растворы: методы получения и использование
Многие люди, не имеющие дело с химией, слыша словосочетание «коллоидные растворы», представляют что-то наподобие геля, вязкой смеси. Дело в том, что изначально такое название произошло от греческого слова, в переводе означающего «клеевидные». При нарушении сбалансированности системы золи дают осадок, напоминающий студень.
Как правило, коллоидные растворы представляют собой абсолютно прозрачную жидкость. В зависимости от состава, она может быть бесцветной или окрашенной. На первый взгляд золи ничем не отличаются от истинных растворов. Изучением подобного рода субстанций занимается целый раздел – коллоидная химия.
Общая характеристика
Любой раствор представляет собой однофазную систему, включающую два компонента или более. В отличие от него, суспензия или эмульсия менее устойчивы. В жидких растворах при хранении может выпасть осадок, если, например, они помещены в негерметично закрытую тару и происходит испарение жидкости. В остальных случаях это инертная система, где компоненты не вступают в реакцию друг с другом, и поэтому она может оставаться неизменной в течение длительного времени.
Свойства коллоидных растворов
Молекулы вещества равномерно распределяются по всему растворителю, однако они постоянно совершают броуновское (колебательное) движение. Вследствие этого происходит полное перемешивание компонентов системы. Свойства коллоидных растворов в данном процессе немного другие. Частицы такой системы называются мицеллами. Они диффундируют из одного слоя жидкости в другой медленнее (в 100 раз). Причиной низкой скорости является больший объем мицелл по сравнению с молекулами истинных растворов.
В зависимости от размера частиц, их количества, коллоидные растворы отличаются по вязкости. Часто встречаются системы, переходящие в гелеобразное состояние при понижении температуры. Наличие слишком крупных мицелл и превышение предела растворимости приводит к помутнению.
Частицы коллоида, в отличие от молекул, имеют более крупные размеры и поэтому способны рассеивать свет. Таким образом, можно отличить эти растворы от истинных. При прохождении через такую систему пучок света будет виден.
Структура мицелл
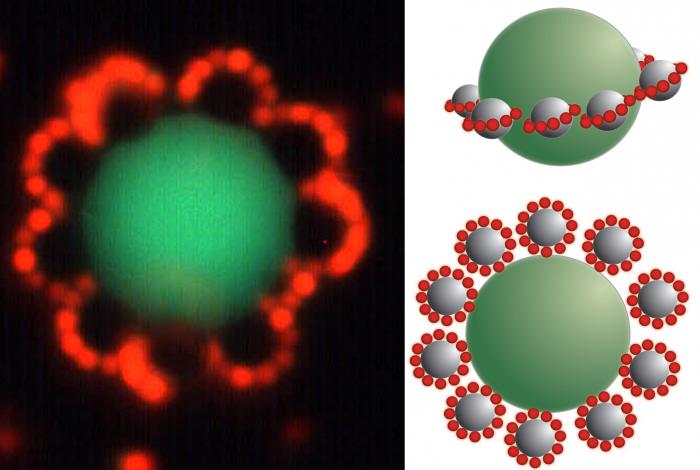
Получение коллоидных растворов зиждется на образовании мицелл, которые должны пребывать для сохранения свойств системы в стабильном состоянии. Частица имеет сложную структуру, состоит из ядра, которое образуется малорастворимым веществом. Вокруг него распределяется слой потенциалоопределяющих ионов. Обычно они являются такими же, что и в малорастворимом веществе, расположенном в центре мицеллы (правило Панета–Фаянса). Такие ионы определяют заряд ядра.
Например, при взаимодействии иодида калия и нитрата серебра образуются мицеллы. Ядром таких частиц является иодид серебра (AgI). Если преобладает второй компонент, то потенциалоопределяющими ионами будут Ag + , если первый — I — . Следующим слоем являются противоионы того вещества, которое было взято в избытке. Они образуют две зоны. Первая расположена близко к поверхности ядра, входит в состав адсорбированного слоя. Вторая входит в состав диффузионного слоя, состоит из ионов, свободно перемещающихся вблизи поверхности.
Коллоидной частицей называется ядро с адсорбированным слоем, который включает потенциалопределяющие ионы и противоионы. Данное образование имеет заряд. Мицелла включает коллоидную частицу и диффузионный слой противоионов и является нейтральной.
Как происходит образование мицеллы
Любые методы получения коллоидных растворов основаны на взаимодействии молекул труднорастворимого соединения с электролитом. Например, AgNO3 (нитрат серебра) с KI (иодидом калия). В результате реакции получается AgI и KNO3 (нитрат калия). Структуру мицеллы можно изобразить схематически. Есть 2 варианта образования коллоидных частиц из вышеуказанных соединений:
Вначале указывается ядро, потом потенциалоопределяющие ионы и противоионы адсорбированного и диффузионного слоя. Электрокинетический потенциал, который определяет заряд коллоидной частицы, обозначается буквой «x». Он возникает в силу разницы поверхностной энергии ядра частицы с потенциалоопределяющими ионами.
Стабильность
Коллоидные растворы способны сохраняться в неизменном состоянии достаточно долго. Стабильность таких систем является следствием одноименности зарядов мицелл, что приводит к их отталкиванию друг от друга. Однако при слишком больших размерах и высокой концентрации частицы могут сталкиваться и объединяться. Устойчивость коллоидных растворов – относительное понятие. Они могут храниться в неизменном состоянии достаточно долго.
Коагуляция коллоидных растворов представляет собой процесс слипания мицелл друг с другом. При стабильном состоянии системы данное явление происходит медленно, что позволяет ей сохраняться длительное (до 100 лет) время в однофазном состоянии. Такое явление получило название агрегативная неустойчивость.
Скорость коагуляции
Скорость агрегации частиц и, как следствие, разделения фаз зависит от многих факторов, в том числе от размера и концентрации мицелл, температуры хранения. К ускорению процесса коагуляции приводит добавление электролита. Данное явление наблюдается в гидрофильных системах. Известны методы замедления процесса агрегации частиц. Например, смешение липофильного коллоида с гидрофильным. На утрату стабильного состояния золей может повлиять нагрев или охлаждение, механическое воздействие.
Коагуляция коллоидных растворов с помощью электролитов
Существуют определенные закономерности влияния электролитов на коллоидный раствор. Так, для начала процесса нужна определенная концентрация последнего, не ниже определенного уровня — порог коагуляции. Электролит – вещество, способное проводить электрический ток в результате диссоциации в растворе или расплава на ионы. На состояние коллоидного раствора влияет ион, заряд которого противоположен таковому у мицеллы. Действие усиливается со степенью заряда (правило Шульце-Гарди).
Другой фактор, определяющий степень влияния ионов, – их гидратируемость. Частицы с одноименным зарядом оказывают разный уровень действия на процесс коагуляции. При разделении коллоидного раствора ионы, вызвавшие коагуляцию, присутствуют в осадке. При добавлении смеси электролитов ее компоненты могут ослаблять действие друг друга (антагонизм) или, наоборот, усиливать (синергизм). Реже наблюдается независимое (аддитивное) влияние.
Способы получения
Методы получения коллоидных растворов сводятся к двум. Одним из вариантов является диспергирование (измельчение) крупных частиц до размеров, соответствующих коллоидным. Такой процесс можно осуществлять, например, с использованием ультразвуковых приборов (механическое измельчение). Разновидностью дисперсных методов является формирование коллоидных частиц в результате добавления электролитов, которые адсорбируются на поверхности коллоидных ядер и переводят частицы в растворенное состояние.
Противоположным дисперсионному методу является конденсационный, заключающийся в агрегации мелких частиц в более крупные. Такое явление происходит, например, при замене растворителя. Каким образом можно добиться такого эффекта? Наблюдается резкое снижение растворимости в силу изменения среды. Далее вещество образует коллоидную частицу. В ее формировании участвуют молекулы растворителя, с которым оно лучше смешивается. Такой эффект, например, достигается при постепенном добавлении канифоли, растворенной в этаноле, к воде.
Различного рода конденсационные реакции, в том числе описанные выше, также относятся к методам агрегации. Другими примерами может являться гидролиз солей металлов, в частности хлорида железа (FeCl3), реакция нейтрализации в результате взаимодействия гидроксида бария (Ba(OH)2) с серной кислотой (H2SO4).
Солюбилизация
Значение коллоидных растворов в жизни человека велико в связи со способностью поверхностно-активных веществ повышать растворение гидрофобных соединений в воде. Такое явление получило название «солюбилизация». По своей сути данный процесс представляет растворение соединений в мицеллах. Благодаря этому явлению порошки способны удалять загрязнение с тканей, получаются устойчивые эмульсии углеводородов и красителей в воде.
Солюбилизация может проходить разными способами. Так, неполярные углеводороды проникают в ядро мицеллы, в то время как соединения, имеющие гидрофильную и гидрофобную часть (амины, спирты), встраиваются так, что первая находится снаружи, а вторая уходит вглубь коллоидной частицы. Существует также такое явление, как обратная солюбилизация, заключающаяся в растворении воды в маслах. В случае неионогенных ПАВов выделяют еще один способ повышения растворимости гидрофобных соединений – прикрепление к поверхности мицеллы посредством химических связей (водородных в частности).
Повсеместное распространение
Коллоидные растворы присутствуют неизменно внутри человека и вокруг него. К ним относятся кровь, лимфа, часто используемые в различных строительных и отделочных работах клеи и краски. Из коллоидных растворов в результате коагуляции и осаждения получают гели. К таковым можно, например, отнести холодец, мармелад, агар-агар, желатин, каррагинаны. Последние используются для улучшения структуры продуктов, в частности паштетов. Везде в организме человека присутствуют коллоидные растворы, обогащенные белками.
Использование в медицине
В медицине коллоидные растворы применяются повсеместно. Вот несколько примеров их использования. Коллоидное серебро, представляющее собой мелкие частицы металла, диспергированные в воде, применяется при лечении ожогов, язвенных болезней желудка и двенадцатиперстной кишки, для промывания слизистой носа в целях предотвращения распространения вирусных инфекций.
Фармацевтическая промышленность предлагает большой выбор коллоидных растворов для различных целей. Среди них встречают универсальные средства, которые можно применять как ранозаживляющие при ожогах, геморрое; противовоспалительные – при насморке, ангине, гайморите; анальгетики – для снятия зубной боли и не только. К таковым относится коллоидный раствор «Миллениум». В состав геля входит алоэ, белок пшеницы, женьшень, витамин Е и прочие полезные добавки. Многие фармацевтические средства для наружного применения на самом деле являют собой коллоидный раствор. Для суставов, например, используется «Артро Комплекс», содержащий такой полезный компонент, как акулий хрящ.
Применение в быту и промышленности
Коллоидные растворы составляют основу моющих и чистящих ПАВов. Загрязнения проникают внутрь мицеллы и таким образом удаляются с поверхности.
Другой важный аспект применения мицеллообразующих ПАВов – производство полимеров, в частности латексов, поливинилового спирта, клеев растительного происхождения. Различные пластмассы, кожзаменители получены на основе эмульсии. ПАВы применяются также при очистке сточных вод и питьевой воды.
Преимущества косметики на основе коллоидных растворов заключаются в проникновении действующих веществ через кожные покровы человека и структуру волос. Такие средства эффективно используются против старения. К ним относится, в частности, гель «Миллениум Нео». Коллоидный раствор помогает содержащимся в нем компонентам достичь глубоких слоев кожи, минуя эпидермис.
Источник