Методы получения коллоидных растворов
Коллоидные растворы по размерам частиц занимают промежуточное положение между грубодисперсными и истинными. Поэтому выделяют две группы методов их получения:
1) дисперсионные (дробление грубодисперсных частиц до частиц коллоидной степени дисперсности);
2) конденсационные (укрупнение частиц истинных растворов в агрегаты коллоидных систем).
Эти группы методов, в свою очередь, делятся на физические и химические.
Самым распространённым из дисперсных химических методов получения золей является метод пептизации (процесс перевода осадка (гидроксида металла) в коллоидный раствор под действием диспергирующих средств).
В качестве пептизатора используют хорошо растворимую соль соответствующего металла. Например, мицелла золя гидроксида железа (III) Fe(OH)3 получается в присутствии пептизатора FeCl3 –сильного электролита:
nFeCl3 ↔ n Fe 3+ + 3nCl —
ядро адсорбционный слой диффузионный слой
гранула
мицелла
К конденсационным химическим методам относят:
1) метод обменной реакции, в ходе которой получается нерастворимое вещество, причём одно исходное вещество должно быть в избытке:
AgNО3 + KI → AgI ↓ + KNО3
nAgNО3 ↔ nAg + + n NO3‾
ядро адсорбционный слой дифф. слой
2) метод гидролиза, в результате которого получается нерастворимое соединение.
Fe(OH)3 + HCl → FeОCl + 2H2O
Продукт этой реакции – хлорокись железа(III) может диссоциировать и стабилизировать мицеллообразование.
FeOCl ↔ FeO + +Сl‾
3) метод окислительно-восстановительных реакций
5.4.Свойства коллоидных растворов
1. Молекулярно-кинетические свойства, общие для истинных и коллоидных растворов: осмос, осмотическое давление, диффузия, броуновское движение.
Но в коллоидных растворах эти процессы идут медленнее.
2. Оптические свойства – это специфические свойства, присущие только коллоидным растворам.
a) опалесценция — это явление рассеяния проходящего через коллоидный раствор света с изменением окраски золя.
b) эффект Фарадея-Тиндаля — явление изменения формы пучка проходящего через раствор света на конусовидную.
3. Электрические свойства
a) электрофорез — явление перемещения частиц дисперсной фазы в электрическом поле;
b) электроосмос — это явление перемещения частиц дисперсионной среды (растворителя) относительно неподвижной дисперсной фазы. Например, течение жидкости через капиллярные системы под влиянием разности потенциалов.
На этих свойствах основаны методы введения лекарственных препаратов через кожу.
4. Электрокинетические свойства характеризуют возникающие в мицелле потенциалы.
a) электротермодинамический (Е) потенциал — возникает на границе ядра и слоя потенциалопределяющих ионов. Величина этого потенциала постоянна и зависит от числа потенциалопределяющих ионов, у многих коллоидных растворов она достигает 1В.
b) электрокинетический ζ, (дзетта) потенциал — возникает на границе адсорбционного и диффузионного слоев. Величина ζ — потенциала пропорциональна числу ионов диффузионного слоя и ионной силе раствора.
Концентрация противоионов в диффузионном слое убывает от центра к периферии, ζ-потенциалв этом направлениитак же падает до нуля. Если все противоионы перейдут в адсорбционный слой, то ζ-потенциал станет равен 0.
Состояние системы, когда общий заряд её равен нулю, называется изоэлектрическим состоянием.
Коллоидные растворы являются термодинамически неустойчивыми.
Источник
Урок №13. Коллоидные растворы
Посмотрите видео — фильмы
Дисперсные системы
Чистые вещества в природе встречаются очень редко. Смеси разных веществ в различных агрегатных состояниях могут образовывать гетерогенные и гомогенные системы — дисперсные системы и растворы.
Дисперсными называют гетерогенные системы, в которых одно вещество в виде очень мелких частиц равномерно распределено в объеме другого.
То вещество, которое присутствует в меньшем количестве и распределено в объеме другого, называют дисперсной фазой . Она может состоять из нескольких веществ.
Вещество, присутствующее в большем количестве, в объеме которого распределена дисперсная фаза, называют дисперсионной средой . Между ней и частицами дисперсной фазы существует поверхность раздела, поэтому дисперсные системы называют гетерогенными (неоднородными).
И дисперсионную среду, и дисперсную фазу могут представлять вещества, находящиеся в различных агрегатных состояниях — твердом, жидком и газообразном.
В зависимости от сочетания агрегатного состояния дисперсионной среды и дисперсной фазы можно выделить 9 видов таких систем.
По величине частиц веществ, составляющих дисперсную фазу, дисперсные системы делят на грубодисперсные (взвеси) с размерами частиц более 100 нм (1 нм = 10 -9 м) и тонкодисперсные (коллоидные растворы или коллоидные системы) с размерами частиц от 100 до 1 нм. Если же вещество раздроблено до молекул или ионов размером менее 1 нм, образуется гомогенная система — раствор. Она однородна (гомогенна), поверхности раздела между частицами и средой нет.
Уже беглое знакомство с дисперсными системами и растворами показывает, насколько они важны в повседневной жизни и в природе.
Судите сами: без нильского ила не состоялась бы великая цивилизация Древнего Египта; без воды, воздуха, горных пород и минералов вообще бы не существовала живая планета — наш общий дом — Земля; без клеток не было бы живых организмов и т. д.
Классификация дисперсных систем и растворов
Взвеси
Взвеси — это дисперсные системы, в которых размер частиц фазы более 100 нм. Это непрозрачные системы, отдельные частицы которых можно заметить невооруженным глазом. Дисперсная фаза и дисперсионная среда легко разделяются отстаиванием. Такие системы разделяют на:
1) эмульсии (и среда, и фаза — нерастворимые друг в друге жидкости). Это хорошо известные вам молоко, лимфа, водоэмульсионные краски и т. д.;
2) суспензии (среда — жидкость, а фаза — нерастворимое в ней твердое вещество). Это строительные растворы (например, «известковое молоко» для побелки), взвешенный в воде речной и морской ил, живая взвесь микроскопических живых организмов в морской воде — планктон, которым питаются гиганты-киты, и т. д.;
3) аэрозоли — взвеси в газе (например, в воздухе) мелких частиц жидкостей или твердых веществ. Различают пыли, дымы, туманы. Первые два вида аэрозолей представляют собой взвеси твердых частиц в газе (более крупные частицы в пылях), последний — взвесь мелких капелек жидкости в газе. Например, природные аэрозоли: туман, грозовые тучи — взвесь в воздухе капелек воды, дым — мелких твердых частиц. А смог, висящий над крупнейшими городами мира, также аэрозоль с твердой и жидкой дисперсной фазой. Жители населенных пунктов вблизи цементных заводов страдают от всегда висящей в воздухе тончайшей цементной пыли, образующейся при размоле цементного сырья и продукта его обжига — клинкера. Аналогичные вредные аэрозоли — пыли — имеются и в городах с металлургическими производствами. Дым заводских труб, смоги, мельчайшие капельки слюны, вылетающие изо рта больного гриппом, также вредные аэрозоли.
Аэрозоли играют важную роль в природе, быту и производственной деятельности человека. Скопления облаков, обработка полей химикатами, нанесение лакокрасочных покрытий при помощи пульверизатора, распыление топлив, выработка сухих молочных продуктов, лечение дыхательных путей (ингаляция) — примеры тех явлений и процессов, где аэрозоли приносят пользу. Аэрозоли — туманы над морским прибоем, вблизи водопадов и фонтанов, возникающая в них радуга доставляет человеку радость, эстетическое удовольствие.
Для химии наибольшее значение имеют дисперсные системы, в которых средой является вода и жидкие растворы.
Природная вода всегда содержит растворенные вещества. Природные водные растворы участвуют в процессах почвообразования и снабжают растения питательными веществами. Сложные процессы жизнедеятельности, происходящие в организмах человека и животных, также протекают в растворах. Многие технологические процессы в химической и других отраслях промышленности, например получение кислот, металлов, бумаги, соды, удобрений, протекают в растворах.
Коллоидные системы
Коллоидные системы — это такие дисперсные системы, в которых размер частиц фазы от 100 до 1 нм. Эти частицы не видны невооруженным глазом, и дисперсная фаза и дисперсионная среда в таких системах отстаиванием разделяются с трудом.
Их подразделяют на золи (коллоидные растворы) и гели (студни).
1. Коллоидные растворы, или золи. Это большинство жидкостей живой клетки (цитоплазма, ядерный сок — кариоплазма, содержимое органоидов и вакуолей) и живого организма в целом (кровь, лимфа, тканевая жидкость, пищеварительные соки, гуморальные жидкости и т. д.). Такие системы образуют клеи, крахмал, белки, некоторые полимеры.
Коллоидные растворы могут быть получены в результате химических реакций; например, при взаимодействии растворов силикатов калия или натрия («растворимого стекла») с растворами кислот образуется коллоидный раствор кремниевой кислоты. Золь образуется и при гидролизе хлорида железа (Ш) в горячей воде. Коллоидные растворы внешне похожи на истинные растворы. Их отличают от последних по образующейся «светящейся дорожке» — конусу при пропускании через них луча света.
Источник
Методы получения коллоидных растворов



Методы получения и исследования дисперсных систем
Лекция 8
Для получения коллоидных растворов необходимо: 1) достичь коллоидной степени дисперсности; 2) подобрать дисперсионную среду, в которой нерастворимо вещество дисперсной фазы; 3) подобрать третий компонент — стабилизатор, сообщающий коллоидной системе устойчивость.
Образовывать коллоидные растворы в воде могут металлы, малорастворимые в ней оксиды, гидроксиды, кислоты, соли. Хорошо растворимые в воде вещества, но малорастворимые в неполярных органических растворителях не способны образовывать гидрозоли, но могут образовывать органозоли. Так, например, не возможно получить гидрозоль натрия хлорид, но возможно получение его коллоидного раствора в бензоле. И наоборот, можно легко получить гидрозоль камфоры, практически нерастворимой в воде, но невозможно получить ее коллоид в спирте, поскольку камфора хорошо растворима в этом растворителе.
В качестве стабилизаторов используют вещества, препятствующие агрегации коллоидных частиц в более крупные и выпадению их в осадок. Таким действием обладают: небольшой избыток одного из реагентов, из которых получается вещество дисперсной фазы, ПАВ, белки, полисахариды и др.
По размеру частиц дисперсной фазы коллоидные системы (d ≈10 -7 — 10 -9 м ) занимают промежуточное положение между микрогетерогенными (грубодисперсными) системами (d >10 -7 м ) и истинными растворами, (размер растворенных частиц d -9 м ) низкомолекулярных веществ. По способу достижения коллоидной степени дисперсности различают методы (рис. 12.1): диспергационные (от лат.disper-
| Грубодисперсная система | Коллоидно-дисперсная система | Истинный раствор |
| d>l(r 7 M | 10- 7 M10- 9 | d 9 M |
| ДИСПЕРГИРОВАНИЕ | КОНДЕНСИРОВАНИЕ |
Увеличение степени измельчения
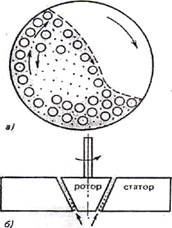
Рис.12.1 Способы достижения коллоидной степени дисперсности gire — измельчать) — получение частиц дисперсной фазы путем дробления более крупных частиц и конденсационные (от лат. condensire — укрупнять) — получение частиц дисперсной фазы путем объединения атомов, молекул, ионов
Методы диспергирования. Для измельчения жидкостей и твердых тел необходимо совершить работу. Эта работа тем больше, чем меньше размер частиц дисперсной фазы. Энергия, расходуемая при диспергировании, идет на преодоление молекулярных сил притяжения и на увеличение межфазной поверхности
Для достижения требуемой степени дисперсности применяют механическое дробление, ультразвуковое, электрическое и химическое диспергирование.
Механическое дробление осуществляют с помощью шаровых и коллоидных мельниц в присутствии жидкой дисперсионной среды и стабилизатора. Схема шаровой мельницы представлена на рис. 12.2, а. Шары измельчают материал дисперсной фазы при вращении за счет раздавливания, раскалывания и истирания.
Измельчение с помощью ультразвука происходит под действием источника ультразвуковых колебаний на смесь нерастворимых друг в друге жидкостей или твердого тела с жидкостью.
Электрическое диспергирование используют для получения золей металлов. К электродам, изготовленным из диспергируемого металла и опущенным в подщелоченную воду, подводят постоянный электрический ток и сближают электроды до образования электрической дуги. Металл, из которого изготовлены электроды, при этом превращается в пар, конденсирующийся в жидкой среде в золь. При получении органозолей (дисперсионная среда органический растворитель) применяют высокочастотный искровой заряд.
Химическое диспергирование, или пептизация, заключается в химическом воздействии на осадок.
Конденсационные методы. Взаимодействие ионов и молекул с образованием частиц коллоидных размеров может быть достигнута физическими и химическими методами.
Физическая конденсация имеет в своей основе физические методы воздействия. Чаще всего для получения золей используют метод замены растворителя. Вначале готовят истинный раствор вещества в летучем растворителе (например, канифоли в спирте) и добавляют к жидкости, в которой вещество нерастворимо (например, к воде). Летучий растворитель удаляют нагреванием. В результате происходит резкое понижение растворимости. Молекулы вещества конденсируются в частицы коллоидных размеров и образуется коллоидный раствор.

При химической конденсации для получения коллоидных растворов используют любые реакции, в результате которых образуются труднорастворимые соединения:
Источник








