Окраска спор у бактерий
Вводные пояснения. Споры бактерий по сравнению с вегетативными клетками обладают высокой устойчивостью к неблагоприятным условиям внешней среды. Они представляют собой округлые, овальные или эллипсовидные образования. Если диаметр споры не превышает диаметра клетки, в которой спора образуется, клетку называют бациллярной, если превышает, то в зависимости от расположения споры в центре или на конце клетки эту клетку называют соответственно клостридиальной или плектридиальной.. В бациллярной клетке спора может размешаться в центре клетки — центральное положение, на конце — терминальное и ближе к одному из концов — субтерминальное положение.
При наблюдении за живыми спорообразующими бактериями их споры можно различить по более сильному преломлению световых лучей. Споры кислотоустойчивы, поэтому с трудом окрашиваются красителями. Объясняется это большой плотностью оболочки, низкой концентрацией в ней свободной воды и высоким содержанием липидов в спорах. В препаратах, окрашенных простыми способами или по Граму, споры остаются бесцветными (негативная окраска).
В связи с особенностями физико-химического состава и плотной малопроницаемой оболочкой на первом этапе окраски спор применяют химические вещества, изменяющие структуру их оболочки. Однако при последующем прокрашивании споры одновременно прокрашивается и цитоплазма клетки, поэтому под микроскопом последняя выглядит однородно окрашенной. Для того чтобы на препарате оставались прокрашенными только споры, следует такой «перекрашенный» препарат частично обесцветить, забирая краситель у цитоплазмы и оставляя его в споре. Этого достигнуть нетрудно, так как краситель, адсорбированный спорой, удерживается прочнее, чем поглощенный цитоплазмой клетки.
Таким образом, все способы окраски спор основаны на едином принципе: сначала споры протравливают различными веществами: хромовой, соляной, серной, уксусной кислотами, аммиаком, едким натром или перекисью водорода, затем окрашивают клетку со спорой при нагревании и, наконец, обесцвечивают цитоплазму и дополнительно окрашивают ее контрастным красителем.
Метод Циля—Нильсена в модификации Мюллера. Мюллер, модифицировав известный метод Циля—Нильсена, применяемый обычно для выявления кислотоустойчивости бактерий (дифференциальной окраски микобактерий и некоторых близких к ним микроорганизмов), снизанной с особенностями химического состава их оболочки, предложил использовать его для окраски спор бактерий.
До фиксации мажа бактерий на пламени препарат готовят обычным способом (см. 2.2.1). Далее на фиксированный в пламени и остывший препарат наносят 5%-ный раствор хромовой кислоты. Через 5—10 мин ее смывают водой. Препарат накрывают полоской фильтровальной бумаги и обильно смачивают бумагу карболовым фуксином Циля. Подогревают препарат над пламенем до появления паров (не до кипения), затем отводят его в сторону и добавляют новую порцию красителя. Эту процедуру проводят в течение 7 мин. Важно, чтобы краситель испарялся, но бумага не подсыхала. После охлаждения ее снимают, препарат промывают водой и тщательно промокают фильтровальной бумагой. В результате такой обработки клетки со спорами равномерно прокрашиваются.
Далее обесцвечивают цитоплазму клеток (но не споры), обрабатывая 1%-ным раствором соляной или серной кислот в течение 15—30 с. При приготовлении препарата спор Bacillus mycoides или Bacillus mesentericus рекомендуется обесцвечивать цитоплазму 16—18 с (размеренно считая вслух от 21 до 37—40). При превышении этого времени могут обесцветиться и споры. Затем препарат промывают водой и окрашивают метиленовым синим 2 мин.
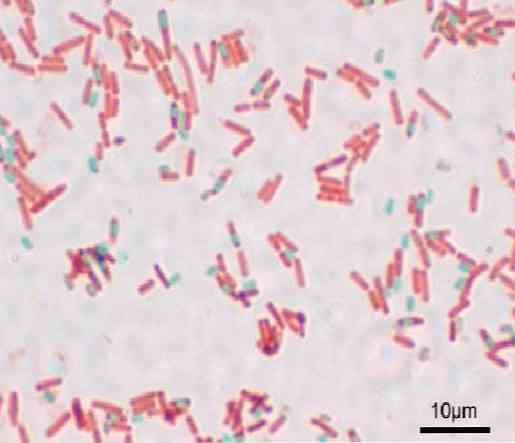
Если все операции проделаны правильно, окраска получается контрастной и ярко-красные споры четко выделяются на голубом фоне цитоплазмы.
Метод Пешкова. На фиксированный в пламени препарат наливают метиленовый синий Леффлера, доводят его до кипения и кипятят 15—20 с, держа стекло над пламенем. Мазок промывают водой и докрашивают в течение 30 с 0,5%-ным водным раствором нейтрального красного. Еще раз промывают, подсушивают и далее исследуют препарат с масляной иммерсией объектива. Споры окрашиваются в голубой или синий цвета, цитоплазма — в розовый.
Для исследования спор удобными объектами могут служить Bacillus mesentericus или Bacillus mycoides в возрасте 4 сут.
Реактивы для окрашивания спор бактерий.
1. Карболовый фуксин Циля (см. 3.2.2).
2. Метиленовый синий Леффлера (см. 3.2.2).
3. Насыщенный водный раствор метиленового синего 2 г красителя и 100 мл дистиллированной воды.
4. Хромовая кислота, 5%-ный раствор.
5. Соляная (или серная) кислота, 1%-ный раствор.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Источник
6.5. Окраска спор микробов
Споры имеют вид образований круглой или овальной формы, находящихся в теле микробной клетки. Различают три | вида расположения спор по отношению к длинной оси палочки: центральное – спора находится в центре тела микроба, субтерминальное – спора располагается ближе к одному из ее концов, терминальное – спора располагается на конце палочки. Диаметр споры может не превышать диаметр тела микробной клетки, вследствие чего форма палочки при спорообразовании не изменяется (бациллы). В других случаях диаметр споры больше поперечного размера микробной клетки и тело ее в месте образования споры утолщается (клостридии).
Форма, величина «расположение спор постоянны для каждого вида бацилл.
В отличие от вегетативной части клетки, споры содержат значительно меньше свободной воды и большое количество липидов и кальция. Плотная оболочка спор, непроницаемая для воды, окрашивается с большим трудом, поэтому при обычных методах окраски споры имеют вид неокрашенных пустот внутри клетки. Для окраски спор пользуются специальными методами с применением протрав (кислоты или щелочи). Протравы разрыхляют оболочку споры, облегчая проникновение в нее красителя. Окрасившиеся споры обладают кислотоустойчивостью, в отличие от вегетативного тела микробной клетки, обесцвечивающегося под действием кислоты. Поэтому принцип окраски спор и кислотоустойчивых бактерий одинаков: препарат окрашивают основным красителем, затем обесцвечивают кислотой и докрашивают дополнительно в какой-нибудь контрастный цвет.
6.5.1. Окраска спор методом Ожешко
- На высушенный нефиксированный препарат (мазок готовится толстым и на краю стекла) наливают несколько капель 0,5 % раствора хлористоводородной кислоты и подогревают 1–2 мин над пламенем горелки до закипания, после чего остатки кислоты сливают;
- остывший препарат промывают водой, подсушивают и фиксируют на пламени горелки;
- окрашивают карболовым фуксином Циля (рецепт 17) с подогреванием до появления паров;
- обесцвечивают 5 % раствором серной кислоты в течение нескольких секунд;
- промывают водой;
- докрашивают метиленовым синим Леффлера (синька Леффлера – рецепт 9) или 1 % водным раствором малахитового зеленого (рецепт 23) 3–5 мин.
Окрашенные споры имеют рубиново-красный цвет, вегетативные тела микробных клеток приобретают цвет дополнительной краски – голубой при применении метиленового синего или зеленый при использовании малахитового зеленого.
6.5.2. Окраска спор методом Пешкова
- На фиксированный мазок наливают синьку Леффлера (рецепт 9), дают краске закипеть. Окрашивание мазка происходит кипящей синькой в течение 20–30 с;
- препарат промывают водой;
- докрашивают 0,5 % водным раствором нейтральрот в течение 30–60 с (рецепт 25);
- промывают водой и высушивают.
Споры, окрашенные синькой Леффлера, имеют голубой цвет, вегетативные тела бактерий – красный цвет.
Источник
Основа, методы и способы окрашивания спор
окрашивание спор методология, используемая для окрашивания структур устойчивости, которые образуют некоторые бактериальные роды, когда они находятся в неблагоприятных условиях; эти структуры соответствуют способу выживания.
Есть много родов, которые образуют споры; Однако основными из них являются Bacillus и Clostridium. Эти роды считаются более актуальными, потому что они имеют патогенные виды для людей.
Каждая бацилла может породить спору. Во время окрашивания препарата спора может быть найдена внутри бациллы (эндоспора) или снаружи (экзоспора). При использовании традиционных методов окрашивания бактерий, таких как окрашивание по Граму, споры остаются бесцветными..
В настоящее время существует несколько методик окраски, которые способны пересекать толстую структуру споры и окрашивать ее. Эти методологии очень разнообразны; среди них можно упомянуть технику Дорнера, мельеровскую окраску и методологию Шеффера-Фултона, также известную как Вирц-Конклин..
Из всех упомянутых методик методология Шеффера-Фултона является наиболее используемой в рутинных лабораториях. Он обязан своим именем двум микробиологам, создавшим окраску в 1930 году: Алисии Шеффер и Макдональду Фултону. Однако иногда эту технику называют Вирц-Конклин в честь двух бактериологов 1900-х годов..
- 1 фундамент
- 2 Техника окраски спор
- 2.1 Техника Дорнера
- 2.2 Модифицированная техника Дорнера
- 2.3 Техника Шеффера-Фултона или Вирца-Конклина
- 2.4 Техника Мёллера
- 2.5 Модифицированная техника Мёллера без нагрева
- 3 использования
- 3.1 Примеры
- 4 Ссылки
фундамент
Споры не окрашиваются обычными окрасками, потому что имеют очень толстую стенку. Сложный состав спор предотвращает проникновение большинства красителей.
Если споры изучаются снаружи внутрь, наблюдаются следующие слои: во-первых, экзоспорий, который является самым тонким наружным слоем, образованным гликопротеинами..
Затем следует кутикула, которая обеспечивает устойчивость к высоким температурам, за которой следует кора, состоящая из пептидогликана. Тогда есть стена основания, которая защищает протопласт.
Спора представляет собой обезвоженную структуру, которая содержит 15% кальция и дипиколиновой кислоты. Поэтому большинство методов окрашивания спор основаны на применении тепла, чтобы краситель мог проникать в толстую структуру..
Как только спора окрашена, она не может устранить краситель. В методике Шеффера-Фултона малахитовый зеленый проникает в вегетативные клетки и при воздействии тепла проникает в эндоспоры, а также в экзоспоры..
При промывании водой краситель удаляется из вегетативной клетки. Это происходит потому, что зеленый малахитовый краситель является слегка основным, поэтому он слабо связывается с вегетативной клеткой.
С другой стороны, он не может выйти из споры, и, наконец, контрастирует бацилла с сафранином. Эта основа действительна для остальных техник, в которых происходит нечто подобное.
Техника окраски спор
Чтобы споры окрасились, у вас должна быть чистая культура подозреваемого штамма, которую вы хотите изучить.
Культура подвергается воздействию экстремальных температур в течение 24 часов, чтобы стимулировать микроорганизм к споруляции. Для этого культуру можно поместить в духовку при 44 ° С или в холодильник (8 ° С) на 24 или 48 часов..
Если при указанных температурах останется слишком много времени, будут наблюдаться только экзоспоры, поскольку все эндоспоры покинут бациллу..
В конце времени, несколько капель стерильного физиологического раствора должны быть помещены на чистое предметное стекло. Затем берется небольшая часть урожая и производится мелкий спред.
После этого его оставляют сохнуть, его фиксируют на высокой температуре и окрашивают некоторыми методами, которые описаны ниже:
Техника Дорнера
1- Приготовьте в пробирке концентрированную суспензию спорулированного микроорганизма в дистиллированной воде и добавьте равный объем отфильтрованного Kinyoun фенольного фуксина.
2- Поместите пробирку в ванну с кипящей водой на 5-10 минут..
3- На чистом предметном стекле смешайте каплю предыдущей суспензии с каплей 10% водного раствора нигрозина, вскипятите и отфильтруйте.
4- быстро растягивается и сохнет при умеренном нагревании.
5- Исследуйте с 100X объективом (погружение).
Споры окрашиваются в красный цвет, а бактериальные клетки выглядят почти бесцветными на темно-сером фоне.
Модифицированная техника Дорнера
1- Суспензия спорулированного микроорганизма распределяется на предметном стекле и фиксируется на высокой температуре..
2- Образец покрывается полоской фильтровальной бумаги, к которой добавляется фуксин фениновой кислоты. Краситель нагревают в течение 5-7 минут с помощью пламени горелки Бунзена до тех пор, пока не образуются выделения паров. Затем бумага удаляется.
3- Вымойте препарат водой, а затем высушите с помощью впитывающей бумаги..
4- Покройте мазок тонкой пленкой из 10% нигрозина, используя второе предметное стекло, чтобы распределить нигрозин или иглу.
Окраска, полученная спорами и бактериями, такая же, как описанная в предшествующем уровне техники..
Техника Шеффера-Фултона или Вирца-Конклина
1- Сделайте тонкий спред с суспензией спорулированного микроорганизма на предметном стекле и закрепите его для нагревания..
2- Накройте предметное стекло водным раствором 5% малахитового зеленого (на листе можно разместить фильтровальную бумагу).
3. Нагрейте пламя горелки Бунзена, чтобы пар вышел и удалял пламя. Повторите операцию от 6 до 10 минут. Если во время процедуры малахитовый зеленый раствор испаряется слишком много, можно добавить еще.
4- Удалите фильтровальную бумагу (если она была размещена) и промойте водой.
5- Накройте предметное стекло 0,5% водным сафранином в течение 30 секунд (в некоторых вариантах техники используется 0,1% водный сафранин и оставьте его на 3 минуты).
С этой техникой споры зеленые и бациллы красные.
Недостатком является то, что эндоспоры молодых культур плохо окрашиваются, так как выглядят очень прозрачными или бесцветными. Чтобы избежать этого, рекомендуется использовать культуры 48 часов инкубации.
Техника Мёллера
1- Покройте мазок хлороформом в течение 2 минут..
2- Откажитесь от хлороформа.
3- Покройте 5% -ной хромовой кислотой в течение 5 минут.
4- промыть дистиллированной водой
5- Лист покрыт фуксин-фенольным карпом и подвергается воздействию пламени горелки Бунзена до момента выделения паров; затем он удаляется из пламени на несколько мгновений. Операция повторяется до 10 минут.
7- Используйте подкисленный этанол (соляной спирт) для обесцвечивания. Осталось на 20 или 30 секунд.
8- Промыть дистиллированной водой.
9- Противодействовать покрытию листа метиленовым синим в течение 5 минут..
10- Промыть дистиллированной водой.
11 — Осталось высохнуть, и образец взят под микроскопом..
Споры выглядят красными и синими бациллами. Важно не вдыхать пары, потому что они токсичны и в долгосрочной перспективе могут быть канцерогенными.
Модифицированная техника Мёллера без тепла
В 2007 году Хаяма и его сотрудники создали модификацию метода Мёллера. Они удалили этап нагревания красителя и заменили его добавлением 2 капель поверхностно-активного вещества Tergitol 7 на каждые 10 мл фуксин-фенольного карболического раствора. Те же результаты были получены.
приложений
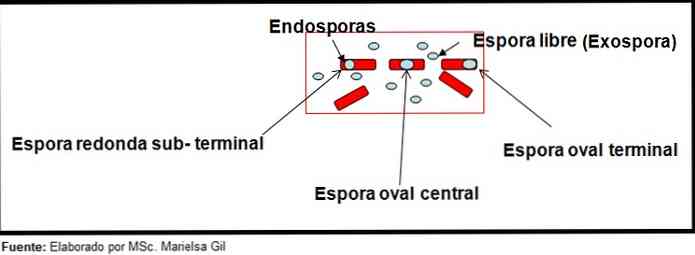
Окраска спор предоставляет очень ценную и полезную информацию для идентификации возбудителя, так как наличие его, его форма, расположение в бацилле и способность деформировать вегетативную клетку или нет, являются данными, которые могут направлять вид участвует в определенном поле.
В этом контексте стоит упомянуть, что споры могут быть круглыми или овальными, они могут располагаться в центре или также в парацентральном, субтерминальном или терминальном положении.
примеров
— Clostridium difficile образует овальную спору в терминальном положении, которая деформирует бациллу.
— Спора Clostridium Tertium Он овальный, не деформирует бациллу и расположен на уровне терминала.
— Эндоспора Clostridium тетэни он терминальный и деформирует палочку, придавая вид голени.
— Споры Clostridium botulinum, С. histolyticum, С. Новый и C. septicum они округлые или субтерминальные овальные и деформируют бациллу.
— Эндоспора Clostridium sordelli он расположен в центральном положении, с небольшой деформацией.
Источник