- Способы фиксации мазков из микробов и смешанного материала
- Ориентировочная окраска бактерий простыми методами.
- Микроскопия препарата с иммерсионным объективом
- 3.3.3. Методы фиксации и окраски препаратов
- Какие способы фиксации препаратов вы знаете
- Окрашенные мазки. Отбор материала для микроскопии
- Фиксация препарата. Фиксация мазка. Фиксация бактерий
- Методы приготовления препаратов для микроскопии, микробиология
- При работе необходимо соблюдать следующую последовательность:
- При смене объектива, дающего малое увеличение, на объектив большего увеличения требуется соблюдение следующих правил:
- Приготовление фиксированных окрашенных препаратов включает следующие этапы: приготовление мазка, высушивание, фиксацию и окраску.
- Метод окрашивания в модификации
Способы фиксации мазков из микробов и смешанного материала
Фиксация необходима для инактивации бактерий и прикрепления (фиксации) их к стеклу, предотвращения аутолизиса клеток и улучшения восприятия красителя.
а) Самым распространённым методом фиксации бактерий считается обработка жаром, что осуществляется путём трёхкратного проведения препарата мазком кверху через пламя спиртовки или газовой горелки. Препарат находится в пламени спиртовки З секунды. После чего препараты из бактерий окрашиваются разными способами. Метод применим при работе с чистой культурой микробов.
б) Фиксация химическими веществамииспользуется для выявления и дифференциации структурных элементов: жгутиков, протоплазмы, нуклеоида, оболочки, при работе со смешанным материалом (кровь, отпечатки органов, соскобы со слизистых, гной, мокрота). В качестве фиксаторов используют:
— метиловый спирт (фиксируют 5 минут),
— этиловый спирт (фиксируют 20 минут),
— смесь Никифорова: равные объёмы спирта и эфира (фиксируют 20 минут),
— спирт — формол: смесь 5мл неразведённого формалина мл и 96 % этилового спирта (фиксируют 15 минут),
— жидкость Боуэна: неразбавленный формалин 10 мл, ледяная уксусная кислота 2 мл, насыщенный водный раствор пикриновой кислоты 30 мл (фиксируют 30 минут),
— жидкость Карнуа — ледяная уксусная кислота 10 мл, хлороформ 30 мл и 96 % спирт (фиксируют 15 минут).
Ориентировочная окраска бактерий простыми методами.
Окраска выявляет морфологию и частично структуру клетки.
Для простой окраски используют один из красителей:
а) разведённый (1:10) карболовый фуксин, окрашивают 10-30 сек. (метод Леффлера), промывают водой, высушивают на воздухе;
б) водньий раствор метиленовой синьки Леффлера окрашивают 3-10 минут, промывают водой, высушивают на воздухе.
Микроскопия препарата с иммерсионным объективом
Иммерсионный объектив даёт увеличение х90 при условии отсутствия рассеивания потока лучей в связи с неоднородностью среды при их прохождении.
В этой связи, во избежание такого дефекта применяется иммерсионное кедровое масло или его заменитель — вазелиновое масло. Процесс микроскопии с иммерсионным объективом х90 ведут с окулярами х7, х10, но чаще с первым из них. Техника микроскопии состоит из нескольких этапов:
1. На готовый окрашенный мазок наносят каплю масла.
2. Под контролем глаза сбоку осторожно опускают тубус, погружая объектив в каплю масла. При неосторожном выполнении можно раздавить либо линзу объектива, либо предметное стекло.
3. После прикосновения объектива к маслу дальнейшее опускание тубуса ведётся с помощью микровинта микроскопа до появления микрообъектов в окуляре.
4. Просмотр препарата ведут только за счёт манипуляций с микровинтом и движения стекла.
5. После окончания микроскопии тубус поднимают, объектив выходит из капли масла.
6. Масло с объектива удаляют чистой ваткой или марлей и протирают жирорастворителем — либо ксилолом, либо спиртом, либо хлороформом. Оставлять масло на линзе объектива нельзя.
7. Револьверную часть на тубусе устанавливают на объектив х8, конденсор и тубус опускают, переводя в нерабочее состояние, и закрывают микроскоп колпаком.
Источник
3.3.3. Методы фиксации и окраски препаратов
Обработка мазков фиксирующими жидкостями, придающими форменным элементам стойкость по отношению к содержащейся в красках воде, которая без фиксации мазков гемолизирует эритроциты и изменяет строение лейкоцитов. Кроме того, фиксация, вызывая коагуляцию белка, прикрепляет препарат к стеклу.
Химически чистый метиловый спирт (метанол) лучше всего; 96° этиловый спирт, денатурированный спирт, смесь Никифорова (смесь этанола 96% и наркозного эфира 1:1), жидкость Карнуа (этанол 96% — 60 %, хлороформа 30 %, ледяной уксусной кислоты 10 %), спирт-формол (40% формалин 5 мл, этиловый спирт 96° — 95 мл).
Высохшие на воздухе мазки крови, сложенные попарно (мазками наружу), опускают пинцетом в специальную посуду для фиксации (в широкогорлую банку с притертой пробкой) или в обыкновенные стеклянные стаканы, обрезанные до 6—6,5 см и наполненные до определенной высоты фиксирующей жидкостью.
В метиловом спирте мазки выдерживают не менее 5 мин, а в этиловом и денатурированном спирте и смеси Никифорова — не менее 30 мин.
По окончании срока фиксации препараты вынимают пинцетом, сушат на воздухе или ополаскивают в банке с дист. водой и укладывают мазками кверху на стеклянный мостик для окраски.
Фиксации мазков парами фенола (по Сюткину). Принцип. Получение хорошего качества фиксации мазкой при отсутствии спирта.
Методика. В эксикаторе заменяют фарфоровую подставку на стеклянный мостик для мазков. На дно эксикатора наливают жидкость — фенол (90 весовых частей кристаллического фенола и 10 весовых частей дист.воды) из расчета 100 мл на 1,4 л объема эксикатора. В близи эксикатора на стене вешают термометр. Приготовленные обычным способом сухие мазки крови помешают в эксикатор на мостике в один ряд намазанной поверхностью вниз.
Для сохранения формы эритроцитов, лейкоцитов и дифференцированной окраски зернистости лейкоцитов воздействие на мазки крови паров фенола должно продолжаться в зависимости от комнатной температуры строго определенное время: при температуре 16—18° — 20 мин, при 19—21°— 10 мин, при 22—24° — 5 мин, при 25—27° — 3 мин. По истечении этого времени мазки вынимают, раскладывают на столе намазанной поверхностью кверху.
Недостаточная фиксация мазков дает слабую окраску нейтрофильной зернистости, а недостаточное освобождение мазков от паров фенола ведет к гемолизу эритроцитов при окраске или окрашиванию мазка в красный цвет.
Физический способ фиксации
Предметное стекло с препаратом берут пинцетом или в руки за рёбра мазком кверху и плавным движением проводят 2—3 раза над верхней частью пламени горелки. Весь процесс фиксации должен занимать не более 2 с. Надёжность фиксации проверяют: свободную от мазка поверхность предметного стекла прикладывают к тыльной поверхности левой кисти. При правильном фиксировании мазка стекло должно быть горячим, но не вызывать ощущения ожога (70—80 °С).
Все методы окраски мазков основаны гл.обр. на химическом сродстве основных частей клеток к определенным анилиновым краскам и на их физических свойствах. Цитоплазма одних клеток, будучи щелочной, имеет сродство к кислым краскам, выявляя оксифильные элементы крови. Цитоплазма других клеток, содержащих базофильные и нейтрофильные субстанции, поглощает и кислые, и основные краски. Ядра, содержащие в значительном количестве нуклеиновую кислоту, связывают главным образом основные краски.
К основным гематологическим краскам относятся метиленовый синий и его производные— азур I (метиленазур) и азур II (смесь равных частей азура I и метиленового синего), к кислым — водорастворимый желтый эозин. Азур-эозиновые смеси красок обладают высокой чувствительностью к реакции воды и поэтому применяемая дист. вода должна иметь нейтральную реакцию, т. е. рН 7,0. При кислей реакции воды клетки долго не прокрашиваются и имеют красный оттенок. При щелочной реакции эритроциты окрашиваются в серовато-синий цвет, а ядра и цитоплазма клеток — в очень темные цвета.
Окраска по Романовскому Принцип.
Окрашивание различных элементов клеток в разные цвета и оттенки смесью основных (азур II) и кислых (водорастворимый желтый эозин) красок.
Окраска по Романовскому в модификации Филипсона. Принцип.
Применение красителей-фиксаторов, которыми мазки крови в первый период одновременно фиксируются и частично окрашиваются, а во второй период, после разбавления красителей-фиксаторов дистиллированной водой, докрашиваются окончательно.
Окраска по Нохту. Принцип.
Воздействие на фикс. мазок водного раствора смеси основной (азур II) и кислой краски (эозин).
Окраска по Паппенгейму — Крюкову. Принцип.
Комбинированная окраска фиксатором-красителем Мая—Грюнвальда и краской Романовского, дающая возможность очень хорошо дифференцировать составные части клеток.
Окраска по Райту. Принцип
Применение специально приготовленного красителя-фиксатора, дающего наиболее четкую окраску зернистости гранулоцитов, особенно базофилов.
Мазок до нанесения толстых капель и после не фиксируют, а наливают на него на несколько минут дист. воду для извлечения гемоглобина. Окрашенную гемоглобином воду затем осторожно сливают и на препарат наливают разведенную, как обычно, краску Романовского на 20—30 мин. После окраски препарат осторожно промывают водой, чтобы не смыть каплю, и высушивают на воздухе.
Больший объем крови, чем в мазках, и гемолиз эритроцитов позволяют легче обнаружить в крови малярийные плазмодии, спирохеты возвратного тифа, а также эозинофилы и полихроматофилы.
Клиническое значение. Приведенные методы окраски дают возможность дифференцировать вид клеток, особенности структуры их ядер и цитоплазмы и патологические изменения в них.
По Граму Техника проведения окраски
Окраска по Граму относится к сложному способу окраски, когда на мазок воздействуют двумя красителями, из которых один является основным, а другой— дополнительным. Кроме красящих веществ применяют обесцвечивающие вещества: спирт, кислоты и др.
Для окраски по Граму чаще используют анилиновые красители: генциановый, метиловый фиолетовый, кристаллвиолет. Грам (+) микроорганизмы дают прочное соединение с указанными красителями и йодом. При этом они не обесцвечиваются при воздействии на них спиртом, вследствие чего при доп. окраске фуксином. Грам (+) микроорганизмы не изменяют первоначально принятый фиолетовый цвет.
Грам (-) микроорганизмы образуют с основными красителями и йодом легко разрушающееся под действием спирта соединение. В результате микробы обесцвечиваются, а затем окрашиваются фуксином, приобретая красный цвет.
Способы крашения разделяют на витальный, поствиталъный и негативный, последний может быть витальным и поствитальным.
Витальный способ окраски
Для витального (прижизненного) крашения применяют 0,2-0,001 % водные растворы метиленового и толуоидинового синего, нейтральрот и конго красный, которые добавляют в придавленную или висячую капли культуры. Этим способом выявляют спирохеты, простейшие, определяют подвижность бактерий, иммунное набухание капсулы, но использование его требует строгого соблюдения правил, исключающих лабораторное заражение.
Поствитальные способы окраски (фиксированных препаратов)
Простой способ — красящие растворы фуксина Пфейффера (экспозиция 1-2 мин), метиленового синего (3-5 мин) наносят на фиксированный препарат, так, чтобы он полностью покрыл мазок, краситель сливают, препарат промывают струйкой воды, встряхивают, высушивают и микроскопируют.
Простые способы позволяют судить о величине, форме, локализации, взаимном расположении отдельных клеток, но с их помощью нельзя установить структуру микробов и часто их дифференцированное отношение к красителям.
Из сложных способов крашения бактерий в основном используют дифференцированный способ Грамма, выявление кислотоустойчивости по Циль — Нельсону, определение волютиновых зёрен по Леффлеру или Нейссеру, дифференцирующий способ Романовского — Гимзы, негативно-позитивный способ определения капсулы по Гинсу — Бурри, выявление спор по Цилю — Нельсону и др.
Грибы исследуют неокрашенными или способами Грама, Циль- Нельсона. Леффлера, Романовского — Гимзы, а также раствором Люголя. лактофуксином и др.
Источник
Какие способы фиксации препаратов вы знаете
Для приготовления окрашенных препаратов из исследуемого объекта готовят мазки и фиксируют их.

Окрашенные мазки. Отбор материала для микроскопии
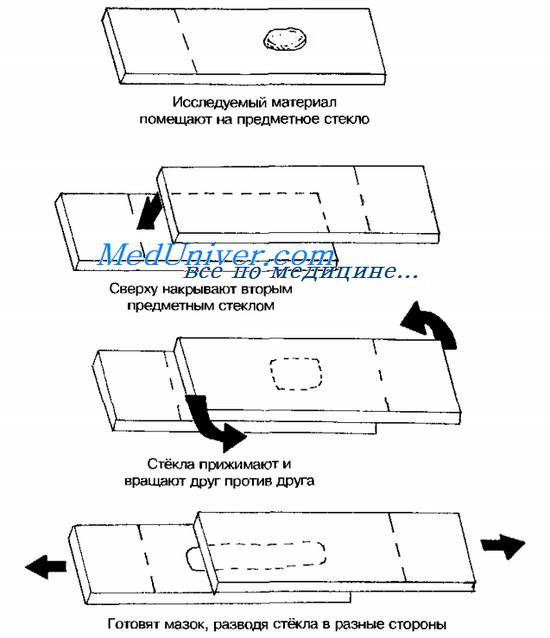
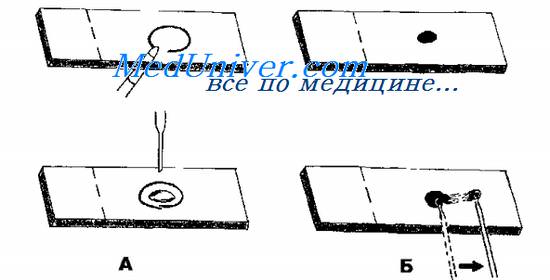
Тампоны, содержащие микроорганизмы, прокатывают по предметному стеклу (рис. 11-8, А); с их помощью также готовят мазки из непрозрачных жидкостей, например взвеси испражнений (рис. 11-8, Б). Мазки из материалов со слизистой или грубой консистенцией готовят растиранием их между двумя предметными стёклами (рис. 11-9). Прозрачные жидкости (например, мочу или СМЖ) можно нанести в виде капли на предметное стекло (рис. 11-10, А), при этом границы капли желательно обвести маркёром. Лучшие результаты даёт предварительное центрифугирование; затем осадок наносят на стекло; если он густой, его можно распределить с помощью стеклянной палочки (рис. 11-10, Б).
Фиксация препарата. Фиксация мазка. Фиксация бактерий
В практической бактериологии наиболее распространена термическая фиксация (над пламенем горелки) — метод грубый, но сохраняющий морфологию и отношение к красителям у бактерий. Для более детального изучения структуры клеток применяют фиксирующие растворы, предотвращающие ферментативный аутолиз бактерий и стабилизирующие макромолекулы путём химического их сшивания. Для светоопти-ческой микроскопии используют формалин, спирты, глутараль-дегид, жидкость Карнуа, ацетон, пары осмиевой кислоты и др.
Мазки фиксируют, помещая их в раствор фиксатора или нанося фиксаж на мазок. Для электронной микроскопии применяют глутаральдегид и тетраоксид осмия.
Источник
Методы приготовления препаратов для микроскопии, микробиология
Методы приготовления препаратов для микроскопии, микробиология
Микроскопия Изучение морфологии и строения клеток микроорганизмов, величина которых измеряется в большинстве случаев микрометрами (1 мкм = = 10 мм =10 м), возможно только с помощью микроскопов, обеспечивающих увеличение исследуемых объектов в сотни (световая микроскопия) и десятки тысяч (электронная микроскопия) раз. Изображение в световом микроскопе формируется вследствие того, что объект и различные элементы его структуры избирательно поглощают свет с различной длиной волны (абсорбционный контраст) или вследствие изменения фазы световой волны при прохождении света через объект (фазовый контраст). Световая микроскопия включает в себя обычную просвечивающую микроскопию (светло- и темнопольную), фазово-контрастную и люминесцентную.
Светлопольная микроскопия. Существуют различные модели учебных и исследовательских световых микроскопов, которые позволяют определить форму клеток микроорганизмов, их размер, подвижность, степень морфологической гетерогенности, а также характерную для микроорганизмов способность к дифференцирующему окрашиванию. Правила пользования микроскопом. Строгое соблюдение правил пользования микроскопом является непременным условием для каждого работающего с ним.
При работе необходимо соблюдать следующую последовательность:
- Устанавливают микроскоп в рабочее положение, т.е. так, чтобы колонка была обращена в сторону исследователя, а зеркало — в направлении источника света.
- Ставят под тубус, пользуясь револьвером, объектив малого увеличения. Как правило, предмет рассматривают вначале при малом увеличении.
- Проверив, открыта ли диафрагма и поднят ли конденсор, вращают, глядя в окуляр, зеркало и устанавливают его так, чтобы поле зрения оказалось хорошо освещенным.
- Помещают препарат на предметный столик микроскопа так, чтобы рассматриваемый объект оказался над отверстием столика. Препарат закрепляют с помощью клемм.
- Находят фокусное расстояние, для чего опускают или поднимают тубус с помощью макрометрического винта. Для окончательной фокусировки пользуются микрометрическим винтом.
При смене объектива, дающего малое увеличение, на объектив большего увеличения требуется соблюдение следующих правил:
| 1 | Прежде чем сменить объектив, рассматриваемый объект (или его участок) ставят в центре поля зрения микроскопа при малом увеличении. Диаметр линзы уменьшается по мере возрастания степени увеличения, вследствие чего объект, если он лежит не в центре, при смене объектива может оказаться за пределами поля зрения. | Before changing the lens, the object in question (or its section) is placed in the center of the field of view of the microscope at low magnification. The diameter of the lens decreases as the magnification increases, as a result of which the object, if it is not in the center, may be out of sight when the lens is changed. |
| 2 | Слегка приподнимают тубус и затем переводят объектив с помо щью револьвера. Это необходимо потому, что объектив большего увели чения всегда бывает длиннее. | Slightly raise the tube and then transfer the lens with a revolver. This is necessary because the lens of higher magnification is always longer. |
| 3 | Для того чтобы в поисках фокусного расстояния не раздавить пре парат или, что еще хуже, не повредить линзу объектива, тубус с подведеннымпод него объективом, глядя для контроля сбоку микроскопа, опускают до самой поверхности препарата и затем, смотря в окуляр, очень медленно (чтобы не пропустить появления очертаний предмета) поднимают. | In order not to crush the preparation or, even worse, to damage the objective lens, while searching for the focal length, the tube with the objective underneath it, looking to control the side of the microscope, is lowered to the surface of the preparation and then, looking into the eyepiece, very slowly (so as not to miss the appearance of the outlines of the subject) raise. |
Рассматривают препарат в микроскоп левым глазом. Правый глаз при этом должен оставаться открытым. Левую руку держат на микрометрическом винте и слегка вращают его (влево и вправо).
Этим достигается возможность рассмотрения поверхностных и более глубоких участков объекта. Правой (свободной) рукой делают зарисовку того, что видно в поле зрения.
Правила работы с иммерсионным объективом. Сухой окрашенный препарат (приготовление см. ниже) помещают на столик микроскопа и, пользуясь объективом 8х, устанавливают свет.
Затем в центр препарата на мазок наносят каплю иммерсионного масла и заменяют сухую систему иммерсионной. С помощью макрометрического винта опускают тубус микроскопа до погружения объектива в масло. Эту операцию нужно проводить очень осторожно, следя сбоку за тем, чтобы фронтальная линза не коснулась предметного стекла и не получила повреждения. После погружения объектива в масло осторожно, также пользуясь макровинтом, поднимают тубус и, наблюдая в окуляр, находят плоскость препарата. Точная фокусировка достигается с помощью микрометрического винта. По окончании микроскопирования поднимают тубус, снимают препарат и осторожно протирают фронтальную линзу объектива сначала сухой хлопчатобумажной салфеткой, а затем той же салфеткой, но слегка смоченной ксилолом. Оставлять масло на поверхности линзы ни в коем случае нельзя, так как оно способствует фиксированию пыли и может со временем привести к повреждению оптики микроскопа. Изучение микроорганизмов в световом микроскопе.
Выбор методов микроскопического анализа и способов окраски определяется конкретной целью исследования.
Препараты готовят, как правило, на предметных стеклах, толщина которых не должна превышать 1,2 — 1,4 мм. Применение более толстых стекол не позволяет получить резкое изображение краев диафрагмы осветителя в плоскости препарата. Поверхность стекла должна быть тщательно очищена и обезжирена, чтобы капля жидкости равномерно расплывалась по стеклу. Это достигается протиранием стекол ватой, смоченной эфиром (после этого промывание водой не требуется), или обжиганием поверхности стекол в пламени горелки (жир при этом сгорает).
Покровные стекла, применяемые для приготовления препаратов микроорганизмов, также должны быть тщательно вымыты и высушены. Толщина покровных стекол не должна превышать 0,15-0,17 мм. Более толстые покровные стекла резко ухудшают качество получаемого изображения. Препараты живых клеток микроорганизмов
1. «Раздавленная капля». На предметное стекло наносят каплю водопроводной воды и помещают в нее небольшое количество клеток изучаемых микроорганизмов, размешивают и накрывают покровным стеклом. Микроорганизмы, выращенные на плотной питательной среде, переносят в каплю воды бактериологической петлей, выращенные в жидкой среде — стерильной пипеткой. В этом случае каплю воды на предметное стекло можно не наносить. Капля исследуемого материала должна быть настолько мала, чтобы после прижимания ее покровным стеклом не было избытка жидкости, выступающего из-под него. В противном случае избыток жид кости необходимо удалить фильтровальной бумагой.
2. «Висячая капля». Каплю суспензии микроорганизмов петлей наносят на покровное стекло, которое поворачивают каплей вниз и помещают на специальное предметное стекло с углублением (лункой) в центре. Капля должна висеть свободно, не касаясь краев и дна лунки. Края лунки предварительно смазывают вазелином. Капля оказывается герметизированной во влажной камере, что делает возможным многодневное наблюдение за объектом. Для длительных наблюдений используют стерильные стекла, а суспензию микроорганизмов готовят на жидкой питательной среде. Препараты фиксированных окрашенных клеток микроорганизмов
Приготовление фиксированных окрашенных препаратов включает следующие этапы: приготовление мазка, высушивание, фиксацию и окраску.
1. Приготовление мазка. На обезжиренное спиртом предметное стекло помещают маленькую каплю водопроводной воды и переносят в нее петлей небольшое количество исследуемого материала как для препарата «раздавленная капля». Полученную суспензию равномерно размазывают петлей на площади 1 — 2 см2 возможно более тонким слоем. Мазок должен быть настолько тонок, чтобы высыхал после приготовления.
2. Высушивание мазка. Лучше всего сушить готовый препарат при комнатной температуре на воздухе. Хорошо приготовленный тонкий мазок высыхает быстро. Если высушивание мазка замедлено, то препарат можно слегка нагреть в струе теплого воздуха высоко над пламенем горелки, держа стекло мазком вверх. Эту операцию следует проводить осторожно, не перегревая мазка, иначе клетки микроорганизмов деформируются.
3. Фиксация препарата преследует несколько целей: убить микроорганизмы, то есть сделать безопасным дальнейшее обращение с ними; обес печить лучшее прилипание клеток к стеклу; сделать мазок более восприимчивым к окраске, так как мертвые клетки окрашиваются лучше, чем живые. Самым распространенным способом фиксации является термическая обработка. Для этого препарат трижды проводят через наиболее горячую часть пламени горелки, держа предметное стекло мазком вверх. Не следует перегревать мазок, так как при этом происходят грубые изменения клеточных структур, а иногда и внешнего вида клеток, например их сморщивание. Для исследования тонкого строения клетки прибегают к фиксации различными химическими веществами. Фиксирующую жидкость наливают на мазок, либо препарат на определенное время погружают в стакан с фиксатором.
4. Окраска. Клетки микроорганизмов окрашивают главным образом анилиновыми красителями. Различают простые и дифференциальные спо собы окрашивания микроорганизмов. При простой окраске прокрашивается вся клетка, так что становятся хорошо видны ее форма и размеры. Дифференциальная окраска предполагает окрашивание не всей клетки, а опре деленных ее структур. С помощью дифференциальной окраски выявляют некоторые клеточные структуры и запасные вещества. Для простого окрашивания клеток микроорганизмов чаще всего пользуются фуксином, генциановым фиолетовым, метиленовым синим. Для получения более чистых препаратов краситель наливают на мазок, покрытый фильтровальной бумагой.
Метод окрашивания в модификации
Синева позволяет использовать вместо растворов красителей фильтровальную бумагу, заранее пропитанную красителем. В правильно окрашенном и хорошо промытом препарате поле зрения светлое и чистое, окрашены только клетки микроорганизмов. Фиксированные, окрашенные препараты могут храниться длительное время. Необходимо помнить, что возраст культуры, состав среды и условия культивирования существенно влияют на морфологию и цитологию микроорганизмов.
Источник




