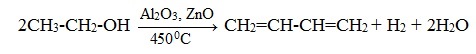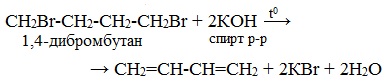- Получение алкадиенов
- Получение алкадиенов
- 1. Дегидрирование алканов
- 2. Синтез Лебедева
- 3. Дегидратация двухатомных спиртов
- 4. Дегидрогалогенирование дигалогеналканов
- Диены — номенклатура, получение, характерные химические свойства
- Номенклатура алкадиенов
- Способы получения алкадиенов
- Химические свойства алкадиенов
- Какие основные способы получения диенов знаете напишите уравнение реакции
- Алкадиены, подготовка к ЕГЭ по химии
- Алкадиены или диены
- Строение и номенклатура алкадиенов
- Молекулярная формула диенов
- Структурное строение молекул диенов
- Изомерия диенов
- Номенклатура алкадиенов
- Физические свойства алкадиенов
- Получение сопряженных алкадиенов
- Реакции присоединения сопряженных диенов
- Реакции полимеризации и горения
- Применение алкадиенов
- Видео
- Применение
Получение алкадиенов
Алкадиены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствуют две двойные связи между атомами углерода С=С.
Общая формула алкадиенов CnH2n-2 (как у алкинов, а также циклоалкенов), где n ≥ 3.
Наличие двух двойных связей между атомами углерода очень сильно влияет на свойства углеводородов. В этой статье мы подробно остановимся на свойствах, способах получения и особенностях строения алкадиенов.
Получение алкадиенов
1. Дегидрирование алканов
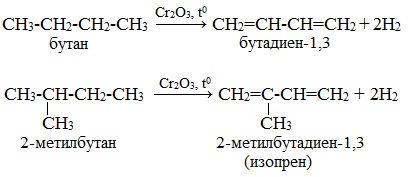
Отщепление водорода от бутана — это промышленный способ получения дивинила. Реакция протекает при нагревании в присутствии оксида хрома (III):

Изопрен получают каталитическим дегидрированием изопентана (2-метилбутана):
2. Синтез Лебедева
Н агревание этанола в присутствии катализатора (смесь оксидов Al2O3, MgO, ZnO) – это промышленный способ получения дивинила из этанола (синтез Лебедева).
При этом образуются бутадиен-1,3, вода и водород:
3. Дегидратация двухатомных спиртов
Под действием серной кислоты вода отщепляется от бутандиола-1,3. При этом образуется дивинил и вода:
4. Дегидрогалогенирование дигалогеналканов
Под действием спиртовых растворов щелочей протекает отщепление атомов галогена и водорода и образуются вода, соль и алкадиен.
При этом атомы галогенов в дигалогеналкане должны располагаться не у одного и не у соседних атомов углерода.
1,3-Дихлорбутан реагирует со спиртовым раствором гидроксида калия с образованием бутадиена-1,3:
Источник
Диены — номенклатура, получение, характерные химические свойства
Алкадиены (диены) – непредельные алифатические углеводороды, молекулы которых содержат две двойные связи. Общая формула алкадиенов СnH2n-2.
Свойства алкадиенов в значительной степени зависят от взаимного расположения двойных связей в их молекулах. По этому признаку различают три типа двойных связей в диенах:
1) изолированные двойные связи разделены в цепи двумя или более s-связями:
СН2=СН–СН2–СН=СН2 (разделенные sp 3 -атомами углерода, такие двойные связи не оказывают друг на друга взаимного влияния и вступают в те же реакции, что и двойная связь в алкенах);
2) кумулированные двойные связи расположены у одного атома углерода:
СН2=С=СН2 (подобные диены (аллены) менее стабильны, чем другие диены и при нагревании в щелочной среде перегруппировываются в алкины);
3) сопряженные двойные связи разделены одной s-связью:
Сопряженные диены представляют наибольший интерес. Они отличаются характерными свойствами, обусловленными электронным строением молекул, а именно, непрерывной последовательностью четырех sp 2 -атомов углерода. Все атомы углерода лежат в одной плоскости, образуя s-скелет. Негибридизованные р-орбитали каждого атома углерода перпендикулярны плоскости s-скелета и параллельны друг другу, взаимно перекрываются, образуя единое p-электронное облако. Такой особый вид взаимного влияния атомов называется сопряжением.
Перекрывание р-орбиталей молекулы бутадиена имеет место не только между С1 – С2, С3 – С4, но и между С2 – С3. В связи с этим применяют термин: «сопряженная система». Следствием делокализации электронной плотности является то, что длины связей С1 – С2 (С3 – С4) увеличены, по сравнению с длиной двойной связи в этилене (0,132 нм) и составляют 0,137 нм; в свою очередь, длина связи С3 – С4 меньше, чем в этане С – С (0,154 нм) и составляет 0,146 нм. Диены с сопряженной системой двойных связей более энергетически выгодны.
Номенклатура алкадиенов
По правилам IUPAC главная цепь молекулы алкадиена должна включать обе двойные связи. Нумерация атомов углерода в цепи проводится так, чтобы двойные связи получили наименьшие номера. Названия алкадиенов производят от названий соответствующих алканов (с тем же числом атомов углерода) с добавлением окончания –диен.
Виды изомерии алкадиенов:
Структурная изомерия:
1) изомерия положения сопряженных двойных связей;
2) изомерия углеродного скелета;
3) межклассовая (изомерны алкинам)
Пространственная изомерия — диены, имеющие различные заместители при углеродных атомах у двойных связей, подобно алкенам, проявляют цис-транс-изомерию.
Способы получения алкадиенов

Химические свойства алкадиенов

Для сопряженных диенов характерны реакции присоединения (реакции 1, 2). Наличие сопряженной системы p-электронов приводит к особенностям реакций присоединения. Сопряженные диены способны присоединять не только по двойным связям (С1 и С2, С3 и С4), но и к концевым (С1 и С4) атомам углерода сообразованием двойной связи между С2 и С3. Соотношение продуктов 1,2- и 1,4-присоединения зависит от температуры, при которой проводился эксперимент и от полярности применяемого растворителя.
Восстановление (реакция 3) с помощью [Na + C2H5OH] называется восстановлением водородом в момент выделения (при взаимодействии натрия и спирта выделяется водород). Алкены в таких условиях не восстанавливаются, это отличительное свойство сопряженных диенов.
Полимеризация (реакция 4) важнейшее свойство сопряженных диенов, которая происходит под действием различных катализаторов (AlCl3, TiCl4+(C2H5)3Al) или света. В случае применения определенных катализаторов можно получить продукт полимеризации с определенной конфигурацией цепей.
Цис-конфигурацию имеет натуральный каучук. Макромолекулы натурального каучука имеют спиралевидную структуру цепи из-за того, что изопреновые звенья изогнуты, что создает пространственные препятствия упорядоченному расположению цепей. В каучуке длинные молекулы скручены в спутаны друг с другом в спирали. При растяжении каучука спирали растягиваются, а при снятии напряжения они снова скручиваются. В природе существует еще другой полимер изопрена гуттаперча (транс-конфигурация). Гуттаперча обладает стержнеобразной структурой цепи из-за выпрямленности изопреновых звеньев (цепи с транс-конфигурацией двойных связей могут располагаться одна вдоль другой), поэтому гуттаперча твердый, но хрупкий полимер. Натуральный каучук имеют немногие страны и поэтому его заменяют синтетическими каучуками из дивинила, а также из изопрена.
Для практического использования каучуки превращают в резину.
Резина – это вулканизованный каучук с наполнителем (сажа). Суть процесса вулканизации заключается в том, что нагревание смеси каучука и серы приводит к образованию трехмерной сетчатой структуры из линейных макромолекул каучука, придавая ему повышенную прочность. Атомы серы присоединяются по двойным связям макромолекул и образуют между ними сшивающие дисульфидные мостики.
Сетчатый полимер более прочен и проявляет повышенную упругость – высокоэластичность (способность к высоким обратимым деформациям).
В зависимости от количества сшивающего агента (серы) можно получать сетки с различной частотой сшивки. Предельно сшитый натуральный каучук – эбонит – не обладает эластичностью и представляет собой твердый материал.
Источник
Какие основные способы получения диенов знаете напишите уравнение реакции
Общие способы получения диенов аналогичны способам получения алкенов.
1. Дегидрирование алканов
Каталитическое двухстадийное дегидрирование алканов (через стадию образования алкенов). Этим путем в промышленности получают бутадиена-1,3 (дивинил) из бутана и изопрен из изопентана (2-метилбутана), содержащихся в газах нефтепереработки и в попутных газах.
2. Дегидрирование и дегидратация этанола (реакция Лебедева)
Диеновые углеводороды получают в основном по способу Лебедева: из этанола на катализаторе (происходит отщепление молекул воды и водорода – образуется бутадиен-1,3).
3. Дегидрогалогенирование дигалогеналканов спиртовым раствором щелочи
4. Дегидратация гликолей (двухатомных спиртов, или алкандиолов)
Источник
Алкадиены, подготовка к ЕГЭ по химии
Алкадиены или диены
Алкадиены (их также называют диенами) – это углеводороды, которые имеют в своем составе 2 двойных связи.
Строение и номенклатура алкадиенов
Рассмотрим более подробно, что из себя представляют молекулы диенов, какой они имеют атомный состав, узнаем подробнее их структуру и изомерию.
Молекулярная формула диенов
Для начала определим: как связаны между собой число атомов углерода и водорода в молекуле диена. Общая формула алкадиенов выглядит так:
Из уроков про алканы и алкены мы знаем, что n – число атомов углерода в молекуле, и задается любое. Так как в молекуле диена присутствуют две двойных связи, то минимальное число атомов углерода должно быть 3, т.е. 3 атома углерода будут связаны между собой только двойными связями, как показано формулой ниже:
Для примера воспользуемся формулой, чтобы узнать молекулярный состав диенов, у которых 3, 4 или 7 атомов углерода.
Подставляем эти числа в формулу, и получаем молекулярные составы:
Теперь, зная молекулярный состав молекул, разберемся с их структурой.
Структурное строение молекул диенов
Всего существует 3 варианта расположение двойных связей, от которого будет зависеть гибридизация атомов углерода.
Рассмотрим каждый из них.
- Кумулированные связи. Что же означает это сложное слово? Кумулированные – это двойные связи, которые стоят у соседних атомов углерода, например у 1 и 2. Для наглядности посмотрим на рисунок ниже. У 1 и 3 атома углеродов тип гибридизации –sp 2 , и это означает, что у них есть 1 p-орбиталь, имеющая свою обычную форму в виде восьмерки. Только у 1 атома эта восьмерка расположена «горизонтально», а у 3 – «вертикально» (показано на рисунке 1).
У 2 атома углерода тип гибридизации – sp, и у него есть 2 p-орбитали с обычной формой – одна расположена «вертикально», а вторая «горизонтально» (смотрим на 2 атом углерода на рисунке 1).
Между первым и вторым атомом углерода образуются σ-связь (при перекрывании гибридных орбиталей, выделена синей линией) и π-связь (от перекрывания «горизонтальных» p-орбиталей, выделено зеленой линией). Между вторым и третьим также образуются σ-связь (от перекрывания гибридных орбиталей, выделена синей линией) и π-связь (от перекрывания «вертикальных» p-орбиталей, выделена зеленой линией).
Рисунок 1. – Образование кумулированных двойных связей
- Сопряженные связи. Если между двумя двойными связями есть одна одинарная связь, то такие связи называются сопряженными. Все 4 атома углерода, которые участвуют в образовании этих связей, имеют sp 2 -гибридизацию. При этом негибридизованные p-орбитали образуют так называемую пи-систему кратных связей, что представлено на рисунке 2. Пример структурной формулы диена с сопряженными кратными связями представлен ниже.
Рисунок 2. – Образование сопряженных кратных связей на примере бутадиена-1,3.
- Изолированные связи. Такой вид связей можно увидеть, если между двойными связями будут находиться несколько одинарных. Гибридизация атомов углерода при двойных связях, как мы уже знаем из первого и третьего уроков – sp 2 . Пример диена с изолированными связями представлен ниже.
Изомерия диенов
Рассмотрим структурные формулы разных веществ, которые имеют одинаковый атомный состав, (если вспомним, то это ни что иное, как определение «изомерии») на примере диена с названием пентадиен-1,3. Внимательно посмотрим на рисунок ниже и порассуждаем:
- Двойные связи в молекуле могут расположиться у разных атомов углерода. Например, у 1 и 3 или у 1 и 2, а как известно, у соединений с разным строением будут и разные свойства. Не забываем, что такой вид изомерии называется изомерией положения связей (стрелочка 1).
- Предположим, что кратные связи остались у 1 и 3 атома углеродов, но длина углеродного скелета теперь не 5, а 4 атома углерода, но зато есть метил-радикал. Если посчитаем число атомов углерода и водорода в полученном соединении (которое имеет название 2-метилбутадиен-1,3) и пентадиене-1,3, то выяснится, что их количество одинаково. Помним, что такой вид изомерии называется структурной (стрелочка 2).
- Сделаем так, что теперь в соединении вообще не будет никаких двойных связей, но зато будет 1 тройная. Посчитаем атомы углеродов и водородов. Получилось, что их ровно столько же, сколько и в пентадиене-1,3. Углеводород с 1 тройной связью – это один из отдельных классов углеводородов. А теперь вспомним, как называется вид изомерии, когда вещества относятся к разным классам, но имеют одинаковый состав? Если забыли, то ответ: межклассовая изомерия (стрелочка 3).
- Теперь немного поиграем с расположением атомов водорода и у атомов при одной из двойных связей. Если оба атома водорода будут, например, только снизу, то это цис-пентадиен-1,3. Если один атом водорода снизу, а второй сверху относительно двойной связи, то это транс-пентадиен-1,3. Такая изомерия называется пространственной (стрелочки 4 и 5).
Номенклатура алкадиенов
Выше уже были даны названия некоторым диенам, например пентадиен-1,3, 2-метилбутадиен-1,3 и другие. Почему их называют именно так? Есть ли какие-то закономерности? Если внимательно присмотримся к строению диенов и вспомним уроки 2 и 3, где рассказывалось про номенклатуры алканов и алкенов, то сразу станет понятно, что названия даются таким образом, чтобы учесть число атомов в самой длинной углеродной цепочке, наличие заместителей, и расположение кратных связей.
Сравним известный нам из третьего урока пентен-1 и пентадиен-1,3. Структурные формулы этих соединений выглядят так:
Что видим общего? И там и там атомы пронумерованы с того конца, где расположение кратных связей ближе. В углеродных цепочках по 5 атомов углерода (а из второго урока помним, что 5 – это корень пент-..). Названия оканчиваются суффиксом –ен, и через дефис в конце указывается, от каких атомов углерода берет начало двойная связь.
Какие видим различия? То, что в названии диена перед –ен стоит частичка ди, и корень не просто пент-, а пента-.
В органической химии, если в соединении несколько кратных связей, то в названии прописывается их количество, но только не по-русски, а по-древнегречески. Вспомним, что тоже самое делалось, когда давалось название сложному алкану, у которого было много одинаковых заместителей и нужно было указать их число (например 2,5,6,7-тетраметилдекан).
Точно также указывается количество двойных связей, но не перед корнем, а перед суффиксом. В алкадиенах их всегда две, а значит и все названия диенов будут оканчиваться одинаково: вот-такой диен. И обязательно указать, у каких атомов берут начало кратные связи в конце названия через запятые. Например: октадиен-1,2; гептадиен-2,5 илинонадиен-4,8.
Номенклатура диенов с заместителями строится по такому же принципу, как и у алкенов с заместителями, но только нужно помнить про разницу, указанную выше. Если забыли эту тему – срочно открывайте третий урок по органической химии, а если помним, то смотрим таблицу с номенклатурой алкадиенов для закрепления знаний.
Таблица 1. — Номенклатура алкадиенов
Физические свойства алкадиенов
Пропадиен и бутудиен по агрегатному состоянию – газы.
Диены, в составе которых от 5 до 17 атомов углерода, относятся к легкокипящим бесцветным жидкостям, температуры кипения и плавления некоторых представлены в таблице ниже. Выше 18 атомов углерода – твердые вещества.
Получение сопряженных алкадиенов
В органической химии большой интерес вызывают диены с сопряженными кратными связями, строение которых рассматривалось выше. Поэтому ниже будет повествование о способах синтеза и химических свойствах соединениях именно этого типа.
Рассмотрим способы получения алкадиенов
- Реакция Лебедева С.В. В 1928 году в мире наступала эпоха, когда люди хотели получать резину не из природных материалов, а с помощью химических превращений из дешевых реагентов. Такой интерес был вызван тем, что началось развитие машиностроения, и необходимо было добывать материалы, которые использовались бы для создания шин. Изначально такие материалы делались только в странах, где росло особое дерево – гевея, сок которого отверждался на воздухе и превращался в гибкий материал (рисунок 3). Но такое дерево может расти не везде, а кататься на машинах хотелось всем, вот и придумали особый способ получения вещества, которое впоследствии превращалось в резину.
Такой способ включает в себя одновременно 2 реакции: дегидрирование и дегидратацию (что это за реакции было подробно рассказано на 2 и 3 уроках).
Реакция Лебедева записывается следующим образом:

- Дегидратация гликолей в присутствии серной кислоты. Чтобы получить сопряженный диен данным методом, необходимо подобрать правильно гликоль.
На представленном ниже рисунке видно, какая у него должна быть структурная формула: фрагмент углеродной цепи, где позже будут находиться сопряженные двойные связи, должен содержать 4 атома углерода (каждый из них пронумерован), причем ОН-группы стоят именно у 1 и 4 атомов углерода. Помимо этого, у 2 и 3 атомов углерода обязательно должны стоять атомы водородов (хотя бы по 1 штуке).
При протекании реакции у 1 и 4 атомов углерода разрушаются связи С-ОН, а у 2 и 3 разрушаются связи С-Н, что видно на рисунке ниже.
После этого начинают образовываться связи между 1 и 2, 3 и 4 атомами углерода, а также между атомами водорода и ОН-группами, что показано на рисунке ниже.
Вещество Н-ОН – это не что иное, как Н2О, т.е. молекула воды, которая является побочным продуктом данной реакции.
Если совместим первый и последний рисунки, добавим условия реакции, то получим схему образования диена с помощью дегидратации гликолей:
- Получение из дигалогеналканов.
Теперь рассмотрим схему получения сопряженных диенов из дигалогеналканов, которая изображена вверху рисунка, который представлен ниже. Как и в случае с гликолями, фрагмент углеродной цепочки, где будут двойные связи, должен содержать 4 атома углерода, только теперь вместо ОН-групп у 1 и 4 атомов углеродов стоят заместители-галогены (хлор, бром или иод).При протекании реакции происходит разрыв связей между атомами галогена и углерода, а также водорода и углерода (как показано на нижнем рисунке).
Затем происходит образование двойных связей и образование молекул галогенводородов (в данном случае хлороводорода НСl). Галогенводород взаимодействует с щелочью, в результате чего получается соль и вода.
Реакции присоединения сопряженных диенов
Один вариант присоединений выглядит следующим образом: в диене есть 2 двойные связи, и между ними находится одинарная. После протекания реакции там, где были двойные связи(т.е. между 1 и 2, 3 и 4 атомами углерода), появляются одинарные, а там, где стояла одинарная (т.е. между 2 и 3 атомами углерода) – появляется двойная. Вещество А-Б распадается на 2 части (на частичку А и частичку Б), которые присоединяются к 1 и 4 атомам углерода, как это показано на рисунке ниже.
Рассмотрим, как к молекуле диена присоединяются галогены, водород и вода.
- Качественная реакция диенов – галогенирование. Аналогично, как и алкены, диены могут взаимодействовать с бромной водой, обесцвечивая ее. Но в этом уроке рассмотрим взаимодействие диена с чистым хлором.
- Гидрирование. На платиновом или никелевом катализаторе диен превращается в алкен. Можно правильно заметить, что получившийся алкен также может подвергаться реакции гидрирования, образуя насыщенный углеводород.
- Гидратация. Эта реакция проходит в кислой среде, например в присутствии серной кислоты. Молекула воды разрывается по связи Н-ОН на 2 частички, которые присоединяются к диену в соответствии с вышеупомянутым правилом.
Также есть еще один вариант протекания реакций присоединения: в этом случае вещество А-Б присоединяется только к 1 из кратных связей, как показано на схеме ниже. Такой вариант присоединения на практике хоть и встречается, но очень редко (например, при взаимодействии 10 молекул бутадиена с бромом, 8 молекул превратятся в 1,4-дибромбутен-2, и только 2 молекулы в 3,4-дибромбутен-1).
Реакции полимеризации и горения
При полимеризации сопряженных диенов происходит тоже самое, что и при реакциях присоединения: одинарная связь между кратными превращается в двойную, а кратные становятся одинарными. Рассмотрим пример образования полимера из диена. Условия реакции – использование катализатора (например, хлороводородной кислоты) и повышенной температуры. Помним, что n – большое число молекул, например 200 или даже 1000.
При горении диенов в кислороде образуются углекислый газ и вода. Общая формула горения диенов выглядит так:
Воспользуемся формулой и определим коэффициенты в реакции горения гептадиена-1,5:
Применение алкадиенов
Основная область применения диенов – органический синтез, цель которого получить каучуки с определенным набором свойств. Каучуки – это полимерные материалы, обладающие упругостью, из которых впоследствии делают резину.
Видео
Применение
Алкадиены применяют в области промышленности с целью получения синтетического каучука.
Диеновые, имеющие две двойные связи в составе молекулы, терпены – достаточно широко известны. Их можно обнаружить в растительном организме, обладающим приятным запахом.
Источник