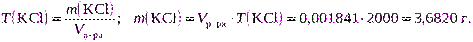СПОСОБЫ ПРИГОТОВЛЕНИЯ РАСТВОРОВ
Дата добавления: 2014-10-02 | Просмотров: 9907
Известны четыре способа приготовления растворов: по точной навеске, по приблизительной навеске, разбавлением и из фиксанала. Способ приготовления раствора зависит от свойств растворяемых веществ. Навеску вещества, как правило, не используют, если вещество является жидким. Разбавлением можно готовить растворы всех веществ, если в наличии есть более концентрированные растворы. Четвертый способ используют только в том случае, если фиксаналы этих веществ выпускаются промышленностью. Рассмотрим основные этапы приготовления растворов различными способами.
По точной навескеготовят только растворы стандартных веществ (см. критерии стандартности на с. 8). Для приготовления растворов этим способом должны быть заданы концентрация раствора и его объем. Основные этапы приготовления растворов следующие:
— рассчитывают необходимую навеску для взвешивания с точностью до 0,0001 г с использованием формул (4.2)-(4.13) (см. с. 21-24);
— взвешивают точную навеску на аналитических весах;
— взвешенную навеску растворяют, количественно переносят в мерную колбу вместимостью, равной Vр-ра, доводят до метки дистиллированной водой и перемешивают;
— если взятая навеска (mпракт) отличается от теоретически рассчитанной, то концентрацию раствора пересчитывают, используя указанные выше формулы, например:


Приготовленные таким образом растворы называют первичными стандартами.
Запомните: если объем приготавливаемого раствора больше 2 дм 3 , то расчеты массы навески ведут с точностью не более чем до 0,01 г, независимо от стандартности вещества, и берут ее на технических весах, так как максимальная вместимость мерных колб, выпускаемых промышленностью, равна 2 дм 3 .
По приблизительной навеске готовят растворы нестандартных веществ. Если вещество, которое используют для анализа, содержит примеси (более 1 %), вещество квалифицируют «ч.» или «техн.» (см. с. 8) и его массу рассчитывают с учетом имеющихся примесей. Этапы работы такие же, как и при приготовлении растворов по точной навеске, но навеску рассчитывают с точностью не более чем до 0,01 г и берут ее на технических весах. Точную концентрацию такого раствора устанавливают титрованием (часто растворами первичных стандартов) и рассчитывают ее по закону эквивалентов:

Приготовленные таким образом растворы с точно установленной концентрацией называются вторичными стандартами, или титрованными.
Из фиксанала (норма-дозы, стандарт-титра) готовят растворы точной концентрации. Фиксанал — стеклянная или полимерная ампула, в которой содержится точно известное количество вещества в сухом виде или в виде раствора. Содержимое фиксанала количественно переносят в мерную колбу, после растворения вещества доводят уровень раствора до метки и перемешивают. Концентрация раствора должна быть задана, а вместимость мерной колбы рассчитывают, используя формулу:


Разбавлением концентрированных растворовготовят растворы многих веществ. В этом случае должны быть заданы объем разбавленного раствора, его концентрация и концентрация концентрированного раствора. Рассчитывают необходимый для разбавления объем концентрированного раствора, затем измеряют рассчитанный объем, переносят в мерную колбу или в мерный стакан, доводят уровень жидкости до метки дистиллированной водой и перемешивают.
Запомните: при разбавлении водой масса (или количество) растворенного вещества одинаковы в концентрированном и разбавленном растворах.
Если исходный раствор имел точную концентрацию и при его разбавлении использовали точную мерную посуду, то получают раствор точной концентрации. В противном случае получают раствор приблизительной концентрации, все расчеты концентраций ведут с точностью не более чем до 0,01 и точную концентрацию устанавливают титрованием. Эти правила справедливы и при смешивании растворов.
При использовании материала ссылка на сайт Конспекта.Нет обязательна! (0.035 сек.)
Источник
СПОСОБЫ ПРИГОТОВЛЕНИЯ РАСТВОРОВ
Известны четыре способа приготовления растворов: по точной навеске, по приблизительной навеске, разбавлением и из фиксанала. Способ приготовления раствора зависит от свойств растворяемых веществ. Навеску вещества, как правило, не используют, если вещество является жидким. Разбавлением можно готовить растворы всех веществ, если в наличии есть более концентрированные растворы. Четвертый способ используют только в том случае, если фиксаналы этих веществ выпускаются промышленностью. Рассмотрим основные этапы приготовления растворов различными способами.
По точной навескеготовят только растворы стандартных веществ (см. критерии стандартности на с. 8). Для приготовления растворов этим способом должны быть заданы концентрация раствора и его объем. Основные этапы приготовления растворов следующие:
— рассчитывают необходимую навеску для взвешивания с точностью до 0,0001 г с использованием формул (4.2)-(4.13) (см. с. 21-24);
— взвешивают точную навеску на аналитических весах;
— взвешенную навеску растворяют, количественно переносят в мерную колбу вместимостью, равной Vр-ра, доводят до метки дистиллированной водой и перемешивают;
— если взятая навеска (mпракт) отличается от теоретически рассчитанной, то концентрацию раствора пересчитывают, используя указанные выше формулы, например:


Приготовленные таким образом растворы называют первичными стандартами.
Запомните: если объем приготавливаемого раствора больше 2 дм 3 , то расчеты массы навески ведут с точностью не более чем до 0,01 г, независимо от стандартности вещества, и берут ее на технических весах, так как максимальная вместимость мерных колб, выпускаемых промышленностью, равна 2 дм 3 .
По приблизительной навеске готовят растворы нестандартных веществ. Если вещество, которое используют для анализа, содержит примеси (более 1 %), вещество квалифицируют «ч.» или «техн.» (см. с. 8) и его массу рассчитывают с учетом имеющихся примесей. Этапы работы такие же, как и при приготовлении растворов по точной навеске, но навеску рассчитывают с точностью не более чем до 0,01 г и берут ее на технических весах. Точную концентрацию такого раствора устанавливают титрованием (часто растворами первичных стандартов) и рассчитывают ее по закону эквивалентов:

Приготовленные таким образом растворы с точно установленной концентрацией называются вторичными стандартами, или титрованными.
Из фиксанала (норма-дозы, стандарт-титра) готовят растворы точной концентрации. Фиксанал — стеклянная или полимерная ампула, в которой содержится точно известное количество вещества в сухом виде или в виде раствора. Содержимое фиксанала количественно переносят в мерную колбу, после растворения вещества доводят уровень раствора до метки и перемешивают. Концентрация раствора должна быть задана, а вместимость мерной колбы рассчитывают, используя формулу:


Разбавлением концентрированных растворовготовят растворы многих веществ. В этом случае должны быть заданы объем разбавленного раствора, его концентрация и концентрация концентрированного раствора. Рассчитывают необходимый для разбавления объем концентрированного раствора, затем измеряют рассчитанный объем, переносят в мерную колбу или в мерный стакан, доводят уровень жидкости до метки дистиллированной водой и перемешивают.
Запомните: при разбавлении водой масса (или количество) растворенного вещества одинаковы в концентрированном и разбавленном растворах.
Если исходный раствор имел точную концентрацию и при его разбавлении использовали точную мерную посуду, то получают раствор точной концентрации. В противном случае получают раствор приблизительной концентрации, все расчеты концентраций ведут с точностью не более чем до 0,01 и точную концентрацию устанавливают титрованием. Эти правила справедливы и при смешивании растворов.
Живите по правилу: МАЛО ЛИ ЧТО НА СВЕТЕ СУЩЕСТВУЕТ? Я неслучайно подчеркиваю, что место в голове ограничено, а информации вокруг много, и что ваше право.
Что делает отдел по эксплуатации и сопровождению ИС? Отвечает за сохранность данных (расписания копирования, копирование и пр.).
Что способствует осуществлению желаний? Стопроцентная, непоколебимая уверенность в своем.
ЧТО ПРОИСХОДИТ ВО ВЗРОСЛОЙ ЖИЗНИ? Если вы все еще «неправильно» связаны с матерью, вы избегаете отделения и независимого взрослого существования.
Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте:
Источник
Способы приготовления растворов
Существует несколько способов приготовления растворов. По способу приготовления различают первичные и вторичные стандартные растворы.
1.
По точной навескеготовят первичные стандартные растворы, растворы стандартных установочных веществ, которые должны удовлетворять следующим требованиям:
а) состав их должен строго соответствовать химической формуле;
б) вещества должны быть устойчивыми при хранении в растворе и в сухом виде (не окисляться, не поглощать диоксид углерода, воду, не терять кристаллизационную воду);
в) величина молярной массы эквивалента должна быть по возможности наибольшей для уменьшения погрешности взвешивания и титрования.
При приготовлении растворов по точной навеске задаются концентрацией раствора и его объемом. Основные этапы работы:
- рассчитывают необходимую навеску для взвешивания с точностью до 0,0001 г по одной из формул:
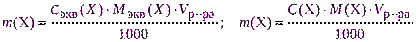
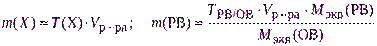
где Vр-ра – объем раствора, см 3 ;
- взвешивают точную навеску на аналитических весах;
- взвешенную навеску количественно переносят в мерную колбу вместимостью, равной Vр-ра, растворяют вещество, доводят до метки дистиллированной водой и перемешивают;
- если взятая навеска отличается от теоретически рассчитанной, то концентрацию раствора пересчитывают, используя указанные выше формулы, например:
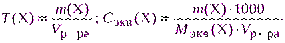
где Vр-ра – объем раствора, см 3 ; m(Х) – практическая навеска, г.
2.
По приблизительной навескеготовят растворы нестандартных веществ или растворы приблизительной концентрации. Этапы работы такие же, как и при приготовлении растворов по точной навеске, но навеску рассчитывают с точностью не более, чем до 0,01 г и берут ее на технических весах. Точную концентрацию такого раствора устанавливают титрованием (часто растворами первичных стандартов) и рассчитывают по закону эквивалентов:
Сэкв 1·V1 = Cэкв 2·V2 (2.16)
Приготовленные таким образом растворы с точно установленной концентрацией называются вторичными стандартами или титрованными.
3.
Из фиксанала (норма-дозы, стандарт-титра)готовят первичные стандартные растворы точной концентрации. Фиксанал – стеклянная ампула, в которой содержится точно известное количество nэкв вещества в кристаллическом виде или в виде раствора. Содержимое фиксанала количественно переносят в мерную колбу, доводят уровень раствора до метки, раствор перемешивают. Концентрация раствора должна быть задана, а вместимость мерной колбы рассчитывают, используя формулу (2.6).
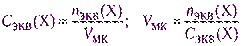
4.
Разбавлением концентрированных растворовготовят растворы многих веществ. В этом случае должны быть заданы объем разбавленного раствора, его концентрация и концентрация концентрированного раствора. Рассчитывают необходимый для разбавления объем концентрированного раствора, затем измеряют рассчитанный объем, переносят в мерную колбу или в мерный стакан, доводят уровень жидкости до метки дистиллированной водой и перемешивают. Если исходный раствор имел точную концентрацию и при его разбавлении использовали точную мерную посуду, то получают раствор точной концентрации. В противном случае получают раствор приблизительной концентрации, все расчеты ведут с точностью не более чем до 0,01, точную концентрацию устанавливают титрованием и рассчитывают по формуле (2.16).
Пример.Сколько грамм хлорида калия KCl потребуется для приготовления 2 дм 3 раствора:
а) с массовой долей, равной 30% и плотностью 1,110 г/см 3 ;
б) с титром, равным 0,001841 г/см 3 ;
в) с молярной концентрацией эквивалента, равной 0,2000 моль/дм 3 .
Решение.
| Дано: ω(KCl) = 30% | а) Массу хлорида калия рассчитаем, используя формулу (2.11): |
| Vр-ра= 2 дм 3 = 2000 см 3 ρ р-ра = 1,110 г/см 3 | 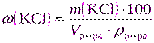 |
| Сэкв(KCl) = 0,2000 моль/дм 3 T(KCl) = 0,001841 г/см 3 |  |
| m(KCl) = ? |
б) Для расчета используем формулу (2.12):
в) Для расчета можно использовать формулу (2.7):
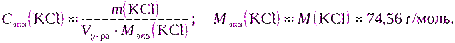
m(KCl) = Cэкв(KCl) · Vр-ра · Mэкв(KCl) = 0,2000·2·74,56 = 29,8240 г.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Источник