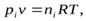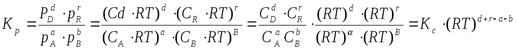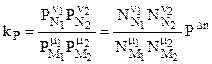Различные способы выражения константы равновесия. Влияние давления на константу равновесия. Правило Брауна
Способы выражения константы равновесия
Константа равновесия может быть выражена различными способами. Если концентрации веществ, участвующих в реакции, выражены в молярных единицах молярности , т.е. в моль/л, то она обычно обозначается Кс и для равновесия обратимой реакции
записывается в виде:

Для гомогенной газовой реакции константу равновесия удобнее выразить через парциальные давления веществ:

Иногда константу равновесия удобно выразить не через парциальные давления и концентрации, а через количества веществ:

или через соответствующие мольные доли:

В общем случае константы равновесия Кс, Кр, Кn и КN различны по значениям. Установим связь между ними.
В газовых системах, для характеристики которых применимо уравнение состояния идеальных газов Менделеева – Клайперона, значение парциального давления любого компонента можно вычислить следующим образом:


где C – концентрация i-го компонента, выраженная в моль/л. Подставим значение р из уравнения (2.8) в уравнение (2.5) и получим соотношение, которым определяется связь Кс и Кр:
или 
где 
Для идеальных газов парциальные давления связаны с общим давлением Робщ и мольной долей Ni данного компонента в смеси согласно законам Дальтона следующим равенством:
где рi – парциальное давление компонента; Ni – мольная доля этого компонента в смеси; Робщ – общее давление.
Подставим значение рi в уравнение (2.5), получим:
Воспользовавшись соотношением Pi = Ni∙ Робщ = 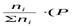
где ni – число моль компонента inåв смеси, а i – число моль всех компонентов в смеси, получаем:


Таким образом, если Dn≠ 0, т.е. если реакция сопровождается изменением числа моль, то имеет место соотношение:

Если же ∆n=0 (реакция не сопровождается изменением числа моль), то Кр = Кс = Кn = KN, т.е. значения всех видов констант равновесия совпадают.
Кр и Кс для реакции идеальных газов не зависят от давления. КN и Кn от давления зависят в случае ∆n≠0.
Принцип ЛеШателье Брауна: если систему, находящуюся в равновесии подвергнуть какому–либо внешнему воздействию, то система будет компенсировать это внешнее воздействие.
Под влиянием внешних воздействий или при изменении условий существования системы состояние равновесия изменяется и может наступить новое состояние равновесия, при этом сдвиг его влево или вправо устанавливается принципом Ле-Шателье_-Брауна:
Если на систему, находящуюся в равновесии, оказать воздействие извне, то возникает такое смещение равновесия. которое ослабляет это воздействие.
Поясним на примере.
Если давление увеличится, то равновесие сдвинется слева направо, так как эта реакция протекает с уменьшением объема.
А уменьшение объема вызовет снижение давления ( произойдет уменьшение количества молекул в реагирующей смеси), т. е. идет ослабление внешнего воздействия.
Дата добавления: 2018-04-04 ; просмотров: 1320 ; Мы поможем в написании вашей работы!
Источник
Связь между различными формами выражения констант равновесия.
Константа химического равновесия может быть выражена различными способами. Если Кравн выражается через равновесные концентрации, то она обозначается Кс и рассчитывается по уравнению:

Если реакция протекает в газовой фазе, то константу равновесия можно выразить через равновесные парциальные давления участников реакции:
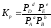
Константу равновесия можно выразить через числа молей (n) участников реакции:
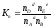
и их мольную долю (N):
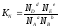
Учитывая соотношение между парциальными давлением (Рi, н/м), концентрацией (Сi, моль/м 3 ), числом молей (ni) и мольной долей (Ni) i – компонента.
Рi = Ci RT = NiPобщ = 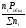
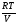
можно вывести формулы связи констант равновесия, выраженных различным способом:
Кр = Кn 
n равна разности между стехиометрическими коэффициентами конечных и начальных газообразных веществ в соответствии с уравнениями реакции и определяется по уравнению: n = е + d – a – b.
Таким образом, если n 0 и реакция сопровождается изменением числа молей, то имеет место соотношение:
Кр = Кс(RT) n = KNPобщ n = Kn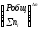

Константы равновесия Кn и KN зависят от общего давления. Если n = 0, то все константы равновесия численно равны друг другу при любом способе их вычисления:
10. Химическое равновесие в гетерогенных системах. Расчет константы равновесия. Химическое сродство как мера реакционноспособности системы. Изотерма Вант-Гоффа. Нормальное химическое сродство.
Химическое равновесие в гетерогенных системах. Расчет константы равновесия.
При выводе закона действующих масс для гомогенных химических реакций предполагается, что все участники реакции находятся в газообразном состоянии. Если система гетерогенная, то есть в реакции участвуют жидкие и твёрдые вещества (так называемые конденсированные фазы), не образующие растворов друг с другом, то при данной температуре парциальные давления указанных компонентов являются величинами малыми и постоянными, так как давление насыщенного пара данных веществ при заданной температуре является постоянным.
Эти постоянные величины давлений пара можно внести в константу равновесия, и она, таким образом, будет определяться только равновесными парциальными давлениями газообразных участников реакций. Для реакции FeO+COFe+CO2
Константа равновесия запишется так:
Кр=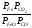
Перенесём парциальные давления твёрдых компонентов в левую часть уравнения и обозначая постоянную её через Кр’, получим Кр’= Кр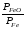
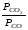
Кр’ =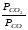
Рассмотрим другой пример: термическую диссоциацию (разложения) карбоната кальция:
Напишем формулу для расчёта константы равновесия данной гетерогенной реакции как для гомогенной:
Кр=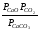
Внеся РСаОи РСаСОв константу равновесия, получим Кр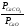
Кр’ =
Если 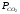
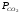
Таким образом, константа равновесия гетерогенной системы определяется парциальным давлением только лишь газообразных компонентов.
Давление газообразного продукта рассмотренной реакции называютупругостью диссоциации. Следовательно, упругость диссоциации при определённой температуре в каждом конкретном случае (термической диссоциации карбонатов, бикарбонатов, кристаллогидратов) является совершенно определённой величиной.
Источник
Различные формы констант равновесия и связь между ними.

Кроме того константу равновесия можно выразить через парциальные давления реагирующих веществ:

Константу равновесия можно выразить через числа молей веществ — участников реакции:

Константу равновесия можно выразить и через мольные доли участников реакции:

В общем случае kC 


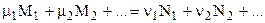


где 
Для идеальных газов их парциальные давления связаны с общим давлением соотношением:



Уравнение изотермы химической реакции.
Химическое сродство.
Для реакции (4.87) ход рассуждений, использованный в параграфе 12 в условиях V, T=const дает:

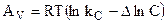
где 
которой умножено на соответствующий коэффициент.
Замена концентраций парциальными давлениями дает в условиях P, T = const:

Уравнения (4.92) и (4.93) — уравнения изотермы химической реакции или уравнения Вант-Гоффа.
Способность различных веществ взаимодействовать между собой с образованием новых веществ была замечена давно и получила наименование химического сродства. Критерий оценки химического сродства был найден не сразу. Несостоятельным оказалось предположение о равенстве теплового эффекта реакции и сродства.
Голландский физико — химик Вант-Гофф предложил новую теорию химического сродства, которая, не объясняя его природу, дает возможность количественно оценить его: в качестве мерила химического сродства предложено использовать полную максимальную работу реакции, если реакция протекает при V = const:
или максимальную полезную работу, если реакция протекает в условиях p = const:
где значения AV и AP могут быть рассчитаны и по уравнениям изотермы химической реакции (4.94).
Для того, чтобы иметь возможность сравнивать сродство различных веществ, было введено понятие нормального (стандартного) сродства.
К уравнению нормального сродства легко подойти, если начальные парциальные давления или концентрации реагентов равны единице.


Сравнивая 

Замечание. Для растворов правильнее пользоваться не молярными концентрациями (Сi) в случае расчета химического сродства, а мольными долями компонентов.
Направление реакций и условие равновесия.
Если начальные парциальные давления или концентрации реагирующих газов совпадают с равновесными, то 
Чем более далеки парциальные давления или концентрации реагентов от равновесных, тем больше величина работы, выше сродство, как это следует из уравнения изотермы химической реакции. Согласно этому же уравнению реакция идет в направлении, указанном ее уравнением, если 
Реакция пойдет в обратном направлении, если 
Чем больше АР(V), тем больше kP(C) и тем дальше пойдет реакция при заданных начальных парциальных давлениях (или концентрациях), так как большим kP(C) отвечают большие значения равновесных концентраций конечных продуктов реакции (числитель) и малые равновесные концентрации остающихся исходных продуктов реакции (знаменатель). Поэтому очевидно, что константа равновесия химической реакции однозначно определяет полноту протекания химической реакции.
Зависимость константы равновесия
От температуры и давления.
Полученные сведения о равновесии можно дополнить, установив зависимость константы равновесия от температуры и давления. Дифференцирование уравнения (4.93) по температуре дает:

Полученное выражение и значение АР из уравнения (4.93) необходимо ввести в уравнение Гиббса — Гельмгольца:

откуда после упрощений:
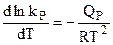

Или, учитывая соотношения 

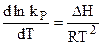
Полученные уравнения вида (4.95) и (4.96) — это уравнения изобары и изохоры химической реакции, устанавливающие зависимость константы равновесия химической реакции от температуры.
Интегрирование уравнений (4.95) и (4.96) в обобщенной форме их записи позволяет получить точное решение в виде:

Если предположить, что Q 

Из (4.98) видно, что 
Источник