- Получение кислорода
- История открытия кислорода
- Способы получения и собирания кислорода в лаборатории
- 1) Разложение оксида ртути (II)
- 2) Разложение перманганата калия
- Разложение пероксида водорода
- Разложение хлората калия
- Разложение нитратов
- Получение кислорода в промышленности
- Как получают кислород в промышленности
- Как добывают кислород в промышленности. 3 метода
- Технические особенности оборудования для получения кислорода в промышленности
- Получение кислорода в промышленности — основные способы и технология производства
- Основные свойства
- Способы получения
- Применение вещества
Получение кислорода
История открытия кислорода
Открытие кислорода ознаменовало новый период в развитии химии. С глубокой древности было известно, что для горения необходим воздух. Процесс горения веществ долгое время оставался непонятным. В эпоху алхимии широкое распространение получила теория флогистона, согласно которой вещества горят благодаря их взаимодействию с огненной материей, то есть с флогистоном, который содержится в пламени. Кислород был получен английским химиком Джозефом Пристли в 70-х годах XVIII века. Химик нагревал красный порошок оксида ртути (II), в итоге вещество разлагалось, с образованием металлической ртути и бесцветного газа:
Оксиды – бинарные соединения, в состав которых входит кислород При внесении тлеющей лучины в сосуд с газом она ярко вспыхивала. Ученый считал, что тлеющая лучина вносит в газ флогистон, и он загорается. Д. Пристли пробовал дышать полученным газом, и был восхищен тем, как легко и свободно им дышится. Тогда ученый и не предполагал, что удовольствие дышать этим газом предоставлено каждому. Результатами своих опытов Д. Пристли поделился с французским химиком Антуаном Лораном Лавуазье.
Имея хорошо оснащенную на то время лабораторию, А. Лавуазье повторил и усовершенствовал опыты Д. Пристли. А. Лавуазье измерил количество газа, выделяющееся при разложении определенной массы оксида ртути. Затем химик нагрел в герметичном сосуде металлическую ртуть до тех пор, пока она не превратилась в оксид ртути (II). Он обнаружил, что количество выделившегося газа в первом опыте равно газу, поглотившемуся во втором опыте. Следовательно, ртуть реагирует с каким-то веществом, содержащимся в воздухе. И это же вещество выделяется при разложении оксида. Лавуазье первым сделал вывод, что флогистон здесь совершенно ни при чем, и горение тлеющей лучины вызывает именно неизвестный газ, который в последствии был назван кислородом. Открытие кислорода ознаменовало крах теории флогистона!
Способы получения и собирания кислорода в лаборатории
Лабораторные способы получения кислорода весьма разнообразны. Существует много веществ, из которых можно получить кислород. Рассмотрим наиболее распространенные способы.
1) Разложение оксида ртути (II)
Одним из способов получения кислорода в лаборатории, является его получение по описанной выше реакции разложения оксида ртути (II). Ввиду высокой токсичности соединений ртути и паров самой ртути, данный способ используется крайне редко.
2) Разложение перманганата калия
Перманганат калия (в быту мы называем его марганцовкой) – кристаллическое вещество темно-фиолетового цвета. При нагревании перманганата калия выделяется кислород. В пробирку насыплем немного порошка перманганата калия и закрепим ее горизонтально в лапке штатива. Недалеко от отверстия пробирки поместим кусочек ваты. Закроем пробирку пробкой, в которую вставлена газоотводная трубка, конец которой опустим в сосуд- приемник. Газоотводная трубка должна доходить до дна сосуда-приемника. Ватка, находящаяся около отверстия пробирки нужна, чтобы предотвратить попадание частиц перманганата калия в сосуд-приемник (при разложении выделяющийся кислород увлекает за собой частички перманганата). Когда прибор собран, начинаем нагревание пробирки. Начинается выделение кислорода.
Уравнение реакции разложения перманганата калия:
2KMnO4 t° → K2MnO4 + MnO2 + O2↑
Как обнаружить присутствие кислорода? Воспользуемся способом Пристли. Подожжем деревянную лучину, дадим ей немного погореть, затем погасим, так, чтобы она едва тлела. Опустим тлеющую лучину в сосуд с кислородом. Лучина ярко вспыхивает! Газоотводная трубка была не случайно опущена до дна сосуда-приемника. Кислород тяжелее воздуха, следовательно, он будет собираться в нижней части приемника, вытесняя из него воздух. Кислород можно собрать и методом вытеснения воды. Для этого газоотводную трубку необходимо опустить в пробирку, заполненную водой, и опущенную в кристаллизатор с водой вниз отверстием. При поступлении кислорода газ вытесняет воду из пробирки.
Разложение пероксида водорода
Пероксид водорода – вещество всем известное. В аптеке оно продается под названием «перекись водорода». Данное название является устаревшим, более правильно использовать термин «пероксид». Химическая формула пероксида водорода Н2О2 Пероксид водорода при хранении медленно разлагается на воду и кислород. Чтобы ускорить процесс разложения можно произвести нагрев или применить катализатор.
Катализатор – вещество, ускоряющее скорость протекания химической реакции
Нальем в колбу пероксид водорода, внесем в жидкость катализатор. Катализатором может служить порошок черного цвета – оксид марганца MnO2. Тотчас смесь начнет вспениваться вследствие выделения большого количества кислорода. Внесем в колбу тлеющую лучину – она ярко вспыхивает. Уравнение реакции разложения пероксида водорода:
2H2O2 MnO2 → 2H2O + O2↑
Обратите внимание: катализатор, ускоряющий протекание реакции, записывается над стрелкой, или знаком «=», потому что он не расходуется в ходе реакции, а только ускоряет ее.
Разложение хлората калия
Хлорат калия – кристаллическое вещество белого цвета. Используется в производстве фейерверков и других различных пиротехнических изделий. Встречается тривиальное название этого вещества – «бертолетова соль». Такое название вещество получило в честь французского химика, впервые синтезировавшего его, – Клода Луи Бертолле. Химическая формула хлората калия KСlO3. При нагревании хлората калия в присутствии катализатора – оксида марганца MnO2, бертолетова соль разлагается по следующей схеме:
2KClO3 t°, MnO2 → 2KCl + 3O2↑.
Разложение нитратов
Нитраты – вещества, содержащие в своем составе ионы NO3⎺. Соединения данного класса используются в качестве минеральных удобрений, входят в состав пиротехнических изделий.
Нитраты – соединения термически нестойкие, и при нагревании разлагаются с выделением кислорода:
Обратите внимание, что все рассмотренные способы получения кислорода схожи. Во всех случаях кислород выделяется при разложении более сложных веществ.
Реакция разложения – реакция, в результате которой сложные вещества разлагаются на более простые В общем виде реакцию разложения можно описать буквенной схемой:
Реакции разложения могут протекать при действии различных факторов. Это может быть нагревание, действие электрического тока, применение катализатора. Существуют реакции, в которых вещества разлагаются самопроизвольно.
Получение кислорода в промышленности
В промышленности кислород получают путем выделения его из воздуха.
Воздух – смесь газов, основные компоненты которой представлены в таблице.
Сущность этого способа заключается в глубоком охлаждении воздуха с превращением его в жидкость, что при нормальном атмосферном давлении может быть достигнуто при температуре около -192°С. Разделение жидкости на кислород и азот осуществляется путем использования разности температур их кипения, а именно: Ткип.
N2 = -196°С (при нормальном атмосферном давлении).
При постепенном испарении жидкости в газообразную фазу в первую очередь будет переходить азот, имеющий более низкую температуру кипения, и, по мере его выделения, жидкость будет обогащаться кислородом. Многократное повторение этого процесса позволяет получить кислород и азот требуемой чистоты. Такой способ разделения жидкостей на составные части называется ректификацией жидкого воздуха.
- В лаборатории кислород получают реакциями разложения
- Реакция разложения – реакция, в результате которой сложные вещества разлагаются на более простые
- Кислород можно собрать методом вытеснения воздуха или методом вытеснения воды
- Для обнаружения кислорода используют тлеющую лучину, она ярко вспыхивает в нем
- Катализатор – вещество, ускоряющее химическую реакцию, но не расходующееся в ней
Источник
Как получают кислород в промышленности
В атмосферном воздухе кислород занимает 21%. Большая часть его находится в земной коре, пресной воде и живых микроорганизмах. Он применяется во многих сферах промышленности и задействуется для хозяйственных и медицинских потребностей. Востребованность вещества обусловлена химическими и физическими особенностями.
Как добывают кислород в промышленности. 3 метода
Производство кислорода в промышленности осуществляется за счет деления атмосферного воздуха. Для этого задействуются следующие методы:
- Мембранный. Основывается на проницаемости мембран в хаотичном порядке. Его суть сводится к разной скорости проникновения газов через мембрану, выполненную из полимерных материалов при смене парциального давления. Чистая воздушная масса, которая предварительно сжимается, направляется в мембрану. Газы быстрого типа просачиваются через мембрану в область с невысоким рабочим давлением и в зоне выхода впитывают компонент, отличающийся легкостью проникновения. Остальное количество воздуха обогащается медленным газом и удаляется с агрегата. Преимущества такого метода заключается в экономии электроэнергии и незатратной эксплуатации мембранных установок. С его помощью получаемый кислород отличается чистотой в пределах 45% .
- Адсорбционный. Базируется на зависимости поглощения элемента газовой смеси от парциального давления и температурного режима. Процесс поглощения осуществляется за счет предусмотренных молекулярных сит с применением периодической адсорбции. Его регулировка происходит благодаря смене давления и температуры. Зависимость свойств адсорбента от поглотительных способностей элемента газа является пропорциональной давлению. Данный метод, который объясняет, как получают кислород в промышленности, характеризуется незначительными затратами на электрическую энергию и эксплуатацию агрегатов. Генераторы кислорода — оборудование для получения кислорода адсорбционным методом.
- Криогенный. Дает возможность получать кислород, чистота которого достигает 99,7%. Благодаря температурной разнице кипения кислорода и азота позволяет добиваться разделения сжатой воздушной массы на элементы в колоннах ректификационного типа. Чтобы воздух трансформировался в жидкое состояние, его температура должна опуститься к отметке -196 °C. Процедура охлаждения осуществляется в специальных машинах (детандерах). Отличительная особенность такого оборудования — расширение воздушной массы наблюдается как на лопатках рабочего колеса, так и в сопловом устройстве. Движение газа происходит против центробежных сил. Криогенные кислородные установки вырабатывают холод с применением воздуха, находящегося в сжатом состоянии до нескольких атмосфер. Вращение ротора генератора выполняется за счет энергии.
Производство кислорода в промышленных масштабах несет в себе высокую значимость. К выбору технологии и соответствующего оборудования нужно уделить повышенное вынимание. Допущенные ошибки могут негативно отразиться на технологичном процессе и повлечь за забой увеличение затрат.
Технические особенности оборудования для получения кислорода в промышленности
Наладить процесс получения кислорода в газообразном состоянии помогают генераторы промышленного типа «ОКСИМАТ». Их технические характеристики и конструктивные особенности направлены на получение данного вещества в промышленности необходимой чистоты и требуемом количестве на протяжении суток (без перерыва). Следует учесть, что работать оборудование может в любом режиме как с остановками, так и без них. Агрегат функционирует под давлением. На входе должен быть осушенный воздух в сжатом состоянии очищенный от влаги. Предусматриваются модели малой, средней и большой производительности.
Источник
Получение кислорода в промышленности — основные способы и технология производства
Основные свойства
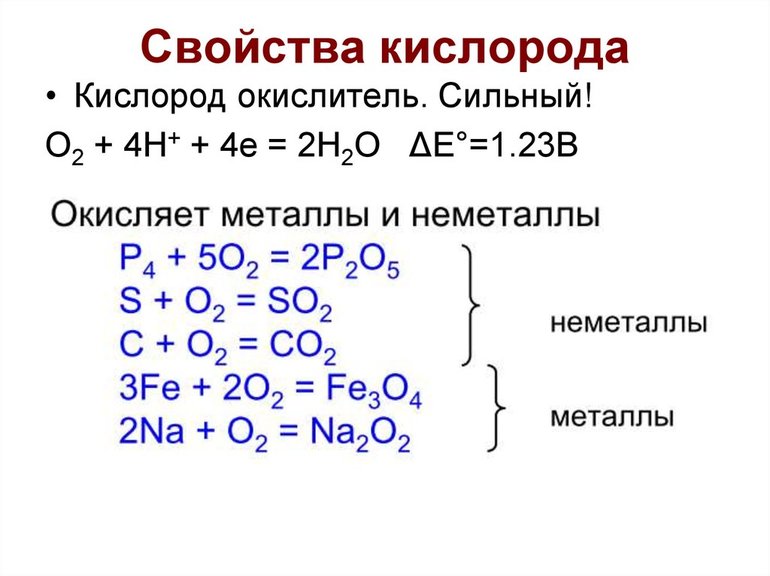
Кислород расположен на 8 месте в таблице периодических элементов Менделеева. Он поддерживает горение и осуществляет окисление веществ. Способы получения кислорода могут осуществляться как лабораторным, так и промышленным методом.
Получение кислорода в лаборатории впервые было осуществлено английским ученым Пристли в 1774 году. Ему удалось получить газ из оксида ртути, уравнение которого описывается 2HgO=2Hg+O2. Но ученый еще не знал, что такой элемент находится в воздухе.
Основные свойства и месторасположение в атмосфере спустя некоторое время смог получить коллега Пристли французский ученый Антуан Лавуазье. Основными характеристиками при электролизе и производстве являются:
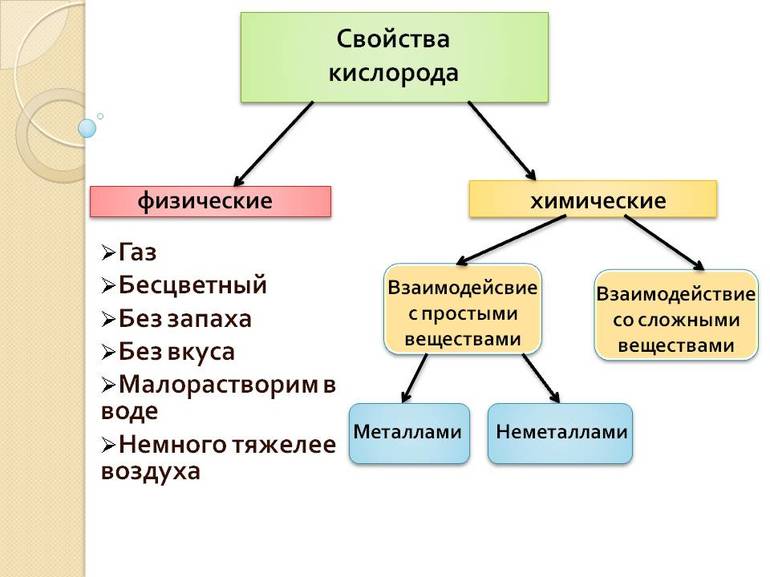
- Газ не имеет какого-либо окраса.
- Также у него при добыче нет запаха и вкуса.
- По плотности тяжелее воздуха.
- В составе молекулы источника содержится два атома.
- Жидкое состояние приводит к появлению бледно-голубого цвета.
- В воде почти не растворяется и сильно окисляется.
Наличие кислорода в перекиси достаточно легко проверять. Для этого опускают в сосуд с газом догорающую лучину. Если в нем имеется кислород, то она немедленно вспыхнет. Аналогично можно делать и с другими предметами.
Способы получения
На сегодняшний день существует некоторое количество методов получения кислорода в промышленных и лабораторных условиях. В первом случае его можно добывать из воздуха с помощью разжижения давлением и при температуре -183 градуса. Жидкий воздух медленно нагревают, после чего азот начнет улетучиваться с сохранением кислорода.
В лабораториях известным способом является получение кислорода из бертолетовой соли, пероксида водорода и электролитическим синтезом. При нагревании идет распад солей. Например, хлорат калия греют до 500 градусов, а марганцовку или калиевый перманганат до 240*С. Основные химические формулы:
- 2KClO3=2KCl+3O2 и 2KMnO4=K2MnO4+MnO2+O2
- Нагревание селитры или нитрата калия 2KNO3=2KNO2+O2.
- Условием разложения является использование оксида марганца в виде катализатора. Главное уравнение 2H2O2=2H2O+O2.
- Также его можно добыть из воды с помощью разложения на водород 2H2O=2H2+O2.
Еще один интересный метод получения был открыт на атомных подводных лодках. Для реакции применялся пироксид натрия, описываемый выражением 2Na2O2+2CO2=2Na2CO3+O2. Интересная особенность заключается в том, что с его выделением будет поглощен углекислый газ. Это прибавляет безопасности на лодках и в замкнутых пространствах.
Применение вещества
Собирание и распознавание нужно, чтобы получать чистый химический элемент. Он необходим в промышленности для окисления веществ и поддержки дыхательных процессов в космосе или проблемных помещениях. Еще он нужен пациентам с затрудненным дыханием в реанимации.
Также он требуется в сжигании топлива. Среди них уголь, нефть, природный газ. Широкое распространение получил в металлургической промышленности и машиностроении. В качестве процессов выступают плавка, резка и сварка металлоконструкций.
Поэтому такой химический элемент важен как для лабораторных исследований, так и промышленных работ. С его помощью идет значительное число реакций в химии. Получение его необходимо также и для облегчения дыхания в труднодоступных местах, включая задымленные помещения и глубоководные пространства.
Источник