- Аl(NО3)3 — свойства и применение
- Химическая формула и свойства соединения
- Реакции, в которых может принимать участие вещество
- Использование алюминиевой соли азотной кислоты
- Алюминий. Химия алюминия и его соединений
- Алюминий
- Положение в периодической системе химических элементов
- Электронное строение алюминия и свойства
- Физические свойства
- Нахождение в природе
- Способы получения
- Качественные реакции
- Химические свойства
Аl(NО3)3 — свойства и применение
Соли металлов очень часто используются для изготовления различных элементов, которые играют важное значение в других отраслях промышленности. Поэтому их довольно часто синтезируют из разнообразных соединений, чтобы затем использовать в своих целях. Нитрат алюминия относится к наиболее востребованным веществам, так как обладает прекрасными свойствами и может быть применен в широких масштабах.
Благодаря высокой химической активности солеобразующих металлов, свойства будут весьма ярко проявляться, так что именно поэтому стараются выбирать активные соединения. С ними проще работать, но могут потребоваться специальные условия хранения, так как в некоторых случаях реакция происходит прямо на открытом воздухе, что недопустимо, так как не будет контроля.
Химическая формула и свойства соединения
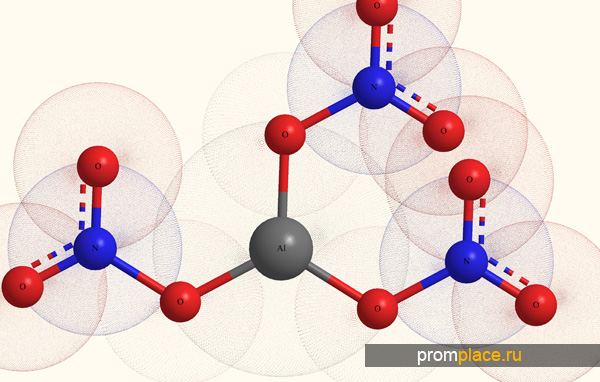
Условными обозначениями формула нитрата алюминия выглядит следующим образом:Аl(NО3)3. Это соединение обладает следующими параметрами:
- • пребывает в твердом агрегатном состоянии при нормальных условиях;
- • молярная масса составляет 212,996 грамм на моль;
- • плотность равняется 1,89 грамм на кубический сантиметр;
- • плавится вещество всего при 66 градусах по Цельсию;
- • массовая доля азота в нитрате алюминия составляет 19,7%;
- • в химических реакциях проявляет высокую активность, которая увеличивается при нагревании до определенного уровня, так как дальше начинается разложение.
Нитрат алюминия 3 можно получить несколькими способами, которые дают одинаково хороший результат, а отличаются лишь необходимостью наличия разных компонентов:
1. Самым простым способом будет растворение или так называемое травление чистого металла в разведенной азотной кислоте: 8Аl+30НNО3=8Аl(NО3)3+3N2О+15Н2О.
2. Также можно осуществлять воздействие азотной кислотой на основание алюминия: Аl(ОН)3+3НNО3=Аl(NО3)3+3Н2О.
3. Можно проводить реакцию замещения, для чего используются менее активные металлы, которые вытесняются алюминием: Аl2(SО4)3+3BА(NО3)2=2Аl(NО3)3+3BАSО4.
4. Чтобы сразу получить безводный раствор, нужно провести реакцию кристаллогидрата, которая может иметь два вида взаимодействий:
5. В промышленности твердое вещество также получают двумя основными методами:
6. Можно применять в качестве исходного сырья бромид алюминия, тогда реакция будет протекать постепенно в две стадии:
Как видно, раствор нитрата алюминия и твердое вещество можно получить большим количеством способов, причем для этого даже не потребуются специальные условия.
Реакции, в которых может принимать участие вещество
Алюминий относится к категории амфотерных элементов, так что при определенных условиях он может проявлять разные свойства. Это широко используется в промышленности, чтобы можно было управлять химическими реакциями в зависимости от необходимости. Нитрат алюминия взаимодействует с большим количеством соединений различного рода, так что может использоваться в широком спектре работ:
- • Цепочка алюминий→нитрат алюминия→гидроксид алюминия может быть пройдена ровно за два простых этапа в следующей последовательности:
- • Нитрат алюминия→хлорид алюминия можно получить при помощи воздействия на вещество соляной кислотой: Аl(NО3)3+3НCl=АlCl3+3НNО3.
- • Оксид алюминия→нитрат алюминия получают по простой схеме: Аl2О3+3N2О5=2Аl(NО3)3.
- • Нитрат алюминия и гидроксид натрия во взаимодействии дают следующий результат Аl(NО3)3+3NАОН=Аl(ОН)3↓+3NАNО3.
- • Нитрат цинка и алюминий при взаимодействии проведут реакцию вытеснения менее активного металла: 3Zn(NО3)2+2Аl=2Аl(NО3)3+3Zn.
- • Нитрат калия с алюминием не реагирует, так как калий является более активным металлом, поэтому алюминий не может вытеснять его из соединений.
- • А вот такому виду замещения, как алюминий→нитрат железа ничего не мешает: 3Fe(NО3)2+2Аl=2Аl(NО3)3+3Fe.
- • Разложение нитрата алюминия происходит при нагревании среды до 150-200 градусов по Цельсию: 4Аl(NО3)3=2Аl2О3+12NО2+3О2.
Это только небольшой перечень реакций, в которые вступает вещество.
Использование алюминиевой соли азотной кислоты
Вещество используется на текстильных фабриках для протравки тканей перед покраской, играет важную роль при дублении кожи, служит для изготовления нитей накаливания. Каталитические свойства применяется для очистки нефти от различных вредных примесей, а также может убирать коррозию с металлов и некоторых сплавов. Входит в состав некоторых антиперспирантов.
Опасность вещества для человека находится на низком уровне или отсутствует вовсе. Твердые элементы можно брать в руки без защитных перчаток, а нюхать материал без какого-либо опасения получить ожог дыхательный путей. Случаи попадания алюминиевого нитрата в пищеварительную систему человека не фиксировались, так что сказать об опасности сложно.
При проведении испытаний на крысах после внутреннего употребления погибла половина испытуемой группы. Так что наверняка опасность присутствует, но в любом случае, ни одно химическое вещество нельзя употреблять в пищу, пока его свойства не будут исследованы и не доказана польза для организма.
Источник
Алюминий. Химия алюминия и его соединений
Бинарные соединения алюминия
Алюминий
Положение в периодической системе химических элементов
Алюминий расположен в главной подгруппе III группы (или в 13 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение алюминия и свойства
Электронная конфигурация алюминия в основном состоянии :
+13Al 1s 2 2s 2 2p 6 3s 2 3p 1 1s 



Электронная конфигурация алюминия в возбужденном состоянии :
+13Al * 1s 2 2s 2 2p 6 3s 1 3p 2 1s 



Алюминий проявляет парамагнитные свойства. Алюминий на воздухе быстро образует прочные оксидные плёнки, защищающие поверхность от дальнейшего взаимодействия, поэтому устойчив к коррозии.
Физические свойства
Алюминий – лёгкий металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке. Обладает высокой тепло- и электропроводностью.
Температура плавления 660 о С, температура кипения 1450 о С, плотность алюминия 2,7 г/см 3 .
Алюминий — один из наиболее ценных цветных металлов для вторичной переработки. На протяжении последних лет, цена на лом алюминия в пунктах приема непреклонно растет. По ссылке можно узнать о том, как сдать лом алюминия.
Нахождение в природе
Алюминий — самый распространенный металл в природе, и 3-й по распространенности среди всех элементов (после кислорода и кремния). Содержание в земной коре — около 8%.
В природе алюминий встречается в виде соединений:
Корунд Al2O3. Красный корунд называют рубином, синий корунд называют сапфиром.
Способы получения
Алюминий образует прочную химическую связь с кислородом. Поэтому традиционные способы получения алюминия восстановлением из оксида протекают требуют больших затрат энергии. Для промышленного получения алюминия используют процесс Холла-Эру. Для понижения температуры плавления оксид алюминия растворяют в расплавленном криолите (при температуре 960-970 о С) Na3AlF6, а затем подвергают электролизу с углеродными электродами. При растворении в расплаве криолита оксид алюминия распадается на ионы:
На катоде происходит восстановление ионов алюминия:
Катод: Al 3+ +3e → Al 0
На аноде происходит окисление алюминат-ионов:
Суммарное уравнение электролиза расплава оксида алюминия:
Лабораторный способ получения алюминия заключается в восстановлении алюминия из безводного хлорида алюминия металлическим калием:
AlCl3 + 3K → Al + 3KCl
Качественные реакции
Качественная реакция на ионы алюминия — взаимодействие избытка солей алюминия с щелочами . При этом образуется белый аморфный осадок гидроксида алюминия.
Например , хлорид алюминия взаимодействует с гидроксидом натрия:
AlCl3 + 3NaOH → Al(OH)3 + 3NaCl
При дальнейшем добавлении щелочи амфотерный гидроксид алюминия растворяется с образованием тетрагидроксоалюмината:
Обратите внимание , если мы поместим соль алюминия в избыток раствора щелочи, то белый осадок гидроксида алюминия не образуется, т.к. в избытке щелочи соединения алюминия сразу переходят в комплекс:
AlCl3 + 4NaOH = Na[Al(OH)4] + 3NaCl
Соли алюминия можно обнаружить с помощью водного раствора аммиака. При взаимодействии растворимых солей алюминия с водным раствором аммиака также в ыпадает полупрозрачный студенистый осадок гидроксида алюминия.
AlCl3 + 3NH3·H2O = Al(OH)3 ↓ + 3NH4Cl
Al 3+ + 3NH3·H2O = Al(OH)3 ↓ + 3NH4 +
Видеоопыт взаимодействия раствора хлорида алюминия с раствором аммиака можно посмотреть здесь.
Химические свойства
1. Алюминий – сильный восстановитель . Поэтому он реагирует со многими неметаллами .
1.1. Алюминий реагируют с галогенами с образованием галогенидов:
1.2. Алюминий реагирует с серой с образованием сульфидов:
1.3. Алюминий реагируют с фосфором . При этом образуются бинарные соединения — фосфиды:
Al + P → AlP
1.4. С азотом алюминий реагирует при нагревании до 1000 о С с образованием нитрида:
2Al + N2 → 2AlN
1.5. Алюминий реагирует с углеродом с образованием карбида алюминия:
1.6. Алюминий взаимодействует с кислородом с образованием оксида:
Видеоопыт взаимодействия алюминия с кислородом воздуха (горение алюминия на воздухе) можно посмотреть здесь.
2. Алюминий взаимодействует со сложными веществами:
2.1. Реагирует ли алюминий с водой? Ответ на этот вопрос вы без труда найдете, если покопаетесь немного в своей памяти. Наверняка хотя бы раз в жизни вы встречались с алюминиевыми кастрюлями или алюминиевыми столовыми приборами. Такой вопрос я любил задавать студентам на экзаменах. Что самое удивительное, ответы я получал разные — у кого-то алюминий таки реагировал с водой. И очень, очень многие сдавались после вопроса: «Может быть, алюминий реагирует с водой при нагревании?» При нагревании алюминий реагировал с водой уже у половины респондентов))
Тем не менее, несложно понять, что алюминий все-таки с водой в обычных условиях (да и при нагревании) не взаимодействует. И мы уже упоминали, почему: из-за образования оксидной пленки . А вот если алюминий очистить от оксидной пленки (например, амальгамировать), то он будет взаимодействовать с водой очень активно с образованием гидроксида алюминия и водорода:
2Al 0 + 6 H2 + O → 2 Al +3 ( OH)3 + 3 H2 0
Амальгаму алюминия можно получить, выдержав кусочки алюминия в растворе хлорида ртути ( II ):
3HgCl2 + 2Al → 2AlCl3 + 3Hg
Видеоопыт взаимодействия амальгамы алюминия с водой можно посмотреть здесь.
2.2. Алюминий взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой). При этом образуются соль и водород.
Например , алюминий бурно реагирует с соляной кислотой :
2Al + 6HCl = 2AlCl3 + 3H2↑
2.3. При обычных условиях алюминий не реагирует с концентрированной серной кислотой из-за пассивации – образования плотной оксидной пленки. При нагревании реакция идет, образуются оксид серы (IV), сульфат алюминия и вода:
2.4. Алюминий не реагирует с концентрированной азотной кислотой также из-за пассивации.
С разбавленной азотной кислотой алюминий реагирует с образованием молекулярного азота:
При взаимодействии алюминия в виде порошка с очень разбавленной азотной кислотой может образоваться нитрат аммония:
2.5. Алюминий – амфотерный металл, поэтому он взаимодействует с щелочами . При взаимодействии алюминия с раствором щелочи образуется тетрагидроксоалюминат и водород:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2 ↑
Видеоопыт взаимодействия алюминия со щелочью и водой можно посмотреть здесь.
Алюминий реагирует с расплавом щелочи с образованием алюмината и водорода:
2Al + 6NaOH → 2Na3AlO3 + 3H2 ↑
Эту же реакцию можно записать в другом виде (в ЕГЭ рекомендую записывать реакцию именно в таком виде):
2Al + 6NaOH → 2NaAlO2 + 3H2↑ + 2Na2O
2.6. Алюминий восстанавливает менее активные металлы из оксидов . Процесс восстановления металлов из оксидов называется алюмотермия .
Например , алюминий вытесняет медь из оксида меди (II). Реакция очень экзотермическая:
2Al + 3CuO → 3Cu + Al2O3
Еще пример : алюминий восстанавливает железо из железной окалины, оксида железа (II, III):
Восстановительные свойства алюминия также проявляются при взаимодействии его с сильными окислителями: пероксидом натрия, нитратами и нитритами в щелочной среде, перманганатами, соединениями хрома (VI):
Источник