- Оксид меди (I)
- Оксид меди (I)
- Способы получения оксида меди (I)
- Химические свойства оксида меди (I)
- Оксид меди (II)
- Оксид меди (II)
- Способы получения оксида меди (II)
- Химические свойства оксида меди (II)
- Оксид меди (II)
- Содержание
- Получение
- Химические свойства
- Физические свойства
- Применение
- Оксид меди (II), свойства, получение, химические реакции
- Оксид меди (II), свойства, получение, химические реакции.
- Краткая характеристика оксида меди (II):
- Физические свойства оксида меди (II):
- Получение оксида меди (II):
- Химические свойства оксида меди (II). Химические реакции оксида меди (II):
- Применение и использование оксида меди (II):
- Мировая экономика
- Справочники
- Востребованные технологии
- Поиск технологий
- О чём данный сайт?
- О Второй индустриализации
Оксид меди (I)
Оксид меди (I)
Оксид меди (I) Cu2O – твердое кристаллическое вещество коричнево-красного цвета.
Способы получения оксида меди (I)
В лаборатории оксид меди (I) получают восстановлением свежеосажденного гидроксида меди (II), например , альдегидами или глюкозой:
Химические свойства оксида меди (I)
1. Оксид меди (I) обладает основными свойствами.
При действии на оксид меди (I) галогеноводородных кислот получают галогениды меди (I) и воду:
Например , соляная кислота с оксидом меди (I) образует хлорид меди (I):
Cu2O + 2HCl = 2CuCl↓ + H2O
2. При растворении Cu2O в концентрированной серной, азотной кислотах образуются только соли меди (II):
3. Устойчивыми соединениями меди (I) являются нерастворимые соединения (CuCl, Cu2S) или комплексные соединения [Cu(NH3)2] + . Последние получают растворением в концентрированном растворе аммиака оксида меди (I), хлорида меди (I):
Аммиачные растворы солей меди (I) взаимодействуют с ацетиленом :
СH ≡ CH + 2[Cu(NH3)2]Cl → СuC ≡ CCu + 2NH4Cl
4. В окислительно-восстановительных реакциях соединения меди (I) проявляют окислительно-восстановительную двойственность:
Например , при взаимодействии с угарным газом, более активными металлами или водородом оксид меди (II) проявляет свойства окислителя :
Cu2O + CO = 2Cu + CO2
А под действием окислителей, например, кислорода — свойства восстановителя :
Источник
Оксид меди (II)
Оксид меди (II)
Оксид меди (II) CuO – твердое кристаллическое вещество черного цвета.
Способы получения оксида меди (II)
Оксид меди (II) можно получить различными методами :
1. Термическим разложением гидроксида меди (II) при 200°С :
2. В лаборатории оксид меди (II) получают окислением меди при нагревании на воздухе при 400–500°С:
2Cu + O2 → 2CuO
3. В лаборатории оксид меди (II) также получают прокаливанием солей (CuOH)2CO3, Cu(NO3)2:
Химические свойства оксида меди (II)
Оксид меди (II) – основный оксид (при этом у него есть слабо выраженные амфотерные свойства) . При этом он является довольно сильным окислителем.
1. При взаимодействии оксида меди (II) с сильными и растворимыми кислотами образуются соли.
Например , оксид меди (II) взаимодействует с соляной кислотой:
СuO + 2HBr = CuBr2 + H2O
CuO + 2HCl = CuCl2 + H2O
2. Оксид меди (II) вступает в реакцию с кислотными оксидами.
Например , оксид меди (II) взаимодействует с оксидом серы (VI) с образованием сульфата меди (II):
3. Оксид меди (II) не взаимодействует с водой.
4. В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства:
Например , оксид меди (II) окисляет аммиак :
3CuO + 2NH3 → 3Cu + N2 + 3H2O
Оксид меди (II) можно восстановить углеродом, водородом или угарным газом при нагревании:
СuO + C → Cu + CO
Более активные металлы вытесняют медь из оксида.
Например , алюминий восстанавливает оксид меди (II):
3CuO + 2Al = 3Cu + Al2O3
Источник
Оксид меди (II)
| Оксид меди (II) | |
|---|---|
  | |
 | |
| Систематическое наименование | Оксид меди (II) |
| Хим. формула | CuO |
| Состояние | черный порошок |
| Молярная масса | 79,545 г/моль |
| Плотность | 6,31 г/см³ |
| Температура | |
| • плавления | 1447 |
| • кипения | 2000 °C |
| Давление пара | 0 ± 1 мм рт.ст. |
| Растворимость | |
| • в воде | нерастворим |
| ГОСТ | ГОСТ 16539-79 |
| Рег. номер CAS | [1317-38-0] |
| PubChem | 164827 |
| Рег. номер EINECS | 215-269-1 |
| SMILES | |
| RTECS | GL7900000 |
| ChEBI | 75955 |
| ChemSpider | 144499 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
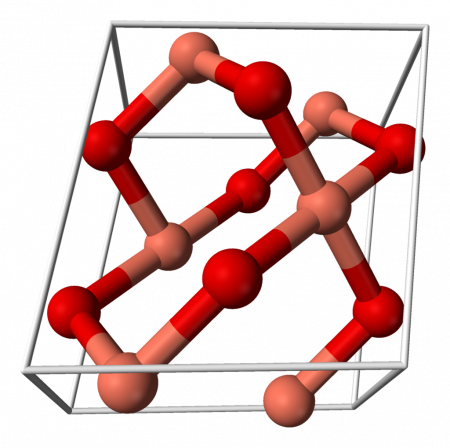
Оксид меди (II) (окись меди) CuO — оксид двухвалентной меди. Кристаллы чёрного цвета, в обычных условиях довольно устойчивые, практически нерастворимые в воде. В природе встречается в виде минерала тенорита (мелаконита) чёрного цвета.
Кристаллическая решётка оксида меди характеризуется следующими параметрами: моноклинная сингония, пространственная группа C2h, параметры ячейки a = 0.46837(5) нм , b = 0.34226(5) нм , c = 0.51288(6) нм , α = 90° , β = 99,54(1)° , γ = 90° . Атом меди окружён четырьмя атомами кислорода и имеет искажённую плоскую конфигурацию.
Содержание
Получение
Получить оксид меди (II) можно:
- нагревая металлическую медь на воздухе (при температурах ниже 1100 °C):
2Cu + O2 → 2CuO
- нагревая гидроксид меди (II), её нитрат или карбонат:
2Cu(NO3)2 → 2CuO + 4NO2 + O2 CuCO3 → CuO + CO2 Cu(OH)2 → CuO + H2O
- нагревая малахит:
Cu2CO3(OH)2 → ot 2CuO + CO2 + H2O
Химические свойства
Оксид меди (II) реагирует с кислотами с образованием соответствующих солей меди (II) и воды:
При сплавлении CuO со щелочами образуются купраты:
При нагревании до 1100 °C разлагается на медь и кислород.
Оксиду меди (II) соответствует гидроксид меди (II) Cu(OH)2, который является очень слабым основанием. Он способен растворяться в концентрированных растворах щелочей с образованием комплексов (то есть обладает слабыми амфотерными свойствами):
Cu(OH)2 + 2NaOH → Na2[Cu(OH)4] (тетрагидроксокупрат (II) натрия).
Оксид меди(II) восстанавливается до металлической меди аммиаком, монооксидом углерода, водородом, углем:
CuO + H2 → Cu + H2O 2CuO + C → 2Cu + CO2
Физические свойства
Оксид меди (II) относится к моноклинной кристаллической системе.
Работа выхода электрона из кристалла CuO составляет 5,3 эВ.
Оксид меди (II) представляет собой полупроводник p-типа с узкой шириной запрещенной зоны 1,2 эВ.
Оксид меди может быть использован для производства сухих батарей.
Применение
CuO используют при производстве стекла и эмалей для придания им зелёной и синей окраски. Кроме того, оксид меди применяют в производстве медно-рубинового стекла.
В лабораториях применяют для обнаружения восстановительных свойств веществ. Вещество восстанавливает оксид до металлической меди, при этом чёрный цвет оксида меди переходит в розовую окраску меди.
Источник
Оксид меди (II), свойства, получение, химические реакции
Оксид меди (II), свойства, получение, химические реакции.
Оксид меди (II) – неорганическое вещество, имеет химическую формулу CuO.
Химические свойства оксида меди (II)
Краткая характеристика оксида меди (II):
Оксид меди (II) – неорганическое вещество черного цвета.
Так как валентность меди меняется и равна одному, двум или трем, то оксид меди содержит соответственно два атома меди и один атом кислорода, один атом меди и один атом кислорода, два атома меди и три атома кислорода.
Оксид двухвалентной меди содержит соответственно один атом меди и один атом кислорода.
Химическая формула оксида меди (II) CuO.
Порошок. Не растворяется в воде.
Физические свойства оксида меди (II):
| Наименование параметра: | Значение: |
| Химическая формула | CuO |
| Синонимы и названия иностранном языке | меди окись (устар. рус.) |
сopper (II) oxide (англ.)
тенорит (рус.)
Получение оксида меди (II):
Оксид меди (II) получается в результате следующих химических реакций:
1. окисления меди:
2. термического разложения гидроксида меди (II), нитрата меди (II), карбоната меди (II):
3. нагревания малахита:
Химические свойства оксида меди (II). Химические реакции оксида меди (II):
Оксид меди (II) относится к основным оксидам.
Химические свойства оксида меди (II) аналогичны свойствам основных оксидов других металлов . Поэтому для него характерны следующие химические реакции:
1. реакция оксида меди (II) с водородом:
CuО + H2 → Cu + H2О (t = 300 o C).
В результате реакции образуется медь и вода .
2. реакция оксида меди (II) с углеродом:
CuО + С → Cu + СО (t = 1200 o C).
В результате реакции образуется медь и оксид углерода .
3. реакция оксида меди (II) с серой:
CuО + 2S → Cu + S2О (t = 150-200 o C).
Реакция протекает в вакууме. В результате реакции образуется медь и оксид серы .
4. реакция оксида меди (II) с алюминием:
3CuО + 2Al → 3Cu + Al2О3 (t = 1000-1100 o C).
В результате реакции образуется медь и оксид алюминия .
5. реакция оксида меди (II) с медью:
CuО + Cu → Cu2О (t = 1000-1200 o C).
В результате реакции образуется оксид меди (I).
6. реакция оксида меди (II) с оксидом лития :
Реакция протекает в токе кислорода. В результате реакции образуется купрат лития.
7. реакция оксида меди (II) с оксидом натрия :
Реакция протекает в токе кислорода. В результате реакции образуется купрат натрия.
8. реакция оксида меди (II) с оксидом углерода :
CuО + СО → Cu + СО2.
В результате реакции образуется медь и оксид углерода (углекислый газ).
9. реакция оксида меди (II) с оксидом железа :
В результате реакции образуется соль – феррит меди. Реакция протекает при прокаливании реакционной смеси.
10. реакция оксида меди (II) с плавиковой кислотой:
В результате химической реакции получается соль – фторид меди и вода.
11. реакция оксида меди (II) с азотной кислотой:
В результате химической реакции получается соль – нитрат меди и вода .
Аналогично проходят реакции оксида меди (II) и с другими кислотами.
12. реакция оксида меди (II) с бромистым водородом (бромоводородом):
В результате химической реакции получается соль – бромид меди и вода .
13. реакция оксида меди (II) с йодоводородом:
В результате химической реакции получается соль – йодид меди и вода .
14. реакция оксида меди (II) с гидроксидом натрия :
В результате химической реакции получается соль – купрат натрия и вода .
15. реакция оксида меди (II) с гидроксидом калия :
В результате химической реакции получается соль – купрат калия и вода .
16. реакция оксида меди (II) с гидроксидом натрия и водой:
Гидрокосид натрия растворен в воде. Раствор гидроксида натрия в воде 20-30 %. Реакция протекает при киппении. В результате химической реакции получается тетрагидроксокупрат натрия.
17. реакция оксида меди (II) с надпероксидом калия:
В результате химической реакции получается соль – купрат (III) калия и кислород .
18. реакция оксида меди (II) с пероксидом калия:
В результате химической реакции получается соль – купрат (III) калия.
19. реакция оксида меди (II) с пероксидом натрия:
В результате химической реакции получается соль – купрат (III) натрия.
20. реакция оксида меди (II) с аммиаком:
3CuO + 2NH3 → N2 + 3Cu + 3H2O (t = 500-550 o C).
Аммиак пропускают через нагретый оксид меди (II). В результате химической реакции получается азот, медь и вода.
В результате химической реакции получается нитрид меди, азот и вода.
21. реакция оксида меди (II) и йодида алюминия:
В результате химической реакции получаются соль – йодид меди, оксид алюминия и йод.
Применение и использование оксида меди (II):
Оксид меди используется для производства стекла и эмалей для придания им соответствующей окраски (зеленой, синей, медно-рубиновой).
Примечание: © Фото //www.pexels.com, //pixabay.com

оксид меди реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие оксида меди
реакции с оксидом меди
Мировая экономика
Справочники
Востребованные технологии
- Концепция инновационного развития общественного производства – осуществления Второй индустриализации России на период 2017-2022 гг. (106 543)
- Экономика Второй индустриализации России (102 550)
- Программа искусственного интеллекта ЭЛИС (27 763)
- Метан, получение, свойства, химические реакции (24 214)
- Этилен (этен), получение, свойства, химические реакции (23 986)
- Природный газ, свойства, химический состав, добыча и применение (21 578)
- Крахмал, свойства, получение и применение (20 896)
- Пропилен (пропен), получение, свойства, химические реакции (20 018)
- Целлюлоза, свойства, получение и применение (19 748)
- Прямоугольный треугольник, свойства, признаки и формулы (19 007)
Поиск технологий
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
О Второй индустриализации
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Источник















