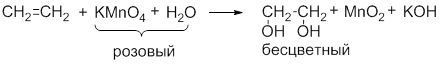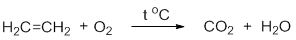- Как получают этилен лабораторным способом
- Этилен (этен), получение, свойства, химические реакции
- Электронное и пространственное строение молекулы
- Видео
- Получение
- Получение этилена (этена). Химические реакции – уравнения получения этилена (этена):
- Получение этилена
- Примеры решения задач
- Этилен (этен), получение, свойства, химические реакции
- Этилен (этен), получение, свойства, химические реакции.
- Этилен (этен), формула, газ, характеристики:
- Физические свойства этилена (этена):
- Химические свойства этилена (этена):
- Получение этилена (этена). Химические реакции – уравнения получения этилена (этена):
- Применение и использование этилена (этена):
Как получают этилен лабораторным способом
Получение этилена и опыты с ним
Реактивы: этанол, серная кислота, бромная вода, раствор перманганата калия, речной песок.
Оборудование: штатив, спиртовка, пробирка с газоотводной трубкой, штатив с пробирками, фильтровальная бумага или вата, спички.
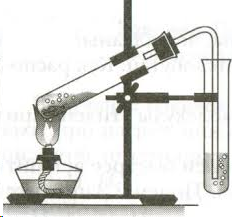
Схема установки:
Проведение эксперимента
В пробирку налейте 3 мл этанола и осторожно добавьте и 9 мл серной кислоты. Затем добавьте немного сухого речного песка (на кончике чайной ложки). Песок обеспечит ровное кипение жидкости, без толчков и выбросов. Вставьте в пробирку пробку с изогнутой газоотводной трубкой. Приготовьте ещё две пробирки: в первую налейте 2-3 мл разбавленного раствора перманганата калия (розовый цвет), во вторую 2-3 мл раствора брома в воде (желто-коричневый цвет). Для получения этилена пробирку с этанолом и серной кислотой осторожно нагрейте в пламени спиртовки. Продолжая нагревание, опустите конец газоотводной трубки в пробирку с перманганатом калия (трубка должна находиться ниже уровня раствора). Пропускайте этилен до полного исчезновения розовой окраски. Смените пробирку и пропустите этилен через раствор бромной воды до полного обесцвечивания раствора брома. Уберите пробирку с обесцвеченным раствором. Протрите конец газоотводной трубки ватой или фильтровальной бумагой, поверните трубку вверх и подожгите выделяющийся газ. Обратите внимание на цвет пламени.
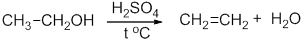
Реакция дегидратации этанола:
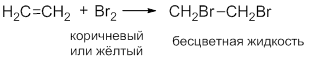
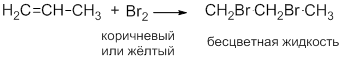
Обесцвечивание раствора Br2:
Исчезает окраска брома и образуется 1,2-дибромэтан.
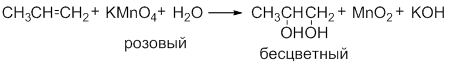
Обесцвечивание водного раствора KMnO4 (без нагревания):
Исчезает окраска перманганата калия и образуется 1,2-этандиол (этиленгликоль).
Получение пропилена и опыты с ним
Пропилен получают аналогично этилену.
В пробирку помещают 3-4 мл изопропилового спирта и 9-12 мл серной кислоты. Осторожно нагревают. Выделяющийся газ пропускают через растворы бромной воды и перманганата калия, наблюдают исчезновение окраски растворов. Поджигают газ у конца газоотводной трубки.
Обесцвечивание раствора Br2:
Исчезает окраска брома и образуется 1,2-дибромпропан.
Обесцвечивание водного раствора KMnO4 (без нагревания):
Исчезает окраска перманганата калия и образуется 1,2-пропандиол (пропиленгликоль).
Источник
Этилен (этен), получение, свойства, химические реакции
Электронное и пространственное строение молекулы
Атомы углерода находятся во втором валентном состоянии (sp 2 —гибридизация). В результате, на плоскости под углом 120° образуются три гибридных облака, которые образуют три σ-связи с углеродом и двумя атомами водорода; p-электрон, который не участвовал в гибридизации, образует в перпендикулярной плоскости π-связь с р-электроном соседнего атома углерода. Так образуется двойная связь между атомами углерода. Молекула имеет плоскостное строение.
Видео
Получение
- Этилен в лаборатории получают при нагревании смеси этилового спирта с концентрированной серной кислотой.
- Углеводороды ряда этилена можно получить также дегидрированием предельных углеводородов.
- На производстве этилен получают из природного газа и при процессах пиролиза нефти.
- Углеводороды ряда этилена можно получить при взаимодействии дигалогенопроизводных предельных углеводородов с металлами.
- При действии спиртовых растворов щелочей на галогенопроизводные отщепляется галогеноводород и образуется углеводород с двойной связью.
Получение этилена (этена). Химические реакции – уравнения получения этилена (этена):
Этилен получают как в лабораторных условиях, так и в промышленных масштабах.
В промышленных масштабах этилен получается в результате следующей химической реакции:
- 1. каталитическое дегидрирование этана :
Этилен в лабораторных условиях получается в результате следующих химических реакций:
- 2. дегалогенирования дигалогенпроизводных этана:
- 3. неполное гидрирование ацетилена:
- 4. дегидрогалогенирование галогенпроизводных алканов под действием спиртовых растворов щелочей:
Получение этилена
Способы получения этилена можно разделить на промышленные и лабораторные. В первом случае этен – это продуктдегидрирования этана, полученного при крекинге нефти.
В лабораторных условиях этилен можно получить при помощи дегидратации этанола (1), дегалогенированиямоно- и дигалогенпроизводных этана (2, 3) или при неполном гидрировании ацетилена (4):
Примеры решения задач
Задание Осуществите ряд превращений: этан → этен → этанол → этен → хлорэтан → бутан. Решение Для получения этена из этана необходимо использовать реакцию дегидрирования этана, которая протекает в присутствии катализатора (Ni, Pd, Pt) и при нагревании: С2H6 →C2H4 + H2. Получение этанола из этена осуществляют по реакции гидратации, протекающей водой в присутствии минеральных кислот (серной, фосфорной): С2H4 + H2O = C2H5OH. Для получения этена из этанола используют реакцию дегидротации: C2H5OH →(t, H2SO4) → C2H4 + H2O. Получение хлорэтана из этена осуществляют по реакции гидрогалогенирования: С2H4 + HCl → C2H5Cl. Для получения бутана из хлорэтана используют реакцию Вюрца: 2C2H5Cl +2Na → C4H10 + 2NaCl.
Задание Сколько граммов потребуется для бромирования 16,8 г алкена, если известно, что при каталитическом гидрировании такого же количества алкена присоединилось 6,72 л водорода? Каков состав и возможное строение исходного углеводорода? Решение Запишем в общем виде уравнения бромирования и гидрирования алкена: CnH2n + Br2 = CnH2nBr2 (1); CnH2n + H2 = CnH2n+2 (2). Рассчитаем количество вещества водорода: n = V / Vm; n(H2) = V(H2) / Vm; n(H2) = 6,72 / 22,4 = 0,3 моль, следовательно, алкена тоже будет 0,3 моль (уравнение 2), а по условию задачи это 16,8 г. Значит молярная масса его будет равна: M = m / n; M(CnH2n) = m(CnH2n) / n(CnH2n); M(CnH2n) = 16,8 / 0,3 = 56 г/моль, что соответствует формуле C4H8. Согласно уравнению (1) n(CnH2n) :n(Br2) = 1:1, т.е. n(Br2) = n(CnH2n) = 0,3 моль. Найдем массу брома: m = n×M; m(Br2) = n(Br2) × M(Br2); M(Br2) = 2×Ar(Br) = 2×80 = 160 г/моль; m(MnO2) = 0,3 × 160 = 48 г. Составим структурные формулы изомеров: бутен-1 (1), бутен-2 (2), 2-метилпропен (3), циклобутан (4). CH2=CH-CH2-CH3 (1); CH3-CH=CH-CH3 (2); CH2=C(CH3)-CH3 (3); C4H8 (4). Ответ Масса брома равна 48 г.
Источник
Этилен (этен), получение, свойства, химические реакции
Этилен (этен), получение, свойства, химические реакции.
Этилен (этен), C2H4 – органическое вещество класса алкенов. Этилен имеет двойную углерод-углеродную связь и поэтому относится к ненасыщенным или непредельным углеводородам.
Этилен (этен), формула, газ, характеристики:
Этилен (этен) – органическое вещество класса алкенов, состоящий из двух атомов углерода и четырех атомов водорода . Этилен имеет двойную углерод -углеродную связь и поэтому относится к ненасыщенным или непредельным углеводородам.
Химическая формула этилена C2H4, рациональная формула H2CCH2, структурная формула CH2=CH2. Изомеров не имеет.
Этилен – бесцветный газ, без вкуса, со слабым запахом. Легче воздуха.
Этилен является фитогормоном, т.е. низкомолекулярным органическим веществом, вырабатываемым растениями и имеющим регуляторные функции. Он образуется в тканях самого растения и выполняет в жизненном цикле растений многообразные функции, среди которых контроль развития проростка, созревание плодов (в частности, фруктов ), распускание бутонов (процесс цветения), старение и опадание листьев и цветков, участие в реакции растений на биотический и абиотический стресс, коммуникации между разными органами растений и между растениями в популяции.
Пожаро- и взрывоопасен.
Плохо растворяется в воде . Зато хорошо растворяется в диэтиловом эфире и углеводородах.
Этилен по токсикологической характеристике относится к веществам 4-го класса опасности (малоопасным веществам) по ГОСТ 12.1.007.
Этилен — самое производимое органическое соединение в мире.
Физические свойства этилена (этена):
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | со слабым запахом |
| Вкус | без вкуса |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность (при 20 °C и атмосферном давлении 1 атм.), кг/м 3 | 1,178 |
| Плотность (при 0 °C и атмосферном давлении 1 атм.), кг/м 3 | 1,26 |
| Температура плавления, °C | -169,2 |
| Температура кипения, °C | -103,7 |
| Температура вспышки, °C | 136,1 |
| Температура самовоспламенения, °C | 475,6 |
| Критическая температура*, °C | 9,6 |
| Критическое давление, МПа | 5,033 |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | от 2,75 до 36,35 |
| Удельная теплота сгорания, МДж/кг | 46,988 |
| Коэффициент теплопроводности (при 0 °C и атмосферном давлении 1 атм.), Вт/(м·К) | 0,0163 |
| Коэффициент теплопроводности (при 50 °C и атмосферном давлении 1 атм.), Вт/(м·К) | 0,0209 |
| Молярная масса, г/моль | 28,05 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Химические свойства этилена (этена):
Этилен — химически активное вещество. Так как в молекуле между атомами углерода имеется двойная связь, то одна из них, менее прочная, легко разрывается, и по месту разрыва связи происходит присоединение, замещение, окисление, полимеризация молекул.
Химические свойства этилена аналогичны свойствам других представителей ряда алкенов. Поэтому для него характерны следующие химические реакции:
- 1. каталитическое гидрирование(восстановление)этилена:
- 2. галогенирование этилена:
Однако при нагревании этилена до температуры 300 o C разрыва двойной углерод-углеродной связи не происходит – реакция галогенирования протекает по механизму радикального замещения:
- 3. гидрогалогенирование этилена:
- 4. гидратация этилена:
Реакция происходит в присутствии минеральных кислот (серной, фосфорной). В результате данной химической реакции образуется этанол.
- 5. окисление этилена:
Этилен легко окисляется. В зависимости от условий проведения реакции окисления этилена могут быть получены различные вещества: многоатомные спирты, эпоксиды или альдегиды.
В результате образуется эпоксид.
В результате образуется ацетальдегид.
- 6. горение этилена:
В результате горения этилена происходит разрыв всех связей в молекуле, а продуктами реакции являются углекислый газ и вода .
- 7. полимеризация этилена:
Получение этилена (этена). Химические реакции – уравнения получения этилена (этена):
Этилен получают как в лабораторных условиях, так и в промышленных масштабах.
В промышленных масштабах этилен получается в результате следующей химической реакции:
- 1. каталитическое дегидрирование этана :
Этилен в лабораторных условиях получается в результате следующих химических реакций:
- 2. дегалогенирования дигалогенпроизводных этана:
- 3. неполное гидрирование ацетилена:
- 4. дегидрогалогенирование галогенпроизводных алканов под действием спиртовых растворов щелочей:
Применение и использование этилена (этена):
– как сырье в химической промышленности для органического синтеза различных органических соединений: галогенпроизводных, спиртов (этанола, этиленгликоля), винилацетата, дихлорэтан, винилхлорида, окиси этилена, полиэтилена , стирола, уксусной кислоты, этилбензола, этиленгликоля и пр.,
Примечание: © Фото //www.pexels.com, //pixabay.com

как получить этилен реакция ацетилен этен 1 2 вещество этилен кислород водород связь является углекислый газ бромная вода
уравнение реакции масса объем полное сгорание моль молекула смесь превращение горение получение этилена
напишите уравнение реакций этилен
Источник