- Коррозия металлов и способы защиты от нее
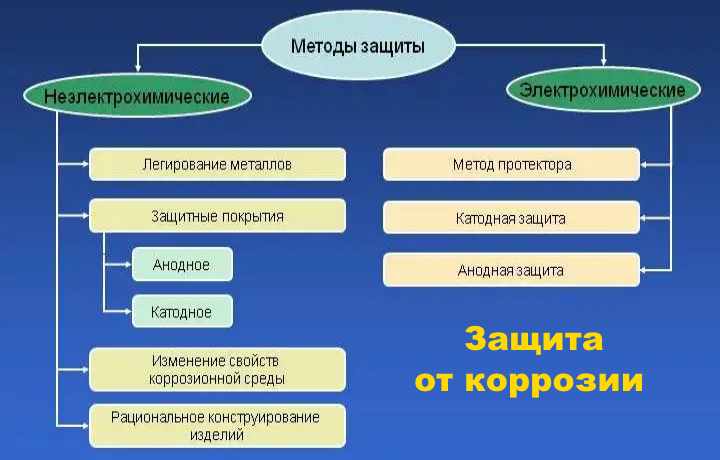
- Методы защиты от коррозии
- Защитные покрытия
- Создание сплавов, стойких к коррозии
- Изменение состава среды
- Электрохимические методы защиты
- Способы защиты металла от коррозии
- Виды антикоррозийной защиты
- Подробности о методах защиты
- Активные методики
- Катодная защита от коррозии
- Протекторная защита от коррозии
- Анодная защита от коррозии
- Пассивные
- Создание защитной плёнки
- Металлоконструкция в «желобах» для защиты
- Фосфатирование
- Покрытие металла устойчивыми материалами
- Пассивация
- Технологический способ защиты
- Защита металлов от коррозии
- Виды коррозии металлов
- Характер разрушения
- Механизм протекания коррозии
- Способы защиты металла от коррозии
- Конструктивные
- Пассивные
- Активные (электрохимические)
Коррозия металлов и способы защиты от нее
| Коррозия – это процесс разрушения металлов и металлических конструкций под воздействием различных факторов окружающей среды – кислорода, влаги, вредных примесей в воздухе. |
Коррозионная стойкость металла зависит от его природы, характера среды и температуры.
- Благородные металлы не подвергаются коррозии из-за химической инертности.
- Металлы Al, Ti, Zn, Cr, Ni имеют плотные газонепроницаемые оксидные плёнки, которые препятствуют коррозии.
- Металлы с рыхлой оксидной плёнкой – Fe, Cu и другие – коррозионно неустойчивы. Особенно сильно ржавеет железо.
Различают химическую и электрохимическую коррозию.
| Химическая коррозия сопровождается химическими реакциями. Как правило, химическая коррозия металлов происходит при действии на металл сухих газов, её также называют газовой. |
При химической коррозии также возможны процессы:
Fe + 2HCl → FeCl2 + H2
2Fe + 3Cl2 → 2FeCl3
Как правило, такие процессы протекают в аппаратах химических производств.
| Электрохимическая коррозия – это процесс разрушения металла, который сопровождается электрохимическими процессами. Как правило, электрохимическая коррозия протекает в присутствии воды и кислорода, либо в растворах электролитов. |
В таких растворах на поверхности металла возникают процессы переноса электронов от металла к окислителю, которым является либо кислород, либо кислота, содержащаяся в растворе.
При этом электродами являются сам металл (например, железо) и содержащиеся в нем примеси (обычно менее активные металлы, например, олово).
В таком загрязнённом металле идёт перенос электронов от железа к олову, при этом железо (анод) растворяется, т.е. подвергается коррозии:
Fe –2e = Fe 2+
На поверхности олова (катод) идёт процесс восстановления водорода из воды или растворённого кислорода:
2H + + 2e → H2
O2 + 2H2O + 4e → 4OH –
| Например, при контакте железа с оловом в растворе соляной кислоты происходят процессы: |
Анод: Fe –2e → Fe 2+
Катод: 2H + + 2e → H2
Суммарная реакция: Fe + 2H + → H2 + Fe 2+
Если реакция проходит в атмосферных условиях в воде, в ней участвует кислород и происходят процессы:
Анод: Fe –2e → Fe 2+
Катод: O2 + 2H2O + 4e → 4OH –
Суммарная реакция:
Fe 2+ + 2OH – → Fe(OH)2
4Fe(OH)2 + O2+ 2H2O → 4Fe(OH)3
При этом образуется ржавчина.
Методы защиты от коррозии
Защитные покрытия
Защитные покрытия предотвращают контакт поверхности металла с окислителями.
- Катодное покрытие – покрытие менее активным металлом (защищает металл только неповреждённое покрытие).
- Покрытие краской, лаками, смазками.
- Создание на поверхности некоторых металлов прочной оксидной плёнки химическим путём (анодирование алюминия, кипячение железа в фосфорной кислоте).
Создание сплавов, стойких к коррозии
Физические свойства сплавов могут существенно отличаться от свойств чистых металлов. Добавление некоторых металлов может приводить к повышению коррозионной стойкости сплава. Например, нержавеющая сталь, новые сплавы с большой коррозионной устойчивостью.
Изменение состава среды
Коррозия замедляется при добавлении в среду, окружающую металлическую конструкцию, ингибиторов коррозии. Ингибиторы коррозии — это вещества, подавляющие процессы коррозии.
Электрохимические методы защиты
Протекторная защита: при присоединении к металлической конструкции пластинок из более активного металла – протектора. В результате идёт разрушение протектора, а металлическая конструкция при этом не разрушается.
Источник
Способы защиты металла от коррозии
Как нам известно, что под воздействием окружающей среды портятся любые материалы и металлические изделия и стройматериалы не являются исключением.
Коррозию невозможно убрать полностью, но снизить ее воздействие при этом увеличив срок эксплуатации изделий из металла вполне возможно.
Очень важным фактором является обработка металлических изделий и конструкций от коррозии, потому что данная процедура значительно увеличит их срок эксплуатации.
Виды антикоррозийной защиты
Защиту от коррозии условно подразделяют на два вида:
- когда ее применяют до начала использования конструкции или изделия и
- когда изделие или конструкция уже пребывают в использовании.
Первый вид способствует высокой сопротивляемости «химическому» воздействию. Изолирует прямой контакт с агрессивными средами (поверхностная изоляция).
Второй вид способствует снижению агрессивной окружающей среды (это будет зависеть от условий использования).
Применение электромагнитных полей , например, «наложение» внешних электрических токов, регулирование плотности и другие методики.
Использование видов защиты от коррозии выбирается индивидуально для каждого изделия и конструкции.
Так же это зависит от следующих факторов:
- Вид металла;
- Условия эксплуатации;
- Трудность проведения обработки антикоррозийными составами;
- Экономическая целесообразность;
- Производственные возможности.
Подробности о методах защиты
Все методики можно разделить:
- на активные (которые постоянно воздействуют на металл),
- пассивные (многоразового применения),
- технологические (применяют на этапе производства образцов).
Активные методики
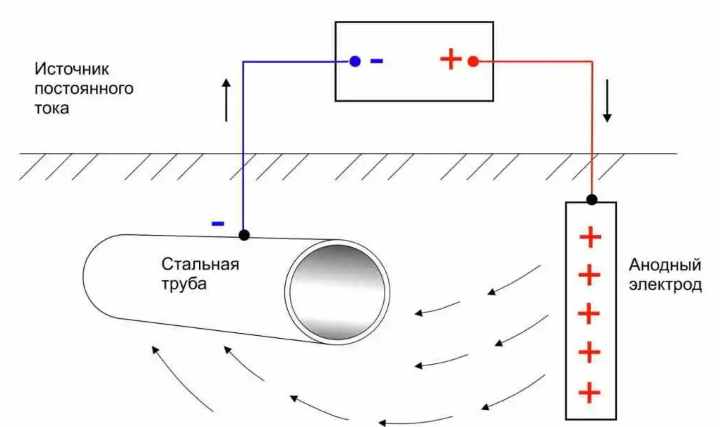
Катодная защита от коррозии
Такую методику используют в тех случаях, если среда, контактирующая с металлом, является электропроводящей. На материал подают большой «минусовой» потенциал, данная процедура позволяет предотвращать его окисление.
Протекторная защита от коррозии
Является катодной поляризацией. Экземпляр связывают с контактом с материалом, который больше всего подвержен окислению в этой токопроводящей среде (проектором). Он как бы является своеобразным громоотводом, то есть принимает весь негатив агрессивных веществ на себя.
Но такого рода протектор требует периодической замены.
Анодная защита от коррозии
Этот вариант применяют очень редко, и он заключается в поддержке «инертности» материала по отношению к окружающей среде.
Пассивные
Создание защитной плёнки
Популярная и низко затратная методика предотвращения коррозии. Чтобы создать поверхностный слой применяют специальные вещества. Данные вещества должны быть не активными по отношению к агрессивным химическим соединениям, быть не электропроводными и иметь хорошую адгезию.
Все вещества для обработки металла перед применением находиться в жидком или аэрозольном состоянии, от этого будет зависеть способ нанесения.
Чтобы обработать металл используют лакокрасочные составы, разные полимеры или мастики.
Металлоконструкция в «желобах» для защиты
Используют для трубопроводов и инженерных систем. В качестве изолятора в этом случае, выступает воздушная прослойка, которая находится между внутренними стенками канала и металлом.
Фосфатирование
Так же металлы обрабатывают специальными окислителями. Такие окислители вступают с основой в реакцию и в результате на ее поверхности образуются отложения малорастворимых химических соединений.
Такой способ защиты от влаги считается очень эффективным.
Покрытие металла устойчивыми материалами
В этом случае, изделия из металла «хромируют», «оцинковывают» серебрят и тому подобное. Так же в качестве защиты металла выступает бетон, стекло, керамика, цементные растворы и так далее.
Пассивация
Данная манипуляция состоит в том, чтобы достаточно резко снизить химическую активность металла. В этом случае, поверхность металла обрабатывают специальными реактивами.
Уменьшение агрессивности среды— применения веществ, которые снижают коррозийные процессы (ингибиторы).
Осушение воздуха— это химическая очистка воздуха от различных вредных примесей и применение других методик, которые применимы в быту.
Гидрофобизация грунта– это засыпка в него специальных веществ для снижения агрессивности почвы.
Обработка ядохимикатами– применяют в тех случаях, когда существует вероятность развития биокоррозии.
Технологический способ защиты
Легирование– на основе металла изготавливают сплав устойчивый к агрессивным воздействиям.
Но такой способ можно реализовать только на промышленных производствах.
И так как вы поняли по вышеперечисленной информации не каждую методику антикоррозийной обработки можно использовать в бытовых условиях.
То есть получается возможности «частника» очень ограничены. В этой статье мы описали несколько способов антикоррозийной обработки металлов и надеемся, что данная информация была вам полезной. Желаем вам удачи и терпения!
Источник
Защита металлов от коррозии
Железо и сплавы на его основе подвержены коррозии – разрушению, которое происходит вследствие химического или электрохимического взаимодействия компонентов металлов и сплавов с различными веществами окружающей среды. В результате этих окислительно-восстановительных реакций металлы связываются в оксиды, что приводит к потере их эксплуатационных свойств. Первые проявления разрушительного процесса – образование на поверхности пятен рыжего цвета. Своевременные меры по предотвращению коррозии обеспечивают значительное продление срока службы металлических изделий и конструкций.
Виды коррозии металлов
Коррозионные процессы различаются по характеру разрушения, механизму протекания процесса, типу агрессивной среды, вызывающей коррозию.
Характер разрушения
По этому признаку выделяют следующие типы коррозии:
- Сплошная – равномерная или неравномерная. Затрагивает равномерно всю поверхность металлоизделия или конструкции.
- Местная. Поражаются отельные участки поверхности.
- Питтинг-коррозия (точечная). Поражения – отдельные, глубокие или сквозные.
- Межкристаллитная. Разрушающиеся области располагаются вдоль границ зерен.
Механизм протекания коррозии
Основные типы коррозии – химическая и электрохимическая. Химические коррозионные процессы протекают в результате химреакций, при которых разрушаются металлические связи, а образуются новые – между атомами металла и окислителя. Химическая коррозия возникает при контакте металлов и сплавов со средами, не проводящими электрический ток. Она может быть жидкостной и газовой.
- Газовая коррозия протекает в агрессивных газовых и паровых средах при отсутствии сконденсированной влаги на поверхности металлоизделия или металлоконструкции. Она может стать причиной полного разрушения железа и сплавов на его основе. На поверхности алюминия и алюминиевых сплавов в газовых средах образуется защитная пленка, защищающая их от коррозии. Примеры газов, которые становятся причиной возникновения химических коррозионных процессов: кислород, диоксид серы, сероводород.
- Жидкостная коррозия протекает при контакте металлической поверхности с жидкими неэлектролитами – нефтью и нефтепродуктами. При наличии даже небольшого количества воды этот химический процесс легко превращается в электрохимический.
Электрохимическая коррозия возникает при контакте металлов и сплавов с жидкостями-электролитами вследствие протекания двух взаимосвязанных процессов:
- анодный – ионы металла переходят в раствор электролита;
- катодный – электроны, которые образовались на стадии анодного этапа, связываются частицами окислителя.
В зависимости от среды, в которой протекают электрохимические коррозионные процессы, различают следующие типы коррозии:
- Атмосферная. Самая распространенная. Протекает в условиях атмосферы или другого влажного газа.
- В растворах электролитов – кислотах, щелочах, солях, обычной воде.
- Почвенная. Скорость процесса зависит от состава грунта. Наименее агрессивны песчаные почвы, наиболее – кислые почвы.
- Аэрационная. Ее вызывает неравномерный доступ воздушной среды к разным частям изделий и конструкций.
- Биологическая. Ее провоцируют микроорганизмы, которые в результате жизнедеятельности вырабатывают углекислый газ, сероводород и другие газы, вызывающие коррозионные процессы.
- Электрическая. Возникает из-за блуждающих токов, которые появляются при эксплуатации электротранспорта.
Общий вывод! Коррозионные процессы активнее всего развиваются на поверхностях, удобных для отложения пыли, осадков, плохо обдуваемых воздушными струями. Поэтому они подвержены застою воздуха, накоплению и длительному сохранению на поверхности влаги.
Способы защиты металла от коррозии
На стадии производства стали в ее состав могут вводиться легирующие добавки, которые предотвращают появление очагов всех (или некоторых) видов коррозии. Таким элементом является, хром, которого должно быть не менее 13 % от общего количества всех компонентов. Для предотвращения возникновения и развития коррозии в сталях без легирующих добавок используют следующие методы антикоррозионной защиты – конструктивные, пассивные, активные.
Конструктивные
Заключаются в защите поверхности металла с помощью нетонкослойных покрытий – панелей, резиновых прокладок, заслонов. Эти способы имеют мало преимуществ: их сложно, а иногда невозможно реализовать, материалы для конструктивной защиты стоят дорого и после монтажа занимают много места. Их применяют нечасто и только в местах, где они скрыты от глаз.
Пассивные
На металлическое изделие наносится тонкослойное покрытие, которое выполняет чисто барьерные характеристики, то есть процесс защиты заключается в предотвращении контакта металла с наружной средой. Для пассивного способа защиты используют неметаллические покрытия – грунтовки, лаки, краски, эмали. После высыхания они образуют прочную и твердую пленку, имеющую хорошее сцепление с основанием.
Преимущества пассивного способа: невысокая цена и удобное нанесение покрытий, большой ассортимент составов разных цветов и характеристик, создание надежного барьера между металлом и окружающей средой. Недостатки: невысокая устойчивость к механическим повреждениям, необходимость периодически обновлять барьерный слой.
Активные (электрохимические)
Самый распространенный способ создания активной защиты для стальной поверхности – цинкование (горячее, термодиффузионное, гальваническое, холодное). Первые три технологии осуществимы только в производственных условиях. Чаще всего используется горячее цинкование. Стальной листовой прокат цинкуют на непрерывных линиях. Преимущества такого процесса: возможность получать цинковый слой достаточной толщины, высокие автоматизация и производительность процесса. В бытовых условиях применяют только холодное цинкование – нанесение на стальную поверхность цинкнаполненного материала. Обычно холодное цинкование применяют для локального восстановления цинкового покрытия.
Принцип активного защитного действия цинка заключается в том, что он обладает меньшей скоростью коррозии в данной среде, что позволяет ему обеспечить электрохимическую катодную защиту стальной основы. При нанесении на сталь цинкового покрытия цинк с железом образуют гальваническую пару, в которой цинк является более активным металлом. При контакте с влагой и другими коррозионноопасными средами цинк-анод отдает электроны, которые принимает железо-катод, что позволяет ему сохранять свои технические характеристики. Защитный процесс длится до полного исчезновения цинкового слоя.
Плюсы цинкования – долговечность и возможность добавлять цинковый слой в процессе эксплуатации изделий и конструкций. Минусы – необходимость в тщательной подготовке поверхности, обязательное соблюдении технологических правил, сложность утилизации токсичных отходов.
Источник