Как можно 3 разными способами распознать аммиак
Часть I
1. Строение молекулы.
2. Физические свойства: газ без цвета с резким запахом.
3. Водородная связь – это межмолекулярные или внутримолекулярные связи между атомом водорода и атомом сильно ЭО атомом.
4. Получение, собирание и распознавание NH3.
1) Напишите уравнение получения аммиака в лаборатории в молекулярной и ионной формах:
2) Получение в промышленности:
Укажите верный способ собирания аммиака, ответ поясните.
б, т.к. NH3 легче воздуха, он будет собираться в пробирке в верхней части.
3) Как можно тремя разными способами распознать аммиак?
а) запах
б) посинение влажной лакмусовой бумаги
в) белый дым на палочке над HCl.
5. Химические свойства.
1) Является сильным восстановителем, потому что N -3 может только отдавать электроны.
Восстановительные свойства проявляет по отношению (запишите уравнения реакций и рассмотрите с позиций окисления-восстановления):
— к кислороду:
— к оксидам металлов:
2) Взаимодействует с водой, образуя непрочное основание – гидрат аммиака NH3*H2O, который, как слабый электролит, незначительно диссоциирует:
3) Взаимодействует с кислотами, образуя соли аммония по донорно-акцепторному механизму:
Различают два механизма образования ковалентной связи:
1) обменный;
2) донорно-акцепторный.
Часть II
1. Заполните схему «Применение аммиака».
2. Зарисуйте схему промышленного синтеза аммиака, укажите сырьё и происходящие процессы.
3. Заполните схему «Типы химических связей».
4. Предложите три молекулярных уравнения, отражающих качественную реакцию на ион аммония:
5. Заполните таблицу.
6. Какой объём аммиака образуется при взаимодействии 535 г 20-%-го раствора аммония с щёлочью?
7. Запишите уравнения реакций для следующих переходов:
Источник
Аммиак: получение и свойства
Аммиак
Строение молекулы и физические свойства
В молекуле аммиака NH3 атом азота соединен тремя одинарными ковалентными полярными связями с атомами водорода:
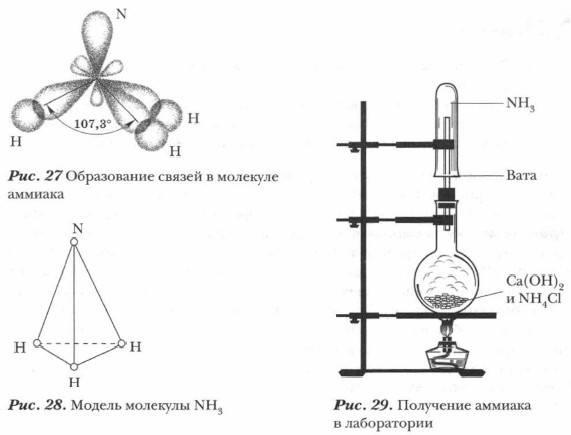
Геометрическая форма молекулы аммиака — правильная треугольная пирамида. Валентный угол H-N-H составляет 107,3 о :
У атома азота в аммиаке на внешнем энергетическом уровне остается одна неподеленная электронная пара. Эта электронная пара оказывает значительное влиение на свойства аммиака, а также на его структуру. Электронная структура аммиака — тетраэдр , с атомом азота в центре:
Аммиак – бесцветный газ с резким характерным запахом. Ядовит. Весит меньше воздуха. Связь N-H — сильно полярная, поэтому между молекулами аммиака в жидкой фазе возникают водородные связи. При этом аммиак очень хорошо растворим в воде, т.к. молекулы аммиака образуют водородные связи с молекулами воды.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например , аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например , гидролиз нитрида кальция:
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Химические свойства аммиака
1. В водном растворе аммиак проявляет основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе:
Таким образом, среда водного раствора аммиака – щелочная. Однако аммиак – слабое основание . При 20 градусах один объем воды поглощает до 700 объемов аммиака.
Видеоопыт растворения аммиака в воде можно посмотреть здесь.
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
Например , аммиак реагирует с серной кислотой с образованием либо кислой соли – гидросульфата аммония (при избытке кислоты), либо средней соли – сульфата аммония (при избытке аммиака):
Еще один пример : аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
Видеоопыт взаимодействия аммиака с концентрированными кислотами – азотной, серной и и соляной можно посмотреть здесь.
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 + HCl → NH4Cl
Видеоопыт взаимодействия аммиака с хлороводородом в газовой фазе (дым без огня) можно посмотреть здесь.
3. В качестве основания, водный раствор аммиака реагирует с растворами солей тяжелых металлов , образуя нерастворимые гидроксиды.
Например , водный раствор аммиака реагирует с сульфатом железа (II) с образованием сульфата аммония и гидроксида железа (II):
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – аминокомплексы.
Например , хлорид меди (II) реагирует с избытком аммиака с образованием хлорида тетрамминомеди (II):
Гидроксид меди (II) растворяется в избытке аммиака:
5. Аммиак горит на воздухе , образуя азот и воду:
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
6. За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя , например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием . С металлами реагирует только жидкий аммиак.
Например , жидкий аммиак реагирует с натрием с образованием амида натрия:
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
7. За счет азота в степени окисления -3 аммиак проявляет восстановительные свойства. Может взаимодействовать с сильными окислителями — хлором, бромом, пероксидом водорода, пероксидами и оксидами некоторых металлов. При этом азот окисляется, как правило, до простого вещества.
Например , аммиак окисляется хлором до молекулярного азота:
Пероксид водорода также окисляет аммиак до азота:
Оксиды металлов , которые в электрохимическом ряду напряжений металлов расположены справа — сильные окислители. Поэтому они также окисляют аммиак до азота.
Например , оксид меди (II) окисляет аммиак:
2NH3 + 3CuO → 3Cu + N2 + 3H2O
Источник
§ 23. Аммиак

Какую степень окисления имеет атом азота в аммиаке и почему?
Какая связь называется водородной? Покажите на примере молекулы воды, изучив схему ее образования (см. учебник химии для 8 класса).
Аммиак — одно из важнейших водородных соединений азота (их у него несколько). Он имеет огромное практическое значение. Жизнь на Земле обязана своим существованием способности некоторых бактерий превращать азот воздуха в аммиак.
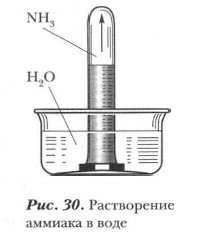
Строение молекулы аммиака. Молекула аммиака образуется за счет ковалентных связей трех p-электронов атома азота с тремя s-электронами атомов водорода (см. рис. 27). Вследствие разницы значений ОЭО атомов азота и водорода связи N—Н полярны. Общие электронные пары смещены к атому азота как к более электроотрицательному. Три атома водорода присоединяются к атому азота так, что их связи образуют углы около 100°, т. е. молекула аммиака имеет пирамидальную форму. Одна из вершин молекулы аммиака занята неподеленной электронной парой атома азота (см. рис. 28). Молекула аммиака сильно полярна.
Получение аммиака. Аммиак может быть получен несколькими способами. В лаборатории аммиак получают действием щелочей на соли аммония при нагревании (см. рис. 29).

Концентрированный раствор аммиака, поступающий в лаборатории, содержит 25% аммиака. В домашнем обиходе используется аптечный раствор «нашатырный спирт», содержащий 10% аммиака.
Физические свойства аммиака. Аммиак — бесцветный газ с резким запахом, почти в два раза легче воздуха. Его относительная плотность по воздуху dв равна 0,48. При охлаждении аммиака до -33 °С он сжижается.
Аммиак прекрасно растворяется в воде вследствие своей полярности (в 1 объеме воды растворяется 700 объемов аммиака), а также благодаря образованию водородных связей между молекулами аммиака и воды.

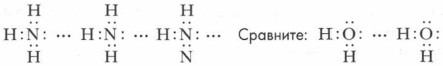
Водородная связь возникает между атомом водорода одной молекулы аммиака, несущим частичный положительный заряд, и электроотрицательным атомом азота другой молекулы аммиака.

Для демонстрации хорошей растворимости аммиака в воде можно провести опыт «Фонтан», который описан при изучении растворимости хлороводо- рода в 8 классе.
Растворимость аммиака еще больше, чем у НСl: в колбе создается вакуум, и немедленно начинает бить фонтан. Если добавить в раствор аммиака лакмус или фенолфталеин, они покажут не кислотный, а щелочной характер раствора, что указывает на наличие в нем гидроксид-иона.

Откуда они взялись в растворе? По всей вероятности, вследствие отнятия от молекул воды ионов водорода Н + молекулами аммиака.
Проблема. Откуда и как в данном растворе появились гидроксид-ионы?
Обратимся вновь к анализу происходящего и с помощью ионных уравнений рассмотрим механизм процесса:
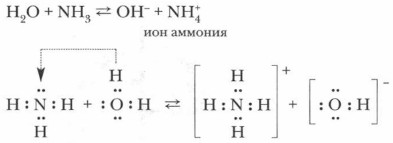
Задание. Попробуйте самостоятельно объяснить этот процесс.

При работе с аммиаком надо помнить, что даже незначительное содержание его приводит к раздражению слизистой оболочки носа, горла и т. д. Повышенное содержание аммиака в воздухе приводит к поражению глаз, воспалению легких.
Средства первой помощи при отравлении аммиаком: свежий воздух, обильное промывание глаз водой, вдыхание водяного пара.
Химические свойства аммиака. Аммиак — химически активное соединение. Он вступает в реакции со многими веществами. Наиболее характерны для него реакции окисления и присоединения, что связано со степенью окисления азота (-3) в молекуле аммиака и с особенностями ее строения.
1. Реакции окисления. В окислительно-восстановительных реакциях аммиак может выступать только в качестве восстановителя.
Он вступает в окислительно-восстановительную реакцию с кислородом — горит в кислороде:
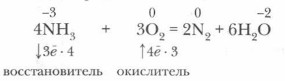

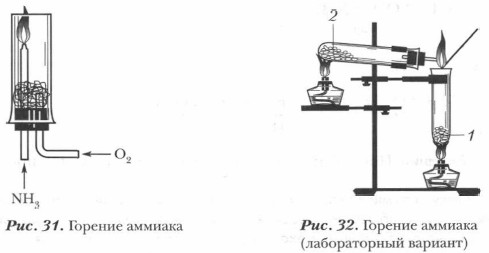


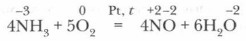
Эта реакция имеет большое значение, так как лежит в основе промышленного получения азотной кислоты из аммиака.
Источник