Классификация питательных сред



При приготовлении питательных сред необходимо учитывать потребность культивируемых микроорганизмов в различных элементах питания. Существует различные классификации питательных сред.
Классификация питательных сред по составу:
1. Простые среды (МПБ, МПА, желатин, пептонная вода). Мясо-пептонный бульон (МПБ) является белковой основой всех сред.
Существует несколько способов приготовления МПБ:
а) на мясной воде с добавлением готового пептона;
б) на переварах продуктов гидролиза исходного сырья при помощи ферментов.
Мясо-пептонный агар (МПА) — получают путем добавления агар-агара (1,5-3%) к МПБ. Если МПА распределен по диагонали пробирки или флакона — это скошенный агар. Если среда распределена в пробирке вертикально высотой 5-7 см, это агар столбиком. МПА, застывший в чашках Петри в виде штастшки — пластинчатый агар. Если среда имеет вертикальный слой высотой 2-3 см, и диагональный слой такой же величины, это полускошенный агар.
2. Сложные среды готовятся на основе простых с определенными добавками (углеводы, кровь, желчь, яйца, сыворотка, молоко, соли, факторы роста и т.п.)
Классификация питательных сред по исходным компонентам:
1. Естественные питательные среды — это натуральный продукт животного или растительного происхождения.
Могут быть:
— Растительные (исходные продукты — соя, горох, картофель, морковь и т.п.).
— Животные (исходные продукты — мясо, рыба, яйца, молоко, животные ткани, желчь, сыворотка крови и т.п.).
— Смешанные (МПА, среда Левенштейна — Йенсена и т.п.).
2. Искусственные среды содержат переработанные естественные продукты (мясную воду, перевар), вещества, полученные из этих продуктов (пептон, дрожжевой и кукурузный экстракты) и различные добавки. Это самая большая и разнообразная по составу наиболее часто применяемая группа сред. Их готовят по определенным рецептам из различных настоев или отваров животного или растительного происхождения с добавлением неорганических солей, углеводов и азотистых веществ.
3. Синтетические среды (известного химического состава) состоят из химически чистых соединений в точно установленных концентрациях (с добавлением углеводов, солей, аминокислот, витаминов и т.п.). На основе этих сред, добавляя к ним естественные или искусственные среды, получают полусинтетические среды.
Классификация питательных сред по консистенции: среды бывают жидкие (среды без агара), полужидкие (с агаром до 1%), плотные (агаровые — 1,5-2,5%). Жидкие среды чаще применяют для изучения физиолого-биохимических особенностей микроорганизмов, для накопления биомассы и продуктов обмена. Полужидкие среды обычно используют для хранения культур, плотные — для выделения микроорганизмов, изучения морфологии колоний, диагностических целей, количественного учета, определения антагонистических свойств и др.
Классификация питательных сред по целевому назначению: универсальные (общеупотребительные) и специальные.
Универсальные (основные) среды. Эти среды используют для культивирования большинства относительно неприхотливых микроорганизмов или применяют в качестве основы для приготовления специальных сред, добавляя к ним кровь, сахар, молоко, сыворотку и другие ингредиенты, необходимые для размножения того или иного вида микроорганизмов. К этой группе относятся: МПБ — мясо-пептонный бульон, МПА — мясо-пептонный агар, МПЖ — мясо-пептонный желатин и т.п.
Специальные среды. Предназначены для выделения и избирательного культивирования определенных видов микроорганизмов, которые не растут на простых средах.
Различают следующие виды специальных сред: среды обогащения, элективные, дифференциально-диагностические, консервирующие и среды накопления.
Среды обогащения. Многие микроорганизмы не растут на обычных средах, поэтому для повышения питательной ценности среды в нее добавляют углеводы (сахарный бульон или агар) или белки (сывороточный агар и бульон, кровяной агар и бульон). Кровяной агар или кровяной бульон — получают путем добавления к питательной среде 5-10% подогретой стерильной дефибринированной крови барана, кролика, лошади, человека. Среда используется для выделения стрептококков, пневмококков и других бактерий, а также для изучения гемолитической активности. Сывороточный бульон или сывороточный агар получают, путем добавления к простым средам 15-20% лошадиной или бычьей сыворотки.

2. Элективные (избирательные) среды. Эти среды предназначены для избирательного выделения и накопления микроорганизмов определенного вида из материала, содержащего несколько видов микробов. При посеве на них материала, содержащего смесь различных микроорганизмов, раньше всего будет проявляться рост того вида, для которого данная среда будет элективной. Избирательность среды достигается путем создания условий, оптимальных для культивирования определенных микробов (рН, Еh, концентрация солей, состав питательных веществ), т.е. положительной селекцией. Или путем добавления в среду веществ, угнетающих другие микроорганизмы (желчь, высокие концентрации NаС1, антибиотики и др.), т.е. отрицательной селекцией. К этой группе относятся:
Селенитовая среда — является лучшей средой обогащения для сальмонелл и дизентерийных микробов Зонне. Селенит натрия, содержащийся в среде, стимулирует рост этих бактерий и подавляет рост сопутствующей флоры.
Висмут-сульфит агар — содержит соли висмута, бриллиантовую зелень. Сальмонеллы растут на этой среде в виде колоний черного цвета. Другие виды бактерий на этой среде роста не дают.
Желточно-солевой агар (ЖСА) — среда для выделения стафилококков, содержит до 10% хлорида натрия, что подавляет большинство бактерий, содержащихся в материале. Кроме того, эта среда является и дифференциально-диагностической, так как присутствие яичного желтка позволяет выявить фермент лецитиназу (лецитовителлазу), который образуют патогенные стафилококки. Лецитиназа расщепляет лецитин на фосфорхолины и нерастворимые в воде жирные кислоты, поэтому среда вокруг лецитиназоположительных колоний мутнеет и появляется опалесцирующая зона в виде «радужного венчика».
Желчный бульон элективен для сальмонелл, размножение которых стимулирует добавленная 10% желчь, одновременно тормозящая рост сопутствующих микроорганизмов.
Щелочной агар или щелочная пептонная вода элективны для холерных вибрионов, щелочная реакция среды (рН 9,0) не препятствует росту холерных вибрионов, но тормозит рост других микроорганизмов. 3-5 сут. Ж
3. Дифференциально-диагностические среды. Дифференциально-диагностические среды применяют для дифференцировки одного вида микроорганизмов от другого по характеру их ферментативной активности. Состав этих сред подбирают с таким расчетом, чтобы четко выявить наиболее характерные свойства определенного вида микроорганизмов, основываясь на особенностях его обмена веществ.
— Среды для выявления протеолитической и гемолитической способности микробов, содержащие в своем составе белковые вещества: кровь, молоко, желатин и т.п. Наиболее распространенными средами являются мясо-пептонный желатин (МПЖ) свернувшаясялошадиная сыворотка, молоко и кровяной агар (КА).
— Среды для изучения гликолитических свойств включают три основных компонента: питательная основа (бульон, агар), субстрат (моно- и дисахара, многоатомные спирты) и индикатор для выявления соответствующих ферментов. Ферментативное расщепление субстратов приводит к сдвигу рН и изменению окраски среды. Наиболее распространены цветные среды с различными углеводами (например, с бромтимоловым синим, индикатором ВР). Также широко распространены среды Гисса, на которых учитывают различия в способности ферментировать различные углеводы с образованием кислоты, либо кислоты и газа.
Для дифференцировки энтеробактерий применяют пептонную воду с набором различных углеводов, индикатором Андреде и поплавками, облегчающими обнаружение газообразования и помогающие визуально определить изменение рН, характерное для различных микроорганизмов. В частности, сдвиг в кислую сторону вызывает покраснение среды с реактивом Андреде или пожелтение при использовании среды с бромтимоловым синим, тогда как при защелачивании индикатор Андреде и бромтимоловый синий не меняют цвет среды. Например, для выделения патогенных бактерий из кишечника применяют среды, которые позволяют дифференцировать патогенные микроорганизмы от постоянных обитателей кишечника — микроорганизмов, разлагающих лактозу.
Такой средой является среда Эндо. Основными компонентами среды Эндо являются МПА, лактоза и основной фуксин, обесцвеченный сульфитом натрия. Исходная питательная среда окрашена в светло-розовый цвет. При сбраживании лактозы образуется ацетальдегид, который реагирует с сульфитом и, высвободившийся при этом, фуксин окрашивает колонии в ярко-красный цвет. Поэтому кишечная палочка, которая сбраживает лактозу, при росте на этой среде образует красные колонии с металлическим блеском, а сальмонеллы и шигеллы — бесцветные, так как они не сбраживают лактозу.
4. Среды накопления, на которых происходит быстрый рост определенных видов микроорганизмов.
5. Консервирующие (транспортные) среды. Предназначены для сохранения микроорганизмов во время транспортировки к месту исследования. Эти среды, содержат добавки, предупреждающие размножение и гибель микробов, что способствует сохранению их жизнеспособности. Наибольшее применение нашли глицериновая смесь (среда Тига), фосфатно-буферная смесь и среды Кари-Блэйра, Амиеса (с активированным углем и без активированного угля), Стюарта и др.
Стерилизация питательных сред.
Все питательные среды независимо от их назначения разливают в чистую посуду и стерилизуют. Большинство сред стерилизуют автоклавированием, но при различных режимах в зависимости от их состава.
1. Синтетические среды и все агаровые среды, не содержащие в своем составе нативного белка и углеводов, стерилизуют 15-20 мин в автоклаве при температуре 115-120°С и давлении 1-1,5 атмосферы.
2. Среды с углеводами и молоком (в состав которого входит лактоза), питательный желатин стерилизуют текучим паром при температуре 100°С дробно или в автоклаве при 112°С и при давлении до 1 атмосферы.
3. Среды, в состав которых входят белковые вещества (сыворотка крови, асцитическая жидкость), обеспложиваются тиндализацией или фильтрованием.
4. Для стерилизации питательных сред, содержащих в своем составе нативные белки, пользуются фильтрацией через мембранные фильтры Зейтца.
Для контроля стерильности среды после стерилизации помещают в термостат при 37°С на 3-5 сут. Жидкие среды должны оставаться прозрачными, а на поверхности и в толще плотных питательных сред не должны появляться признаки роста. Кроме контроля стерильности, про-изводят химический контроль готовых сред, который заключается в том, что в нескольких об-разцах каждой серии определяют рН, количество общего и аминного азота и хлоридов.
Существует также биологический контроль сред. В этом случае несколько образцов среды засевают лабораторной культурой того микроба, для которого приготовлена среда, и изучают характер его роста. Только после того, как среды выдержали контроль, их можно использовать по назначению.
Источник
Классификация питательных сред и способы их приготовления



Питательные среды классифицируют в зависимости от исходных компонентов, консистенции, целевого назначения, химического состава.
В зависимости от химического состава и исходных компонентов различают следующие типы питательных сред.
Среды неопределенного химического состава. Их подразделяют на: 1) среды животного происхождения (исходные продукты — мясо, рыба, яйца, молоко и т.д.); 2) среды растительного происхождения (исходные продукты — соя, горох, картофель, морковь и т.д.).
Некоторые продукты используют в натуральном виде (картофель, морковь, молоко и т. д.), но чаще животные и растительные ткани подвергают различной обработке (экстрагированию, ферментативному или кислотному гидролизу).
Среды известного химического состава (синтетические). В них входят известные химические соединения (соли, углеводы, аминокислоты, витамины и т. д.) в оптимальном количественном соотношении. Синтетические питательные среды используют, когда выращиваемую клеточную массу необходимо максимально освободить от балластных органических соединений, входящих в состав обычных сред, например при получении диагностических аллергенов или при изучении метаболических потребностей микроорганизма в том или ином конкретном химическом соединении.
По консистенции питательные среды дифференцируют на плотные, полужидкие и жидкие.
Жидкие питательные среды. Готовят, используя экстракты, гидролизаты, растворы исходных продуктов.
Полужидкие и плотные питательные среды. Необходимую консистенцию среде придают добавлением различных уплотнителей.
Агар-агар (малайское желе) — полисахарид, продукт переработки некоторых морских водорослей. Плавится при 80. 86 ºС, затвердевает при 40 ºС. Для получения плотных сред его добавляют в количестве 1,5. 2%, реже 3 %; полужидких — 0,3. 0,7%.
Желатина — экстракт из тканей, содержащих много коллагена (кости, хрящи, сухожилия и т.д.). Желатиновый гель плавится при 25 °С, что делает его неудобным для выращивания микроорганизмов с температурным оптимумом 37. 38 °С. Кроме того, ряд бактерий выделяют протеолитические ферменты, разлагающие желатину. Обычно в питательные среды вносят 10. 20 % желатины.
По целевому назначению различают общеупотребительные (основные), обогащенные, специальные, элективные (избирательные) и дифференциально-диагностические питательные среды.
Общеупотребительные (основные) среды. Их применяют для культивирования относительно неприхотливых микроорганизмов.
В качестве исходных компонентов для приготовления основных сред используют наиболее часто мясную воду, перевар Хоттингера, растительные гидролизаты.
Мясная вода: говядину освобождают от костей, жира, сухожилий, пропускают через мясорубку. Мясной фарш заливают водопроводной водой в соотношении 1: 2, кипятят 1 ч. После кипячения мясную воду охлаждают, фильтруют через ватно-мар-левый фильтр, затем доливают водопроводной водой до первоначального объема, разливают по емкостям, закрывают ватно-мар-левыми пробками и стерилизуют при 120 °С 20 мин.
Перевар Хоттингера готовят из мясных отходов путем их триптического гидролиза. Жир, фасции, сухожилия мелко нарезают, заливают кипящей водой в соотношении 1:2, кипятят, охлаждают до 45 °С и добавляют панкреатин, подщелачивают раствором карбоната натрия до рН 7,8. 8,0, встряхивают и добавляют хлороформ (10 мл/л), плотно закрывают, выдерживают в теплом месте 10 дней, получают продукт гидролиза (перевар).
Мясо-пептонный бульон (МПБ). К 1 л мясной воды добавляют 1 % пептона[1] и 0,5 % хлорида натрия, устанавливают необходимый рН дробным добавлением 10%-го раствора гидроксида натрия или гидроксида калия. Фильтруют через бумажный фильтр, разливают по колбам, пробиркам и стерилизуют при 120 «С 15. 20 мин.
Рис. 32. Приготовление скошенного агара
Мясо-пептонный агар (МПА): к МПБ добавляют 2. 3 % промытого мелко нарезанного агар-агара, нагревают до расплавления агара, доводят до кипения, в горячем виде проверяют рН, затем, если необходимо, доводят его до нужного значения (7,2. 7,6), фильтруют через ватно-марлевый фильтр. Профильтрованный горячий агар разливают по пробиркам и колбам, стерилизуют автоклавированием при 1 атм 20. 30 мин. Чтобы получить скошенную поверхность агара, удобную для посева, после стерилизации пробирки с расплавленным МПА оставляют при комнатной температуре до уплотнения в наклонном положении (конец с пробкой приподнят) (рис. 32).

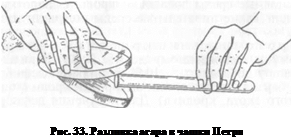
Широко используют культивирование микроорганизмов на плотных питательных средах в чашках Петри. Диаметр стандартной чашки Петри (рис. 33) около 10 см, выпускают чашки меньшего и большего диаметров, а также одноразовые пластиковые. В стандартные стерильные чашки Петри над пламенем горелки наливают около 20 мл расплавленного и охлажденного до 45. 50 «С питательного агара, чашки помещают на горизонтальную поверхность до застывания агара.
 |
Полужидкий мясо-пептонный агар (ПЖА) готовят, как МПА, но добавляют 0,25 % агара. Кипятят при помешивании до полного расплавления агара, устанавливают рН 7,2. 7,6, фильтруют в горячем виде, стерилизуют в автоклаве.
Мясо-пептонная желатина (МПЖ): к МПБ добавляют 10. 20% измельченной желатины, нагревают до расплавления уплотнителя, устанавливают рН 7,2. 7,4, кипятят, фильтруют через ватно-марлевый фильтр, разливают по пробиркам и стерилизуют дробно в аппарате Коха три дня по 20 мин или однократно в автоклаве при 112°С 15 мин.
Бульон Хоттингера: основной перевар Хоттингера разводят водопроводной водой в соотношении 1 :5 (1:8) до содержания аминного азота 120 мг%, добавляют 0,5% хлорида натрия, 0,1 г гидрофосфата калия, устанавливают рН 7,4. 7,6, кипятят 15. 20 мин, фильтруют через ватно-марлевый или бумажный фильтр, разливают по емкостям и стерилизуют при 120 °С 20. 30 мин.
Агар Хоттингера готовят, добавляя к бульону Хоттингера 2 % агар-агара.
Предприятия биологической промышленности выпускают готовые питательные бульон и агар в виде сухого порошка.
Питательный бульон содержит (г/л): триптический гидролизат кильки — 10,05, хлорид натрия — 4,95. Навеску порошка массой 15 г растворяют в 1 л дистиллированной воды, кипятят 2 мин, фильтруют через бумажный фильтр, разливают по емкостям и стерилизуют в автоклаве при 120 ºС 20 мин (рН 7,3).
Питательный агар содержит (г/л): ферментативный гидролизат кормовых дрожжей — 12,0; агар— 12,5; хлорид натрия — 5,5. Навеску порошка массой 36 г растворяют в 1 л дистиллированной воды, кипятят 3 мин, фильтруют через ватный фильтр, стерилизуют при 120 «С 20 мин (рН 7,3).
Обогащенные среды. Многие виды болезнетворных бактерий плохо растут на общеупотребительных питательных средах, поэтому в основные среды добавляют кровь, сыворотку крови, углеводы и т. д. Такие питательные среды получили название обогащенных.
Сывороточный и кровяной агары: к расплавленному и охлажденному до 45. 50°С стерильному питательному агару добавляют 5. 10% стерильной дефибринирован-ной крови барана (кролика) или сыворотки крови (лошади, крупного рогатого скота, кролика). Для получения дефибринирован-ной крови у барана кровь берут асептично из яремной вены стерильной иглой в стерильный флакон (или колбочку) со стеклянными (фарфоровыми) бусами или шариками, встряхивают вращательными движениями 15. 20 мин, чтобы предотвратить свертывание крови. Фибрин остается на бусах.
Компоненты перемешивают, разливают в чашки Петри, пробирки и оставляют до застывания питательной среды.
Сывороточный и кровяной бульоны готовят аналогичным образом.
Растворы углеводов (глюкоза и др.) стерилизуют текучим паром или фильтрованием и добавляют в количестве 0,5. 1 % к питательной среде.
Специальные среды. Так называют среды, разработанные с учетом специфических ростовых потребностей ряда бактерий. Например, желточная среда Мак-Коя для возбудителя туляремии, среда Терских для культивирования лептоспир и др.
Среда Мак-Коя: чистые куриные яйца обрабатывают спиртом, быстро проводят через пламя горелки. Стерильно вскрывают, желтки отделяют от белков. К 60 частям желтков добавляют 40 частей физиологического раствора (рН 7,0. 7,2). Компоненты перемешивают, разливают в пробирки по 4. 5 мл и помещают в наклонном положении в аппарат для свертывания сыворотки. Стерилизуют в первый день при 75 °С 1 ч, на второй день при 85 °С 30 мин. Для контроля стерильности приготовленные среды выдерживают 2 сут в термостате при 37. 38 °С.
Среда Терских состоит из фосфатной смеси Зеренсе-на и кроличьей сыворотки. Смесь Зеренсена: раствор А: гидрофосфат натрия — 11,876 г, вода дистиллированная — 1000 мл; раствор Б: дигидрофосфат калия — 9,078 г, вода дистиллированная — 1000 мл. К 90 мл раствора А добавляют 10 мл раствора Б и доводят объем дистиллированной водой до 1000 мл. Раствор разливают в пробирки по 5 мл, стерилизуют при 1,5 атм 20 мин. В каждую пробирку добавляют шесть—восемь капель стерильной инактивированной при 56 °С сыворотки кролика.
Элективные среды (лат. electus — избранный). Это питательные среды для избирательного выделения и накопления микроорганизмов определенного вида из материалов, содержащих несколько видов микробов. Элективные среды чрезвычайно многообразны по своему составу. В них включают компоненты, обеспечивающие преимущественный рост искомого микроорганизма и (или) подавляющие в той или иной степени рост сопутствующей микрофлоры. По консистенции среды данного типа могут быть плотными и жидкими. Жидкие элективные среды называют средами обогащения или накопления, их применяют, когда ставят цель увеличить количество искомого микроорганизма в смешанной популяции.
Молочно-солевой агар предназначен для избирательного культивирования стафилококков. К расплавленному МПА с рН 7,2. 7,4, содержащему 5. 7,5 % хлорида натрия, добавляют 10 % стерильного обезжиренного молока, перемешивают и разливают в чашки Петри.
Среда Шустовой предназначена для выделения сальмонелл. Представляет собой МПА (рН 7,4) с добавлением 10 % к объему среды 50%-го водного раствора тиосульфата натрия и 2 % раствора Люголя.
Среда Раппопорт предназначена для культивирования сальмонелл. К МПБ добавляют 1 % глюкозы, 10 % желчи, 1 % индикатора Андрэдэ. Стерилизуют текучим паром.
Среда Мюллера предназначена для культивирования сальмонелл. В колбу с 4,5 г стерильного мела наливают 90 мл МПБ, стерилизуют в автоклаве при 120 «С 30 мин. Затем стерильно добавляют 2 мл раствора Люголя и 10 мл раствора тиосульфата натрия (тиосульфат натрия — 50 г, дистиллированная вода — 100 мл), стерилизуют в аппарате Коха 30 мин.
Среда Кауфмана — это среда обогащения для сальмонелл. К 100 мл среды Мюллера добавляют 1 мл водного раствора бриллиантового зеленого, разведенного 1 : 1000, и 5 мл стерильной бычьей желчи. Смесь стерилизуют текучим паром 30 мин.
Казеиново-угольный агар (КУА) с пенициллином используют для культивирования бордетелл. К 1000 мл дистиллированной воды добавляют гидролизат казеина — 20 мл, хлорид натрия — 5 г, хлорид калия — 0,2 г, хлорид кальция — 0,002 г, карбонат натрия — 0,4 г, хлорид магния — 0,025 г, гидрофосфат калия — 0,24 г, растворимый крахмал — 1 г, цистин — 0,01 г, агар —20 г. Компоненты растворяют, устанавливают рН 7,2, стерилизуют при 0,5 атм 30 мин. Перед употреблением в расплавленный агар (50 °С) добавляют 3 % дрожжевого экстракта и 0,2 % сухого активированного угля и 0,5 ЕД/мл пенициллина. Компоненты перемешивают и разливают по чашкам Петри.
Дифференциально-диагностические среды. Предназначены для выявления ферментов у микроорганизмов. По консистенции могут быть жидкими, полужидкими, плотными. В состав этих сред входят основная питательная среда, обеспечивающая рост изучаемого микроорганизма, субстрат для обнаружения фермента и индикатор, по изменению цвета которого судят о сдвиге рН среды в результате расщепления субстрата.
К питательным средам такого типа относят среды Гисса, Эндо, Плоскирева, Левина и др.
Среды Гисса используют для изучения ферментативных свойств выделенных культур микроорганизмов. К 100 мл дистиллированной воды добавляют 1 % пептона, 0,5 г хлорида натрия. Компоненты растворяют, фильтруют через бумажный фильтр, устанавливают рН 7,0. 7,4, добавляют один из углеводов-субстратов (лактоза, глюкоза и т.д.), агар-агар (0,3. 0,4 %), а затем 1мл индикатора Андрэдэ или 0,1мл 1,6%-го раствора бромтимолового синего. Готовую среду разливают по 3 мл в пробирки, стерилизуют текучим паром три дня подряд по 30 мин или при 112 °С 20 мин.
Выпускают сухие среды Гисса с индикатором BP — смесь водно-голубого с розоловой кислотой (готовые среды — полужидкой консистенции).
Плотные дифференциально-диагностические среды применяют для первичной изоляции возбудителей из материала. В их состав нередко кроме известного субстрата входят вещества, придающие питательной среде селективные свойства.
Среда Эндо содержит лактозу в качестве субстрата и предназначена для дифференциации бактерий, различающихся по способности расщеплять лактозу.
К 1000 мл расплавленного МПА (рН 7,4) температурой 70 °С добавляют 1 г лактозы, предварительно растворенной в небольшом количестве дистиллированной кипяченой воды. В отдельных пробирках готовят: 2. 3 мл спиртового раствора основного фуксина; 10 мл 10%-го водного раствора сульфата натрия.
В стерильную пробирку вносят 1 мл раствора фуксина и добавляют раствор сульфита натрия до обесцвечивания фуксина. Приготовленную смесь вливают в расплавленный агар, перемешивают и разливают по чашкам Петри. Готовая среда бесцветна, при росте на ней микроорганизмов, расщепляющих лактозу, среда закисляется, обесцвеченный фуксин восстанавливается, и колония микроорганизма, например эшерихий, приобретает красный цвет с металлическим оттенком. Среду готовят за сутки до ее использования. Выпускают также сухую среду Эндо. Перед употреблением определенную навеску порошка вносят в дистиллированную воду, кипятят и разливают по чашкам Петри.
Среда Левина аналогична по целевому назначению среде Эндо, но содержит другой индикатор (эозин с метилено-вым синим). К 100 мл расплавленного МПА (рН 7,2. 7,4) добавляют 2 мл 0,5%-го водного раствора метиленового синего, 1,5 мл 2%-го раствора эозина желтого, 2 г лактозы, 0,2 г дигидрофосфата калия. Растворы красителей готовят на дистиллированной воде, стерилизуют текучим паром 60 мин. Лактозу и дигидрофос-фат калия предварительно разводят в небольшом количестве стерильной дистиллированной воды и кипятят. Колонии лактозопо-зитивных бактерий на этой среде окрашены в фиолетово-черный цвет.
Агар Плоскирева предназначен для выделения сальмонелл, содержит лактозу в качестве субстрата и компоненты, подавляющие рост сопутствующей микрофлоры. Среду выпускают в виде порошка, в ее состав кроме питательной агаровой основы входят: желчные соли, цитрат натрия, тиосульфат натрия, фосфат натрия, бриллиантовый зеленый, кальцинированная сода, йод, хлорид натрия, лактоза, нейтральный красный. Навеску порошка растворяют в воде, кипятят и разливают в чашки Петри. Готовая среда прозрачная или розоватая. Колонии сальмонелл бесцветные, эшерихий — брусничного цвета.
 |
Методы культивирования микроорганизмов. Наряду с общими принципами культивирование микроорганизмов различных физиологических групп имеет некоторые особенности Культивирование аэробных и факультативно-анаэробных бактерий. Плотные, жидкие или полужидкие питательные среды, засеянные чистыми культурами микроорганизмов или исследуемым материалом, помещают в термостаты (рис. 34), поддерживающие оптимальную для данного микроорганизма температуру. При температурах, превышающих верхнюю границу нормы, бактерии не только замедляют рост, но и быстро гибнут. При температуре ниже оптимальной скорость роста микроорганизма постепенно замедляется.
У мезофилов температурный оптимум находится в интервале 30. 37 ºС, у психрофилов — 10. 15 ºС, у термофилов — 50. 60 ºС.
Микроорганизмы в процессе культивирования на питательных средах при условии, что в среды не вносят дополнительные вещества, постепенно замедляют и затем прекращают свой рост из-за истощения питательного субстрата, изменения оптимальных значений биофизических показателей (рН, Eh и т.д.). Такое культивирование микроорганизмов называют периодическим. Если при этом жидкую питательную среду в процессе инкубирования посевов не перемешивают, то такой способ культивирования определяют как стационарный. При диагностических бактериологических исследованиях обычно используют именно такой способ культивирования. В биологической промышленности при производстве вакцин и других биопрепаратов, когда необходимо достичь максимального выхода бактериальной массы или экзотоксинов, применяют периодическое культивирование в жидких средах с их интенсивным перемешиванием.
При таких задачах аэробные бактерии культивируют в колбах, бутылях на шюттель-аппаратах с частотой колебания 150. 250 мин-1, что облегчает передачу бактериям кислорода и питательных компонентов.
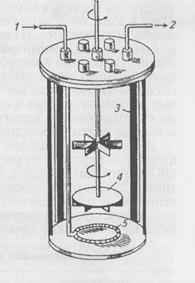
Рис. 35. Схема ферментера для глубинного культивирования аэробных микроорганизмов.
1 – вход воздуха; 2 – выход воздуха; 3 – отбойники; 4 – мешалка; 5 — барботер
Наиболее эффективное культивирование бактерий в жидких питательных средах с максимальным выходом биопродукта достигают в ферментерах. Ферментеры (реакторы) представляют собой металлические или стеклянные культуральные сосуды емкостью от 500 мл до 1000 л (рис. 35). При культивировании бактерий в ферментерах среду перемешивают специальными мешалками с одновременной подачей необходимого количества стерильного воздуха. Ферментеры конструируют как автономные системы с автоматической регуляцией температуры и рН среды. В ферментерах также осуществляют непрерывное (проточное) культивирование, при котором в отличие от периодической культуры автоматически в среду подаются свежие питательные компоненты со скоростью, равной удалению аналогичного объема выросшей культуры бактерий. Такое непрерывное культивирование в хорошо отрегулированной системе в принципе можно продолжать неограниченно долго.
Культивирование анаэробных бактерий. Облигатные анаэробы — бактерии, у которых энергетический и конструктивный метаболизм происходит без молекулярного кислорода 02. У таких микроорганизмов в процессе дыхания конечными акцепторами
электронов являются окись углерода (IV), ионы сульфата, фумарат и др. Кроме того, молекулярный кислород действует на многие анаэробы губительно. Например, строгие анаэробы погибают при незначительных концентрациях кислорода (бактероиды, фузобак-терии), умеренные анаэробы менее чувствительны (С. perfringens), аэротолерантные анаэробы могут расти в условиях обычной атмосферы (молочнокислые бактерии). Большинство болезнетворных анаэробов относят к строгим или умеренным анаэробам. Для их культивирования используют специальные питательные среды и газовые смеси. Последними наполняют анаэростаты.
Необходимое условие роста облигатных анаэробов — не столько отсутствие молекулярного кислорода, сколько низкий ОКВП питательных сред. Резко восстановительных условий достигают, добавляя в среды редуцирующие (восстанавливающие) вещества и одновременно удаляя из них молекулярный кислород. В качестве редуцирующих веществ в питательные среды добавляют химические соединения, приведенные в таблице 1.
1. Восстанавливающие вещества для культивирования анаэробов
Источник