Способы проведения качественного анализа
(реакции и методы обнаружения)
Существует два способа проведения качественного анализа: «сухой» и «мокрый». К сухим способам относят методы определения ионов без предварительного перевода пробы в раствор. Это такие, как: методы растирания, перлов, возгонов и пирохимическая реакция. Чувствительность их относительно невысока, а точность идентификации во многом зависит от состава пробы и концентрации определяемого компонента, наличия мешающих ионов.
Метод растирания порошков был предложен в 1898 г. Ф. М. Флавицким. Его применяют только для высоко чувствительных реакций с низкой энергией активации, так как для запуска таких реакций обычно достаточно небольшого механического воздействия: растирания или прессования. В настоящее время этот метод находит применение преимущественно в полевых условиях в геологии, а также – для быстрого прикидочного анализа на ионы Fe 3+ .
Выполняют анализ с использованием агатовых или яшмовых, иногда — фарфоровых, ступок. Так, при анализе методом растирания ионов Fe 3+ роданидным способом их наличие идентифицируют по появлению характерного розового окрашивания порошка. Аналогично можно определять ион Co 2+ в сульфате. В отличии от водных растворов, при растирании CoSO4 с роданидными солями сразу же появляется синее окрашивание, так как комплекс не гидратирует.
Метод перлов или плавов (термохимический) представляет собой определение ионов по окраске плава, полученного спеканием определяемого вещества с боратами или фосфатами щелочных металлов: Na2B4O7 – бура; Na2HPO4. При охлаждении полученной стекловидной массы в присутствии анализируемого иона появляется характерная окраска. Так ионыхромапридают боратному стеклу (перлу)зеленый цвет, а ионы кобальта в этих же условиях дают при охлаждении перл с розовой или фиолетовой окраской.
Пирохимическая реакция позволяет очень быстро определить катионы по окрашиванию пламени газовой горелки, которое характерно для ионов с низкими значениями энергии ионизации, в первую очередь, это ионы щелочных и щелочноземельных металлов. Данный метод применяют при предварительном испытании пробы, так как точность и чувствительность его не высока, а результаты не всегда однозначны. Для идентификации катионов по окрашиванию пламени пользуются справочными данными (таблица 3.6) или делают контрольный опыт с раствором не содержащим мешающих примесей.
Таблица 3.4 – Пирохимическое определение катионов по
окрашивание пламени некоторыми элементами
| ион | окраска пламени | ион | окраска пламени |
| Li * литий | кармино-красная, | In * индий | сине-фиолетовая |
| Na * натрий | желтая, интенсивная | Tl * таллий | изумрудно-зеленая |
| K * калий | лиловая, слабая | Pb * свинец | красно-фиолетовая |
| Rb * рубидий | розово-фиолетовый | As * мышьяк | бледно-синий |
| Cs * цезий | красно-фиолетовая | Sb * сурьма | бледно-синий |
| Ca * кальций | кирпично-красная, интенсивная | Se * селен | бледно-синий |
| Sr * стронций | кармино-красная, интенсивная | Te * теллур | изумрудно-зеленый |
| Ba * барий | бледно-зеленая | Cu * медь | зеленый, голубой |
| B * бор | зеленый | Mo * молибден | желто-зеленый |
Для проведения анализа применяют предварительно прокаленную в растворе HCl платиновую или нихромовую петлю, в которую помещают порошок (можно и каплю раствора, но при этом чувствительность реакции уменьшается). Петлю с образцом вносят в среднюю, наиболее горячую, часть пламени и определяют его цвет. Для повышения чувствительности иногда наблюдения ведут через специальные стекла – светофильтры, поглощающие мешающее излучение.
Сущность метода возгонов заключается в образовании некоторыми металлами при нагреве на воздухе летучих окрашенных оксидов или же спеков (корольков). Для получения возгона используют калильную трубку. Иногда нагревание выполняют над раскаленным углем (восстановитель). Идентификацию проводят по цвету налетов в холодной части трубки или по цвету королька. Так свинец при нагревании на воздухе образует налет оксида характерного желтого цвета.

Кмокрым способам анализа относят все виды определений, при которых анализируемое вещество предварительно переводят в раствор. Это такие методы, как: пробирный анализ, капельный, экстракционный и микрокристаллоскопический. В качестве растворителя чаще всего используют воду, реже – органические растворители (CCl4, бензол, спирты и эфиры) из-за их летучести и токсичности.
Пробирный анализ выполняют в цилиндрических пробирках объемом 5 – 10 мл, в которые отбирают примерно 0,5 – 1 мл анализируемого раствора и добавляют по каплям реагент. Так как большинство реакций очень чувствительны и протекают с высокой скоростью, то в среднем добавляют 3 – 5 капель реагента, которых вполне достаточно для появления четкого аналитического признака. При необходимости анализ может выполняться с нагревом на водяной или песочной бане, или на газовой горелке.
Экстракционный анализ используют при определении веществ из разбавленных растворов. Аналитический признак — появление характерного окрашенного кольца органического растворителя (экстрагента) в верхней части раствора или же окрашенных капель внизу пробирки (при большой концентрации вещества). В качестве экстрагентов обычно применяют готовую смесь органического растворителя с реагентом, чаще всего — комплексоном. Таким образом поступают при определении ионов цинка раствором дитизона (реагент) в CCl4 (экстрагент). Аналитическим признаком ионов Zn 2+ является появление в верхней части пробирки красного кольца.
Если экстрагент – летуч, а признак – неустойчив, то в водный раствордобавляют сначала реагент, а потом уже экстрагент. Например, при определении ионов Co 2+ : сначала проводят реакцию в водном растворе с роданидом калия, а затем — экстракцию образовавшегося роданидного комплекса амиловым спиртом (образование сине-фиолетового кольца).
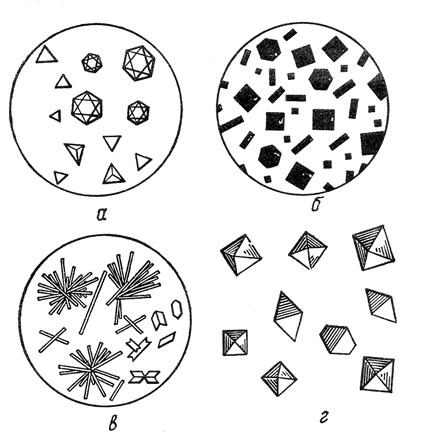
Микрокристаллоскопический анализ основан на идентификации ионов по цвету и форме кристаллов. Он предложен академиком Ловиц Т. Е. в 1798 г. Реакцию проводят на предметном стекле, куда наносят каплю исследуемого препарата и реагента. Рост кристаллов и их окраску наблюдают в микроскоп и сравнивают с образцами в определителях (рис. 3.4). При необходимости ускорения роста кристаллов препарат слегка подсушивают.
Рисунок 3.4 – Сравнительный вид кристаллов различных соединений:
а – лимонного цвета уранилацетата натрия (NaUO2(CH3COO)3);
б – черные или коричневые гексанитрокупрата (II) калия-свинца
в – белого цвета сульфата кальция дигидрата – гипса (CaSO4×2H2O);
г – бесцветные гексахлоростанната (IV) аммония ((NH4)2[SnCl6]).
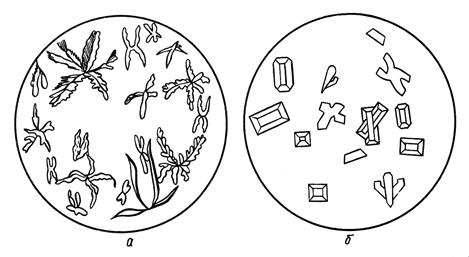
Форма кристаллов может значительно варьировать в зависимости от концентрации растворов, скорости кристаллизации, температуры и влажности среды (рис. 3.5). Тем не менее, данный вид анализа не потерял своей значимости, так как ряд соединений имеет достаточно характерный цвет и вид кристаллов, что позволяет их надежно интерпретировать (рис. 3.4 и 3.5).
Рисунок 3.5 Кристаллы MgNH4PO4×6H2O, выделенные при определении ионов Mg 2+ из а) концентрированного; б) разбавленного раствора.
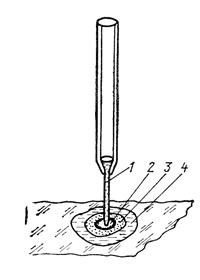
Капельный метод анализа впервые предложен в 1920 г. профессором Тананаевым Н. А. и не потерял своей актуальности до сих пор. Его применяют при малых объемах проб или концентрации вещества, а выполняют на фильтровальной бумаге, часовом стекле или специальных стеклянных пластинках с углублением, что позволяет существенно повысить чувствительность реакций. При проведении капельного анализа на фильтр последовательно наносят с помощью пипетки капли анализируемого раствора и реагента (рис. 3.6). Аналитическим признаком в этом методе является характерная окраска образовавшегося пятна. Например, ионы Mn 2+ со свежеприготовленным раствором аммиаката серебра дают на фильтре пятно серого цвета. Аналогично можно определить ионы железа с помощью гексацианоферратов калия, алюминия – ализариновой пробой.
Рисунок 3.6. – Прибор для проведение капельной реакции: 1 – капилляр
или пипетка с раствором реагента; 2 – образовавшееся цветное пятно;
3 – край пятна анализируемого раствора; 4 – граница растворителя.
Источник
Основные положения качественного анализа. Способы проведения аналитических реакций
1. Сущность и методы качественного анализа
Основной задачей качественного анализа является установление химического состава, т.е. обнаружение ионов (катионов и анионов), содержащихся в анализируемом веществе.
Химические методы обнаружения и идентификации веществ основаны на проведении аналитических реакций.
Аналитические реакции — качественные реакции, сопровождающиеся видимым изменением:
Образованием или растворением осадка.
Ba 2+ + SO4 2- → BaSO4↓ (белый кристаллический)
Ba 2+ + CO3 2- → BaCO3↓ (белый кристаллический)
BaSO4 не растворяется в кислотах, BaCO3 растворяется в кислотах.
Образованием характерных кристаллов.
Кристаллы CaSO4⋅2H2O в виде пучков или звездочек. Кристаллы
натрийуранилацетата CH3COONa⋅UO2(CH3COO)2 правильной тетраэдрической
или октаэдрической формы.
Появлении или изменении окраски растворов.
Водные растворы солей железа (III) окрашены в желтый цвет. При взаимодействии ионов Fe 3+ c тиоцианат-ионами раствор приобретает темно-красную окраску:
Fe 3+ + 3SCN — → Fe(SCN)3(темно-красная)
Выделение газа.
Реакции выделения газов используются для обнаружения анионов летучих и неустойчивых кислот, а также катионов аммония:
Химические реакции проводят в основном двумя способами: «сухим путем» и «мокрым путем». Если реакции проводят между твердыми веществами, то их относят к реакциям «сухим путем», а реакции в растворах называют реакциями «мокрым путем».
Реакции «сухим путем»:
Анализ «сухим» способом проводят без переведения исследуемого твердого вещества в раствор. Этот способ анализа играет вспомогательную роль и применяется для предварительных испытаний. Его осуществляют с помощью таких приемов, как проба на окрашивание пламени и получение окрашенных перлов.
1. Растирание исследуемого твердого вещества с определенным твердым реактивом (предложен русским химиком Ф.М.Флавицкаим)
Так для обнаружения тиоцианат-иона NCS — несколько кристаллов исследуемого твердого вещества, например KNCS, растирают на фарфоровой пластинке с твердым нитратом железа Fe(NO3)3 . Смесь приобретает красную окраску.
При растирании солей аммония с известью образуется аммиак, который легко определить по характерному запаху или с помощью смоченной лакмусовой бумажки.
2. Пирохимические реакции – реакции окрашивания пламени.
Некоторые элементы, входящие в состав исследуемого вещества окрашивают пламя в характерный для них цвет. Для выполнения реакции на очищенной платиновой или нихромовой проволоке вносят вещество в основание пламени горелки, а затем переводят в часть с наивысшей температурой и по окрашиванию пламени делают вывод о наличии определенного иона. Натрий окрашивает пламя в желтый цвет, калий — в фиолетовый, барий – в желто-зеленый, кальций – в кирпично-красный. Вместо проволоки можно применять грифель.
3. Образование окрашенных перлов (стекол) тетрабората натрия Na2B4O7 · 10H2O (бура) или карбоната натрия (сода) Na2CO3. Соединения отдельных элементов, сплавленные с бурой или содой, образуют стекловидные шарики – «перлы», окрашенные в характерный для данного иона цвет. Например, соединения хрома – в зеленый, кобальта – в синий.
Реакции «мокрым путем»:
При этом анализируемое вещество сначала растворяют, затем проводят исследование. В качестве растворителя применяют дистиллированную воду, растворы минеральных кислот (НCl, HNO3 , H2SO4), щелочей, «царскую водку» (смесь из 3 объемов концентрированной соляной кислоты и 1 объема концентрированной азотной кислоты).
В зависимости от того, с каким количеством вещества проводят аналитические реакции, различают следующие методы качественного анализа: макро-, полумикро-, микро-, ультро-, субмикро-, субультромикрометоды. В учебной практике аналитической химии применяют макро-, полумикро- и микроанализы. Для проведения ультромикро-, субмикро-, субультромикроанализа необходимы специальные условия и аппаратура.
1) макрометод – обычно для анализа берется проба от 0,1 до 1 г, которая растворяется в 30-50 мл растворителя. Реакции проводят в пробирках с 2-3 мл полученного раствора;
2) микрометод – масса анализируемого вещества колеблется от 0,001 до 0,01 г. Реакции проводят капельным методом или микрокристаллоскопическим методом, о присутствии определяемого иона судят по форме кристаллов, которые рассматриваются в микроскоп;
3) полумикрометод – анализ проводят с количеством вещества от 0,01 до 0,1 г. Объем раствора пробы составляет 0,1–2 мл.
Принципиально ход анализа макро- и полумикрометодом не различается, но при выполнении анализа полумикрометодом для быстрого отделения малых количеств осадка необходимы центрифуга и посуда меньших размеров.
Описание методов приведено в таблице:
В зависимости от массы или объема раствора исследуемого вещества реакции выполняют пробирочным, капельным и микрокристаллоскопическим методами.
При выполнении анализа реакции проводят в пробирках объемом 2-5 см 3 . Для отделения осадков от растворов применяют центрифугирование, выпаривание ведут в тиглях.
Метод разработан в 1920 г. Н.А.Тананаевым, осуществляется на фарфоровых или стеклянных пластинках, а также на полосках фильтровальной бумаги нанесением 1 капли исследуемого раствора и 1 капли реактива. Появление осадка удобно наблюдать на стеклянной пластинке, появление окраски – на белой пластинке или на полоске бумаги.
Капельный анализ отличается высокой чувствительностью, экономичностью и специфичностью.
Этот метод основан на обнаружении компонентов при помощи реакций, в результате которых образуются соединения с характерной формой кристаллов. При этом используют микроскоп. Реакции проводят на предметных стеклах, куда помещают 1 каплю исследуемого раствора и 1 каплю характерного реактива на определенный ион. Через некоторое время появляются определенной формы и цвета кристаллы соединения искомого иона. Таким образом, можно обнаружить катионы натрия, магния, кальция.
Источник