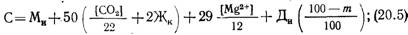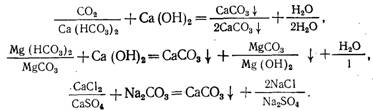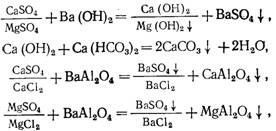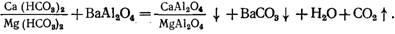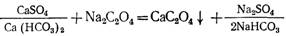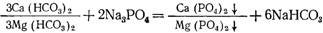Известково-содовый метод умягчения воды
Сущность известково-содового метода умягчения воды сводится к следующим основным процессам:
Этим методом остаточная жесткость может быть доведена до 0,5-1,0; щелочность – до 0,8-1,2 мг-экв/л.
Дозу извести Ди при известково-содовом методе определяют по формуле:
22 12 lк
где Жк – жесткость карбонатная.
Дозу соды Дс при известково-содовом методе определяют по формуле:
где Дс – доза соды в пересчете на Na2CO3, мг/л;
Жнк – жесткость некарбонатная.
При известково-содовом методе умягчения воды образующиеся CaCO3 и Mg(OH)2 могут перенасыщать растворы и долго оставаться в коллоидном состоянии. Переход в грубодисперсный шлам длителен.
При умягчении воды содово-натровым методом воду обрабатывают содой и гидроксидом натрия:
При высокой концентрации гидрокарбонатов в воде и низкой некарбонатной жесткости избыток Na2CO3 может оставаться в умягченной воде. Поэтому данный метод применяется лишь с учетом соотношений между карбонатной и некарбонатной жесткостью. Если карбонатная жесткость равна некарбонатной, то соду можно не добавлять, поскольку необходимое количество ее для умягчения воды образуется в результате взаимодействия гидрокарбонатов с NaOH. Доза кальцинированной соды увеличивается по мере повышения некарбонатной жесткости воды.
Термохимический метод умягчения воды
Этим методом умягчение воды производят при температуре воды выше
100°С. Более интенсивному умягчению воды при ее подогреве способствует:
● образование тяжелых и крупных хлопьев осадка;
● быстрейшее его осаждение вследствие снижения вязкости воды при нагревании;
● сокращается также расход извести, так как CO2 удаляется при нагревании.
Термохимический метод может применяться с добавлением и без добавления коагулянта, поскольку большая плотность осадка исключает необходимость его утяжеления.
Термохимический метод применяют при использовании воды в паровых котлах.
В качестве реагентов при этом методе применяют известь и соду, реже – гидроксид натрия и соду.
Содержание в воде магния может быть снижено до 0,05-0,1 мг-экв/л.
Фосфатный метод умягчения воды самостоятельно не применяют из-за высокой стоимости реагента. Фосфаты применяют для доумягчения воды после ее обработки другими реагентами, например, известью и содой.
В качестве реагентов применяют ди- и тринатрий фосфат.
При добавлении этих реагентов к воде образуются малорастворимые фосфаты кальция и магния:
Процесс фосфатного доумягчения воды проводят обычно при температуре выше 100°С.
Остаточная жесткость при этом получается 0,04-0,05 мг-экв/л. Схема установки приведена на рисунке 18.9 (слайд 60).
Магнитная обработка воды
В последнее время в отечественной и зарубежной литературе появляются сообщения об успешном применении магнитной обработки с целью интенсификации процессов очистки воды, для борьбы с накипеобразованием и инкрустацией.
Механизм действия магнитного поля на воду окончательно не выяснен. Все существующие гипотезы Тебенихин и Гусев классифицировали в три группы:
● первая, объединяющая большинство гипотез, связывает действие магнитного поля на ионы солей. Под влиянием магнитного поля происходит поляризация и деформация ионов, сопровождающиеся уменьшением их гидратации, что повышает вероятность их сближения и образования центров кристаллизации;
● вторая предполагает действие магнитного поля на примеси воды, находящиеся в коллоидном состоянии;
● третья – возможность влияния магнитного поля на структуру воды. Это влияние вызывает изменение в агрегации воды и нарушает ориентацию ядерных атомов водорода в молекуле.
Наиболее широко магнитная обработка воды распространена в борьбе с накипеобразованием. Принцип метода заключается в том, что при пересечении водой магнитных силовых линий накипеобразователи выделяются не на поверхности нагрева, а в массе воды.
Метод эффективен для кальциево-карбонатных вод, которые составляют 80% вод всех водоемов.
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.
Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ — конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
Папиллярные узоры пальцев рук — маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.
Источник
Вы освоили некий источник водоснабжения на своем участке — выкопали колодец или пробурили скважину для хозяйственно-бытовых нужд дома.
И столкнулись с такой проблемой:
- белые следы на сантехнике,
- накипь в чайнике,
- ощущение сухости кожи,
- жесткие волосы после мытья
- на электронагревательных приборах образуется известковая корка

Анализ воды, который Вы сделали в химической лаборатории показал: очень жесткая вода! >25мг/л.экв и/или высокая общая минерализация воды, сухой остаток более 1500мг/л.
Фирмы предлагают Вам дорогущие методы очистки ионообменными смолами без гарантии… Вы получаете примерно такие такие письма в ответ на свой запрос об очистке воды:
«Здравствуйте.
в связи с многократным превышением ПДК по жесткости, а так же по солесодержанию и сульфатам, Комплекс водоподготовки с монтажом обойдется от 300 тыс. рублей, в противном случае гарантию на качество очищенной воды не даем. Если Вы готовы на такие расходы- пришлем предложение.»
Для удаления солей жесткости можно умягчать воду с помощью ионообменных смол, либо синтетического цеолита, но во-первых, максимальное количество солей жесткости,с которыми можно справиться умягчителем не более 15 мг/л экв., во-вторых общую минерализацию воды снизить умягчителем не получится, ведь умягчение — это не удаление, а замещение одних ионов на другие.
Стоимость умягчителя для стандартного удаления солей жесткости начинается от 23 000р с хорошей американской автоматикой. Для подбора умягчителя присылайте анализ на почту samopalych@yandex.ru — я предложу Вам подходящий вариант.
Что делать, если умягчитель бесполезен, а система обратного осмоса на весь дом слишком дорогая (>2000$)? С такой водой жить тяжело, потому что она оставляет бело-рыжие наросты на сантехнике, которые невозможно вывести, очень быстро засоряется солями жесткости боилер, нагревательная спираль стиралки и посудомойки, а что творится в чайнике — лучше не смотреть.
Особая проблема с такой водой встает перед фермерами, садоводами, разводчиками рыбы, ведь такая вода непригодна для кормления скота и полива растений, подпитки пруда. А воды этой нужно очень много.
В случае высокой общей минерализации воды умягчитель не поможет и остается только два способа:
- дорогой обратный осмос,
- дешевый, но требующий регулярного приложения рук процесс химической очистки воды от солей жесткости — известково-содовым методом.
Заключается известково-содовый метод в растворении небольшого количества реагента в накопительной емкости с водой, выпадает осадок, воду забираем на очистку, осадок сливаем в дренаж.
Известково-содовый метод умягчения воды:
В емкость общим объемом, скажем, 1 куб набираем воду.
Вносим в воду 50-70 гр Оксида Кальция (CaO) (негашеной тонкодисперсной извести), либо Са(ОН)2 в виде суспензии
В школьном курсе неорганической химии (9 класс) рассказывается об этих метода удаления солей жесткости (36:10):
Лучше всего вносить реагенты в виде суспензии — крутого раствора, похожего на молоко. Разводим нужное количество реагента в 3-5 литрах воды и выливаем в емкость, перемешиваем палкой-мешалкой….

Автоматизация процесса не составит труда при использовании дозатора, например, попробуйте дозатор в виде ижектора для удобрений, продаётся он на алиэкспресс. Ищется по словам (инжектор, эжектор, ижектор для удобрений) стоит он примерно 700 рублей с доставкой.
Возможно применение и более дорогих и точных дозаторов, однако, точность дозировки в бытовых условиях не имеет значения, учитывая малую стоимость реагента (гашеной извести).
Чтобы сделать устойчивую суспензию (водный раствор) гашеной извести и не позволить извести оседать на дно — заставьте раствор постоянно перемешиваться с помощью аквариумной помпы.
Вода помутнеет в процессе протекания химической реакции, станет теплее — соли кальция и магния (Карбонат кальция и гидроксид Магния) переходят в коллоидную форму, иначе говоря «твердеют», выделяются из раствора в свободные вещества и будут медленно оседать на дно.
Нужно дать воде отстояться до полного осаждения солей. Это может занять от 5 до 10 часов. Зависит от жесткости воды, температуры и многих других факторов.
Когда вода станет прозрачной — ее можно перелить в другую емкость или забрать сразу на расход самотеком, если емкость на чердаке, либо насосом. Не рекомендую использовать вибрационный насос — он будет поднимать муть со дна и засасывать ее. Лучше использовать колодезный погружной насос, либо насосную станцию.
Причем воду надо забирать не с самого дна, а см 30-40 над дном, а у самого дна или лучше в самом дне сделать сливной кран для очистки емкости (слива осадка). Когда воды в емкости почти не осталось — взболомучиваем весь осадок и сливаем воду. Эту процедуру нужно будет делать пару раз в год.
Воду на расход следует дополнительно очищать, прежде, чем подавать в дом хотя бы пропуская через магистральный фильтр 5-10 мкм, но лучше через осветлительный фильтр колонного типа с ручным или автоматическим клапаном управления. Картридж нужно будет менять раз в 2-3 месяца.
Можно сделать схему непрерывного действия, имея одну-две накопительные емкости для подготовки воды и еще одну емкость для отстоенной воды на расход.
Данная реагентная емкость одновременно и аэрирует воду, поэтому, если в воде есть растворенное железо, марганец, органические вещества, сероводород, то гидроокись лучше всего фильтровать через обезжелезиватель на автоматическом клапане.
Если данная схема вызывает у Вас практический интерес и Вы хотели бы применить ее у себя в доме — напишите мне на е-мейл, я займусь этим постом — доведу его до ума, нарисую необходимые схемы и вообще обсудим детали реализации данного проекта.
Источник
Реагентные методы умягчения воды.
Умягчение воды реагентными методами основано на обработке ее реагентами, образующими с кальцием и магнием малорастворимые соединения: Mg (OH) 2, СаС03, Са3 (Р04) 2, Mg3 (P04) 2 и другие с последующим их отделением в осветлителях, тонкослойных отстойниках и осветлительных фильтрах. В качестве реагентов используют известь, кальцинированную соду, гидроксиды натрия и бария и другие вещества.
Умягчение воды известкованием применяют при ее высокой карбонатной и низкой некарботаной жесткости, а также в случае, когда не требуется удалять из воды соли некарбонатной жесткости. В качестве реагента используют известь, которую вводят в виде раствора или суспензии (молока) в предварительно подогретую обрабатываемую воду. Растворяясь, известь обогащает воду ионами ОН — и Са 2+ , что приводит к связыванию растворенного в воде свободного оксида углерода (IV) с образованием карбонатных ионов и переходу гидрокарбонатных ионов в карбонатные:
Повышение в обрабатываемой воде концентрации ионов С03 2 — и присутствие в ней ионов Са 2+ с учетом введенных с известью приводит к повышению произведения растворимости и осаждению малорастворимого карбоната кальция:
При избытке извести в осадок выпадает и гидроксид магния
Mg 2+ + 20Н — → Mg (ОН) 2
Для ускорения удаления дисперсных и коллоидных примесей и снижения щелочности воды одновременно с известкованием применяют коагуляцию этих примесей сульфатом железа (II) т.е. FeS04*7 Н20. Остаточная жесткость умягченной воды при декарбонизации может быть получена на 0,4.0,8 мг-экв/л больше некарбонатной жесткости, а щелочность 0,8.1,2 мг-экв/л. Доза извести определяется соотношением концентрации в воде ионов кальция и карбонатной жесткости: а) при соотношении [Са 2+ ] /20 2+ ] /20 > Жк,
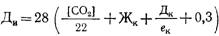
где [СО2] — концентрация в воде свободного оксида углерода (IV), мг/л; [Са 2+ ] — концентрация ионов кальция, мг/л; Жк — карбонатная жесткость воды, мг-экв/л; Дк — доза коагулянта (FeS04 или FeCl3 в пересчете на безводные продукты), мг/л; ек — эквивалентная масса активного вещества коагулянта, мг/мг-экв (для FeS04 ек = 76, для FeCl3 ек = 54); 0,5 и 0,3 — избыток извести для обеспечения большей полноты реакции, мг-экв/л.
Выражение Дк/ек берут со знаком минус, если коагулянт вводится раньше извести, и со знаком плюс, если совместно или после.
При отсутствии экспериментальных данных дозу коагулянта находят из выражения
где С — количество взвеси, образующейся при умягчении воды (в пересчете на сухое вещество), мг/л.
В свою очередь, С определяют, используя зависимость
где Ми — содержание взвешенных веществ в исходной воде, мг/л; m — содержание СаО в товарной извести, %.
a) Известково-содовый метод умягчения воды .
Описывается следующими основными реакциями:
По этому методу остаточная жесткость может быть доведена до 0,5.1, а щелочность с 7 до 0,8.1,2 мг-экв/л.
Дозы извести Ди и соды Дс (в пересчете на Na2C03), мг/л, определяют по формулам
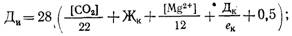
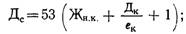
где [Mg 2+ ] — содержание в воде магния, мг/л; Жн. к. — некарбонатная жесткость воды, мг-экв/л.
При известково-содовом методе умягчения воды образующиеся карбонат кальция и гидроксид магния могут пересыщать растворы и долго оставаться в коллоидно-дисперсном состоянии. Их переход в грубодисперсный шлам длителен, особенно при низких температурах и наличии в воде органических примесей, которые действуют как защитные коллоиды. При большом их количестве жесткость воды при реагентном умягчении воды может снижаться всего на 15.20%. В подобных случаях перед умягчением или в процессе его из воды удаляют органические примеси окислителями и коагулянтами. При известково-содовом методе часто процесс проводят в две стадии. Первоначально из воды удаляют органические примеси и значительную часть карбонатной жесткости, используя соли алюминия или железа с известью, проводя процесс при оптимальных условиях коагуляции. После этого вводят соду и остальную часть извести и доумягчают воду.При удалении органических примесей одновременно с умягчением воды в качестве коагулянтов применяют только соли железа, поскольку при высоком значении рН воды, необходимом для удаления магниевой жесткости, соли алюминия не образуют сорбционно-активного гидроксида. Дозу коагулянта при отсутствии экспериментальных данных рассчитывают по формуле (20.4). Количество взвеси определяют по формуле
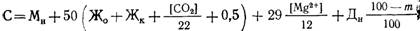
где Жо — общая жесткость воды, мг-экв/л.
Более глубокое умягчение воды может быть достигнуто ее подогревом, добавлением избытка реагента-осадителя и созданием контакта умягчаемой воды с ранее образовавшимися осадками. При подогреве воды уменьшается растворимость СаСО3 и Mg (OH) 2 и более полно протекают реакции умягчения.
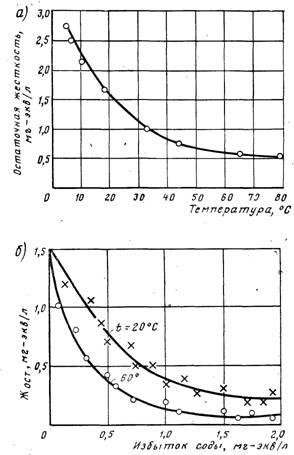
Из графика (рис. 2, а) видно, что остаточная жесткость, близкая к теоретически возможной, может быть получена только при значительном подогреве воды. Значительный эффект умягчения наблюдается при 35.40°С, дальнейший подогрев менее эффективен. Глубокое умягчение ведут при температуре выше 100° С. Большой избыток реагента-осадителя при декарбонизации добавлять не рекомендуется, так как возрастает остаточная жесткость из-за непрореагировавшей извести или при наличии в воде магниевой некарбонатной жесткости вследствие ее перехода в кальциевую жесткость:
Поэтому рекомендуется принимать избыток извести не более 0,5 мг-экв/л. Зависимость остаточной жесткости воды от дозы извести приведена на рис. 2, б.
Рис. 2. Влияние температуры (а) и дозы извести (б) на глубину умягчения воды известково-содовым и известковым методом
При известково-содовом методе также не рекомендуется применять большие избытки извести, однако, в данном случае они не вызывают увеличения остаточной жесткости, поскольку снимаются содой
но избыток извести приводит к нерациональному перерасходованию соды, повышению стоимости умягчения воды и увеличению гидратной щелочности. Поэтому избыток соды принимают около 1 мг-экв/л. Жесткость воды в результате контакта с ранее выпавшим осадком понижается на 0,3.0,5 мг-экв/л п сравнению с процессом без контакта с осадком.
Контроль процесса умягчения воды следует осуществлять коррекцией рН умягченной воды. Когда это невозможно, его контролируют по значению гидратной щелочности, которую при декарбонизации поддерживают в пределах 0,1.0,2 мг-экв/л, при известково-содовом умягчении — 0,3.0,5 мг-экв/л.
b) содово-натриевый метод умягчения воды.
Описывается следующими основными реакциями:
Ввиду того, что сода образуется при реакции гидроксида натрия с гидрокарбонатом, необходимая для добавки в воду доза ее значительно уменьшается. При высокой концентрации гидрокарбонатов в воде и низкой некарбонатной жесткости избыток соды может оставаться в умягченной воде. Поэтому этот метод применяют лишь с учетом соотношения между карбонатной и некарбонатной жесткостью.
Содово-натриевый метод обычно применяют для умягчения воды, карбонатная жесткость которой немного больше некарбонатной. Если карбонатная жесткость приблизительно равна некарбонатной, соду можно совсем не добавлять, поскольку необходимое ее количество для умягчения такой воды образуется в результате взаимодействия гидрокарбонатов с едким натром. Доза кальцинированной соды увеличивается по мере повышения некарбонатной жесткости воды.
Содорегенеративный метод, основанный на возобновлении соды в процессе умягчения, применяют при подготовке воды, для питания паровых котлов низкого давления
Гидрокарбонат натрия, попадая в котел с умягченной водой, разлагается под влиянием высокой температуры
Образующаяся при этом сода вместе с избыточной, введенной вначале в водоумягчитель, тут же в котле гидролизует с образованием гидроксида натрия и оксида углерода (IV), который с продувочной водой поступает в водоумягчитель, где используется для удаления из умягчаемой воды гидрокарбонатов кальция и магния. Недостаток этого метода состоит в том, что образование значительного количества СО2 в процессе умягчения вызывает коррозию металла и повышение сухого остатка в котловой воде.
c) Бариевый метод умягчения воды.
Применяют в сочетании с другими методами. Вначале вводят барий содержащие реагенты в воду (Ва (ОН) 2, ВаСО3, ВаА1204) для устранения сульфатной жесткости, затем после осветления воды ее обрабатывают известью и содой для доумягчения. Химический процесс описывается реакциями:
Из-за высокой стоимости реагентов бариевый метод применяют очень редко. Для подготовки питьевой воды из-за токсичности бариевых реагентов он непригоден. Образующийся сульфат бария осаждается очень медленно, поэтому необходимы отстойники или осветлители больших размеров. Для ввода ВаС03 следует использовать флокуляторы с механическими мешалками, поскольку ВаСО3 образует тяжелую, быстро осаждающуюся суспензию.
Необходимые дозы бариевых солей, мг/л, можно найти, пользуясь выражениями: гидроксида бария (продукт 100% -ной активности) Дб =1,8 (SO4 2- ), алюмината бария Дб=128Ж0; углекислого бария Дв = 2,07γ (S04 2- );
Углекислый барий применяют с известью. Путем воздействия углекислоты на карбонат бария получают бикарбонат бария, который и дозируют в умягчаемую воду. При этом дозу углекислоты, мг/л, определяют из выражения: Дуг. = 0,46 (SO4 2- ); где (S04 2- ) — содержание сульфатов в умягчаемой воде, мг/л; γ=1,15.1,20 — коэффициент, учитывающий потери углекислого бария.
d) Оксалатный метод умягчения воды.
Основан на применении оксалата натрия и на малой растворимости в воде образующегося оксалата кальция (6,8 мг/л при 18° С)
Метод отличается простотой технологического и аппаратурного оформления, однако, из-за высокой стоимости реагента его применяют для умягчения небольших количеств воды.
Применяют для доумягчения воды. После реагентного умягчения известково-содовым методом неизбежно наличие остаточной жесткости (около 2 мг-экв/л), которую фосфатным доумягчением можно снизить до 0,02-0,03 мг-экв/л. Такая глубокая доочистка позволяет в некоторых случаях не прибегать к катионитовому водоумягчению.
Фосфатированием достигается также большая стабильность воды, снижение ее коррозионного действия на металлические трубопроводы и предупреждаются отложения карбонатов на внутренней поверхности стенок труб.
В качестве фосфатных реагентов используют гексаметафос — фат, триполифосфат (ортофосфат) натрия и др.
Фосфатный метод умягчения воды при использовании три — натрийфосфата является наиболее эффективным реагентным методом. Химизм процесса умягчения воды тринатрийфосфатом описывается реакциями
Как видно из приведенных реакций, сущность метода заключается в образовании кальциевых и магниевых солей фосфорной кислоты, которые обладают малой растворимостью в воде и поэтому достаточно полно выпадают в осадок.
Фосфатное умягчение обычно осуществляют при подогреве воды до 105.150° С, достигая ее умягчения до 0,02.0,03 мг-экв/л. Из-за высокой стоимости тринатрийфосфата фосфатный метод обычно используется для доумягчения воды, предварительно умягченной известью и содой. Доза безводного тринатрийфосфата (Дф; мг/л) для доумягчения может быть определена из выражения
где Жост — остаточная жесткость умягченной воды перед фосфатным доумягчением, мг-экв/л.
Образующиеся при фосфатном умягчении осадки Са3 (Р04) 2 и Mg3 (P04) 2 хорошо адсорбируют из умягченной воды органические коллоиды и кремниевую кислоту, что позволяет выявить целесообразность применения этого метода для подготовки питательной воды для котлов среднего и высокого давления (58,8.98,0 МПа).
Раствор для дозирования гексаметафосфата или ортофосфата натрия с концентрацией 0,5-3% приготовляют в баках, количество которых должно быть не менее двух. Внутренние поверхности стенок и дна баков должны быть покрыты коррозионноустойчивым материалом. Время приготовления 3% -ного раствора составляет 3 ч при обязательном перемешивании мешалочным или барботажным (с помощью сжатого воздуха) способом.
Заключение.
В данном реферате рассмотрены методы умягчения воды. Каждый метод по-своему уникален и удобен для использования в промышленности в наши дни.
Список используемой литературы
2. Алексеев Л.С., Гладков В.А. Улучшение качества мягких вод. М., Стройиздат, 1994 г.
3. Алферова Л.А., Нечаев А.П. Замкнутые системы водного хозяйства промышленных предприятий, комплексов и районов. М., 1984.
4. Аюкаев Р.И., Мельцер В.З. Производство и применение фильтрующих материалов для очистки воды.Л., 1985.
5. Вейцер Ю.М., Мииц Д.М. Высокомолекулярные флокулянты в процессах очистки воды. М., 1984.
Источник