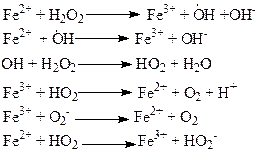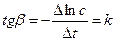Работа № 26. ИЗМЕРЕНИЕ СКОРОСТИ РАЗЛОЖЕНИЯ ПЕРОКСИДА ВОДОРОДА ГАЗОМЕТРИЧЕСКИМ МЕТОДОМ
Цель работы − определение основных кинетических параметров химической реакции: средней константы скорости, порядка реакции и энергии активации. Ознакомление с газометрическим методом изучения кинетики химических реакций, протекающих с участием газообразных веществ.
Пероксид водорода в водных растворах самопроизвольно разлагается по уравнению с выделением газообразного кислорода
В присутствии некоторых катионов и анионов разложение заметно ускоряется. Реакция может служить примером гомогенной каталитической реакции. Разложение Н2О2сопровождается выделением О2. За ходом реакции следят по изменениям объема выделившегося кислорода через различные промежутки времени от начала реакции.
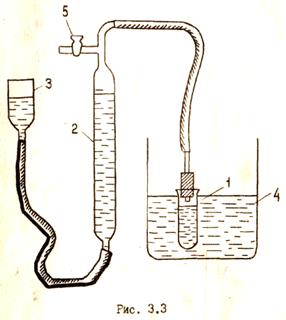
Схема прибора для изучения кинетики разложения пероксида водорода представлена на рис. 3.3.
Порядок выполнения работы
1. Налить в реакционный сосуд (1) раствор катализатора и при открытом кране (5) поместить сосуд в термостат (4). Вид катализатора и температурный режим процесса определяется преподавателем.
2. С помощью уравнительного сосуда (3) установить уровень воды в бюретке (2) на нулевом делении или около него. Закрыть кран (5) и проверить прибор на герметичность.
3. Выдержать реакционный сосуд в термостате
20 мин. и влить в него по указанию преподавателя определенное количество пероксида водорода. Раствор перемешать, встряхивая реакционный сосуд с закрытой пробкой. кран вверху бюретки держать открытым 1 мин. для вытеснения воздуха, затем его закрыть.
4. Установить на одной отметке уровни жидкости в бюретке (2)и в уравнительном сосуде (3), чтобы привести давление в приборе к атмосферному. Записать исходный уровень жидкости в бюретке и время на часах.
5. В ходе реакции делать замеры уровня жидкости в измерительной бюретке через каждые 2-3 мин. в течение 30-36 мин. Следить, чтобы при измерениях уровни жидкости в бюретке и уравнительном сосуде были одинаковыми.
6. После того как реакция практически прекратится, реакционный сосуд поместить в кипящую водяную баню на 15 мин. При кипячении на водяной бане уравнительный сосуд поддерживать в самом высоком положении.
7. Охладитьреакционный сосуд до температуры термостата, выдержать в течение 10-15 мин., после чего замерить уровень жидкости в бюретке (α∞).
8. Результаты измерений занести в таблицу, записав следующие условия опыта:
| Номер измерения | Время от начала реакции τ, мин | Объем выделившегося О2, мл | Максимальный объем выделившегося О2 α∞ , мл | α∞-ατ | tg(α∞-ατ) | Константа скорости, k |
9. Построить кинетическую кривую αt = f(τ).
10. Рассчитать константу скорости для трех-четырех измерений τ при установившемся режиме (в середине процесса) по кинетическому уравнению первого порядка, где концентрации пероксида водорода заменить пропорциональными им величинами объемов выделившегося кислорода. Следует считать, что максимальный объем выделившегося кислорода пропорционален начальной концентрации пероксида водорода, а объем α∞-ατ пропорционален изменению концентрации пероксида водорода к моменту от начала реакции. Тогда

11. Вычислить среднее значение константы скорости реакции.
12. Построить график зависимости tg(α∞-αt) = f(τ), откладывая время в минутах по оси абсцисс. Для реакции первого порядка эта зависимость выражается прямой, тангенс угла наклона которой к оси τесть константа скорости.
13. Определить константу скорости по графику и сравнить с вычисленной. С учетом перевода натурального логарифма в десятичный k = 2,3 tgφ.
14. Записать уравнение химической реакции разложения пероксида водорода и кинетическое уравнение реакции.
15. Получив у преподавателя значение константы скорости при другой температуре, рассчитать энергию активации реакции.
Источник
Работа № 26. ИЗМЕРЕНИЕ СКОРОСТИ РАЗЛОЖЕНИЯ ПЕРОКСИДА ВОДОРОДА ГАЗОМЕТРИЧЕСКИМ МЕТОДОМ
Цель работы − определение основных кинетических параметров химической реакции: средней константы скорости, порядка реакции и энергии активации. Ознакомление с газометрическим методом изучения кинетики химических реакций, протекающих с участием газообразных веществ.
Пероксид водорода в водных растворах самопроизвольно разлагается по уравнению с выделением газообразного кислорода
В присутствии некоторых катионов и анионов разложение заметно ускоряется. Реакция может служить примером гомогенной каталитической реакции. Разложение Н2О2сопровождается выделением О2. За ходом реакции следят по изменениям объема выделившегося кислорода через различные промежутки времени от начала реакции.
Схема прибора для изучения кинетики разложения пероксида водорода представлена на рис. 3.3.
Порядок выполнения работы
1. Налить в реакционный сосуд (1) раствор катализатора и при открытом кране (5) поместить сосуд в термостат (4). Вид катализатора и температурный режим процесса определяется преподавателем.
2. С помощью уравнительного сосуда (3) установить уровень воды в бюретке (2) на нулевом делении или около него. Закрыть кран (5) и проверить прибор на герметичность.
3. Выдержать реакционный сосуд в термостате
20 мин. и влить в него по указанию преподавателя определенное количество пероксида водорода. Раствор перемешать, встряхивая реакционный сосуд с закрытой пробкой. кран вверху бюретки держать открытым 1 мин. для вытеснения воздуха, затем его закрыть.
4. Установить на одной отметке уровни жидкости в бюретке (2)и в уравнительном сосуде (3), чтобы привести давление в приборе к атмосферному. Записать исходный уровень жидкости в бюретке и время на часах.
5. В ходе реакции делать замеры уровня жидкости в измерительной бюретке через каждые 2-3 мин. в течение 30-36 мин. Следить, чтобы при измерениях уровни жидкости в бюретке и уравнительном сосуде были одинаковыми.
6. После того как реакция практически прекратится, реакционный сосуд поместить в кипящую водяную баню на 15 мин. При кипячении на водяной бане уравнительный сосуд поддерживать в самом высоком положении.
7. Охладить реакционный сосуд до температуры термостата, выдержать в течение 10-15 мин., после чего замерить уровень жидкости в бюретке (α∞).
8. Результаты измерений занести в таблицу, записав следующие условия опыта:
| Номер измерения | Время от начала реакции τ, мин | Объем выделившегося О2, мл | Максимальный объем выделившегося О2 α∞ , мл | α∞ -ατ | tg(α ∞ -ατ) | Константа скорости, k |
9. Построить кинетическую кривую αt = f(τ).
10. Рассчитать константу скорости для трех-четырех измерений τ при установившемся режиме (в середине процесса) по кинетическому уравнению первого порядка, где концентрации пероксида водорода заменить пропорциональными им величинами объемов выделившегося кислорода. Следует считать, что максимальный объем выделившегося кислорода пропорционален начальной концентрации пероксида водорода, а объем α∞— ατ пропорционален изменению концентрации пероксида водорода к моменту от начала реакции. Тогда
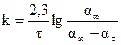
11. Вычислить среднее значение константы скорости реакции.
12. Построить график зависимости tg(α∞-αt) = f(τ), откладывая время в минутах по оси абсцисс. Для реакции первого порядка эта зависимость выражается прямой, тангенс угла наклона которой к оси τесть константа скорости.
13. Определить константу скорости по графику и сравнить с вычисленной. С учетом перевода натурального логарифма в десятичный k = 2,3 tgφ.
14. Записать уравнение химической реакции разложения пероксида водорода и кинетическое уравнение реакции.
15. Получив у преподавателя значение константы скорости при другой температуре, рассчитать энергию активации реакции.
Источник
Порядок выполнения работы
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ЮГОРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ИНСТИТУТ ГЕОЛОГИИ НЕФТИ И ГАЗА
КАФЕДРА ХИМИИ
Лабораторная работа
Изучение скорости разложения пероксида водорода газометрическим методом: гомогенный и
Гетерогенный катализ
Лабораторные работы по физической химии
для студентов института геологии нефти и газа
обучающихся по специальности 020100 «Химия»
Курс III, семестр 6
Ханты-Мансийск·2009
Лабораторная работа №5
Изучение скорости разложения пероксида водорода газометрическим методом:
гомогенный и гетерогенный катализ
Цель работы: определить несколькими методами порядок реакции, аналитически и графически определить среднюю константу скорости при различных концентрациях катализатора.
Общие положения
Пероксид водорода в водных растворах самопроизвольно медленно разлагается по уравнению:
В присутствии катионов и анионов некоторых органических веществ, а также ряда твердых веществ разложение перексида водорода (H2O2) значительно ускоряется. Следовательно, эта реакция в водных растворах может быть гомогенной и гетерогенной каталитической реакцией в зависимости от взятого катализатора.
Механизм реакции включает следующие стадии:
Катализ разложения H2O2 хлоридом железа (III) происходит по общей схеме:
А + К—[АК] (первая стадия),
[АК] — В + К (вторая стадия),
где А – перексид водорода, К – катализатор.
Равновесие устанавливается быстро, и скоростьопределяющей стадией является распад [AK].
Аналитический способ определения порядка реакции
Порядок реакции по концентрации H2O2– первый (или близкий к первому) и для расчета константы скорости используют уравнение:

Подставляя в это уравнение опытные значения концентрации исследуемого вещества в разные моменты времени протекания реакции, вычисляем k. Если расчетные k остаются постоянными, то это означает, что порядок реакции по этому веществу равен единице.
Начальная и текущая концентрации H2O2 пропорциональны объемам кислорода, выделившегося к концу реакции V¥ и разности между V¥ и текущим объемом кислорода Vt. В соответствии с этим, уравнение для расчета константы скорости в данном случае примет следующий вид:
Графический способ определения порядка реакции

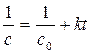
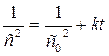
Как видно из этих уравнений, график, построенный по опытным данным для концентраций рассматриваемого исходного вещества в разные моменты времени протекания реакции, будет выражаться прямой линией в разных координатах в зависимости от порядка данной реакции по веществу. А именно, при n = 1 – в координатах ln с – t; при n = 2 – в координатах 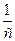
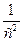
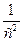
К реакциям первого порядка относятся реакции, в которых концентрация одного из реагирующих веществ остается постоянной. Для реакции типа 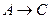
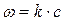
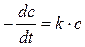
Разделив переменные, 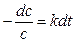

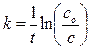

то есть график в координатах lnс – t будет линейным; по углу наклона этого графика можно оценить k.
Для проверки порядка реакции графическим способом (только для гомогенного катализа) строят график ln(w¢)=f[ln(V¥ – Vt)]. На этом графике должна получиться прямая линия, угловой коэффициент которой в соответствии с уравнением lgw=lgk + nlgc должен быть равен порядку реакции, поскольку коэффициент пропорциональности между w¢ и w тот же, что и между (V¥ – Vt) и c (Н2О2). Свободный член полученной зависимости равен lnk только в том случае, если получился порядок равный единице, в ином случае значение свободного члена зависит от порядка реакции и коэффициента пропорциональности между (V¥ – Vt) и c (Н2О2).
|
Рис. 1. График зависимости логарифма концентрации от времени
для реакции первого порядка
Для нахождения значений w’ необходимо построить график (V¥ – Vt) = f(t), т.е. кинетическую кривую, причем следует иметь в виду, что по оси ординат отложена не концентрация, а пропорциональная ей величина. Не менее чем для трех произвольно выбранных значений времени на этом графике найти значения производной
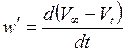
проведя касательные к выбранным точкам и определив их тангенс наклона. Полученные таким образом значения производной w¢ не равны, но пропорциональны значениям скорости w в выбранные моменты времени. Касательные на кинетической кривой проводятся не к экспериментально определенным точкам (производная к точке и, соответственно, касательная к точке – бессмысленные понятия), а к сглаженной линии, наилучшим образом проходящей через экспериментальные точки.
Реактивы и оборудование: 3%-ный раствор хлорида железа (III); 3%-ный раствор пероксида водорода; оксид алюминия (III); оксид марганца (IV); 3%-ный раствор иодида калия; водяная баня – 1 шт.; термометр до 100°С – 1 шт.; установка для газометрических измерений – 1 шт.; градуированная пипетка на 10 мл – 2 шт.; секундомер – 1 шт.
Порядок выполнения работы
Для изучения скорости разложения пероксида водорода используют установку, показанную на рисунке 2, которая позволяет измерять объем выделяющегося кислорода.
В одно колено реактора 1 с помощью пипетки помещают 10 мл 3%-ного раствора пероксида водорода, а во второе – 0,5 мл раствора хлорида железа (III) и с помощью пробки соединяют реакционный сосуд с мерной бюреткой.
Перед началом эксперимента проверяют герметичность системы. Для этого с помощью трехходового крана 3 соединяют измерительный сосуд 4 одновременно с реакционным сосудом 1 и с атмосферой. Поднимают уравнительный сосуд 5, чтобы заполнить бюретку жидкостью до нулевой отметки, после чего соединяют бюретку 4 только с реакционным сосудом 1 и опускают сосуд 5 примерно на четверть высоты бюретки. Если обеспечена герметичность, то уровень затворной жидкости в бюретке 4, опустившись на небольшую величину, должен остановиться, не достигнув уровня жидкости в уравнительном сосуде и должен оставаться неизменным в течение 2-3 минут. После этого при поднимании уравнительного сосуда до уровня жидкости в бюретке, последний должен вновь вернуться к нулевой отметке.
Рис. 2. Схема установки для изучения скорости разложения пероксида водорода:
1 – реакционный сосуд; 2 – пробка, соединяющая реакционный сосуд с мерной бюреткой;
3 – трехходовой кран; 4 – мерная бюретка, 5 – уравнительный сосуд, 6 – термостат.
После проверки герметичности приступают к выполнению эксперимента. Для этого пероксид водорода переливают в колено с катализатором, реакционный сосуд 1 встряхивают несколько раз для более полного перемешивания. Время смешения принимают за время начала реакции. Кислород, выделяющийся в ходе реакции, будет вытеснять жидкость из мерной бюретки. Фиксируют объем выделившегося кислорода в зависимости от времени протекания реакции. Измерения проводят через 1, 2, 4, 6, 10, 15, 20 … минут от начала реакции. При измерениях уровень жидкости в уравнительном сосуде 5 поддерживают на уровне жидкости в мерной бюретке 4. Измерения заканчивают, если в течение 10 мин объем кислорода не увеличивается.
Если в ходе реакции возникает риск, что объем мерной бюретки окажется недостаточным, следует произвести последний замер объема и по возможности быстро с помощью крана 3 соединяют бюретку 4 с атмосферой. С помощью сосуда 5 устанавливают уровень жидкости в бюретке на нулевой отметке и вновь краном 3 соединяют реакционный сосуд 1 только с бюреткой 4. Продолжают измерения, прибавляя объем кислорода, выпущенного в атмосферу (значение последнего измерения перед соединением бюретки с атмосферой).
По окончанию процесса выделения пузырьков кислорода приступают к определению V¥. Для этого реакционный сосуд 1 помещают в водяную баню с температурой воды 70-80°С и выдерживают его при этой температуре до тех пор, пока объем выделившегося кислорода не будет оставаться постоянным в течение 5-10 минут. В этот момент можно считать, что реакция полностью завершилась, однако измерение значения V¥ следует производить только после извлечения реакционного сосуда водяной бани и приведения его к прежней температуре.
Опыты повторяют, увеличивая объем раствора катализатора до 1,0 и 1,5 мл.
Результаты опытов и расчетов оформляют в виде таблиц, предваряя их следующими данными.
Объем пероксида водорода..………………………………мл
Концентрация пероксида водорода..………………………%
Объем раствора катализатора……………………………..мл
Объем кислорода по окончанию реакции V¥………….…мл
Выделение кислорода во времени и определение
константы скорости разложения пероксида водорода
| № | t, мин | Vt | (V∞-Vt) | ln(V∞-Vt) | k, мин -1 |
Аналогичный опыт проделывают с твердым катализатором, в качестве которого используют 0,5 г оксида алюминия (III) или оксида марганца (IV) (по указанию преподавателя).
Источник