- Презентация к уроку по теме «Способы выражения концентрации растворов» презентация к уроку по химии (11 класс) на тему
- Скачать:
- Предварительный просмотр:
- Подписи к слайдам:
- Презентация на тему «Растворы. Концентрация растворов»
- Просмотр содержимого документа «Презентация на тему «Растворы. Концентрация растворов»»
- Презентация по химии на тему «Растворы» (11 класс)
- Дистанционное обучение как современный формат преподавания
- Современные педтехнологии в деятельности учителя
- Методическая работа в онлайн-образовании
- Оставьте свой комментарий
- Безлимитный доступ к занятиям с онлайн-репетиторами
- Подарочные сертификаты
Презентация к уроку по теме «Способы выражения концентрации растворов»
презентация к уроку по химии (11 класс) на тему
Презентация может использоваться на уроке химии в 11 классе, частично в 8 классе, при проведении элективного курса. В презентации содержится информация о следующих способах выражения концентрации растворов: массовая доля, молярность, моляльность, мольная доля, титр.
Скачать:
| Вложение | Размер |
|---|---|
| sposoby_vyrazheniya_koncentracii_rastvorov.ppt | 520 КБ |
Предварительный просмотр:
Подписи к слайдам:
Что обозначается этими величинами в химии? ω , См, X
Тема урока: «Способы выражения концентраций растворов»
Цели урока: расширить и систематизировать представления о способах выражения концентрации растворов; изучить новые способы выражения концентраций растворов; учиться применять полученные теоретические знания при решении задач; развивать интеллектуальные умения и навыки.
Концентрация — величина, характеризующая количественный состав раствора . Согласно правилам ИЮПАК , концентрацией растворённого вещества (не раствора) называют отношение количества растворённого вещества или его массы к объёму раствора (моль/л, г/л), то есть это соотношение неоднородных величин. Те величины, которые являются отношением однотипных величин (отношение массы растворённого вещества к массе раствора, отношение объёма растворённого вещества к объёму раствора) правильно называть долями. Однако на практике для обоих видов выражения состава применяют термин концентрация и говорят о концентрации растворов.
Способы выражения концентрации растворов 1 Массовая доля (весовые проценты, процентная концентрация) 2 Объёмная доля 3 Молярность (молярная концентрация) 4 Мольная доля 5 Моляльность (моляльная концентрация) 6 Титр раствора 7 Нормальность (молярная концентрация эквивалента) 8 Растворимость вещества
Процентная концентрация, массовая доля растворённого вещества Массовая доля растворённого вещества-это отношение массы растворённого вещества к массе раствора. Для расчёта процентной концентрации используется формула: Раствор состоит из растворённого вещества и растворителя. Массу раствора можно определить по формуле:
В бинарных растворах часто существует однозначная зависимость между плотностью раствора и его концентрацией (при данной температуре). Это даёт возможность определять на практике концентрации важных растворов с помощью денсиметра ( спиртометра , сахариметра , лактометра ). Некоторые ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора ( спирта , жира в молоке, сахара). Часто для выражения концентрации (например, серной кислоты в аккумуляторах) пользуются просто их плотностью. Распространены ареометры предназначенные для определения концентрации растворов веществ.
Зависимость плотности растворов H 2 SO 4 от её массовой доли в водном растворе при 20°C ω, % 10 30 50 70 80 90 ρ H 2 SO 4 , г/мл 1,066 1,219 1,395 1,611 1,727 1,814
Объёмная доля Объемная доля — отношение объёма растворённого вещества к объёму раствора. Объёмная доля измеряется в долях единицы или в процентах. где: V (в-ва) — объём растворённого вещества, л; V(р-ра) — общий объём раствора, л. Как было указано выше, существуют ареометры, предназначенные для определения концентрации растворов определённых веществ. Такие ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора. φ = V(в-ва) V(р-ра)
Молярность (молярная концентрация) Молярность — число молей растворённого вещества в единице объёма раствора. где ν — количество растворённого вещества, моль; V — объём раствора, л Молярность чаще выражают в моль/л или ммоль/л. Возможны следующие обозначения молярной концентрации — С, См, М. Так, раствор с концентрацией 0,5 моль/л называют 0,5-молярным (0,5М).
Мольная доля Мольная доля ( X ) — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы. X = ν (в-ва) \ ∑ ν (в-в) ν — количество компонента, моль; ∑ ν — сумма количеств всех компонентов, моль.
Моляльность (моляльная концентрация) Моляльность — число молей растворённого вещества в 1кг растворителя. Измеряется в моль/кг, Так, раствор с концентрацией 0,5 моль/кг называют 0,5-моляльным. Св = ν / m( р-ля), где: ν — количество растворённого вещества, моль; m (р-ля) — масса растворителя, кг. Следует обратить особое внимание, что несмотря на сходство названий, молярность и моляльность величины различные. Прежде всего, при выражении концентрации в моляльности, в отличие от молярности, расчёт ведут на массу растворителя , а не на объём раствора. Моляльность, в отличие от молярности, не зависит от температуры.
Титр раствора Титр раствора — масса растворённого вещества в 1 мл раствора. Т= m (в-ва)/ V (р-ра), где: m (в-ва) — масса растворённого вещества, г; V(р-ра) — общий объём раствора, мл; В аналитической химии обычно концентрацию титранта пересчитывают применительно к конкретной реакции титрования таким образом, чтобы объём использованного титранта непосредственного показывал массу определяемого вещества; то есть титр раствора показывает, какой массе определяемого вещества (в граммах) соответствует 1 мл титрованного раствора.
Нормальность (молярная концентрация эквивалента) Нормальность (Сн) — число эквивалентов данного вещества в одном литре раствора. Нормальность выражают в моль-экв/л. Часто концентрацию таких растворов выражают как «н». Например, раствор содержащий 0,1 моль-экв/л называют децинормальным и записывают как 0,1н. Сн =Э/ V (р-ра), где: Э — эквивалент, моль-экв; V — общий объём раствора, л; Сн(щёлочи) ∙V(щёлочи)= Сн(кислоты)∙ V(кислоты)
Коэффициент растворимости Очень часто концентрацию насыщенного раствора, наряду с вышеперечисленными характеристиками, выражают через так называемый коэффициент растворимости или просто растворимость вещества. Отношение массы вещества, образующего насыщенный раствор при данной температуре, к массе растворителя называют коэффициентом растворимости : Кр = m (в-ва) / m (р-ля) Растворимость вещества показывает максимальную массу вещества, которая может раствориться в 100 г растворителя: р = (m в-ва / m р-ля ) ∙ 100%
Задачи 1.Определите молярную концентрацию хлорида натрия в 24%-ном растворе его плотностью 1,18 г/мл. (Ответ — 4,84 М ) 2. Определите молярную концентрацию соляной кислоты в 20%-ном растворе плотностью 1,098. (Ответ — 6М) 3. Определите молярную концентрацию азотной кислоты в 30%-ном растворе ее плотностью 1,18 г/мл. (Ответ — 5,62 М ) 4. Вычислите массовую долю гидроксида калия в водном растворе с концентрацией 3М и плотностью 1,138 г/мл. (Ответ — 15 %) 5. Сколько мл 56 %-ного раствора серной кислоты ( плотность-1,46г/мл) нужно для приготовления 3 л 1М раствора? (Ответ — 360 мл)
6. К воде массой 200 г прилили 2М раствор хлорида калия объемом 40 мл и плотностью 1,09 г/мл. Определите молярную концентрацию и массовую долю соли в полученном растворе, если его плотность оказалась равна 1,015 г/мл. (Ответ — 0,33М, 2,45%) 7. Сколько г гидроксида калия нужно для нейтрализации 300 мл 0,5 М раствора серной кислоты? ( Ответ — 16,8 г ) 8. Какой объем 2 М раствора гидроксида калия вступит в реакцию: а) с 49 г серной кислоты б) с 200 г 24,5%-ного раствора серной кислоты? В) с 50 г 6,3%-ного раствора азотной кислоты? 9. Какой объем 3М раствора хлорида натрия плотностью 1,12 г/мл надо прилить к воде массой 200 г , чтобы получить раствор с массовой долей соли 10%? (Ответ — 315 мл) 10. Какой объем 3М раствора хлорида калия потребуется для приготовления 200 мл 8%-ного раствора соли с плотностью 1,05 г/мл? (Ответ — 75,2 мл) 11. 2,8 л аммиака растворили в воде, объем раствора довели до 500 мл. Какое количество вещества аммиака содержится в 1 л такого раствора? (Ответ — 0,25 моль)
Источник
Презентация на тему «Растворы. Концентрация растворов»

Основные понятия: Раствор, растворимое вещество, растворитель, растворение, растворимость, концентрация раствора (формулы)
Просмотр содержимого документа
«Презентация на тему «Растворы. Концентрация растворов»»
Растворы. Концентрация растворов
Что же тогда такое раствор?
Раствор (истинный раствор) – гомогенная система, в которой размер частиц вещества меньше 1нм, между частицами и средой нет поверхности раздела.
Любой раствор состоит из:
Из двух или нескольких компонентов раствора растворителем является тот, который взят в большем количестве и имеет то же агрегатное состояние, что и раствор в целом.
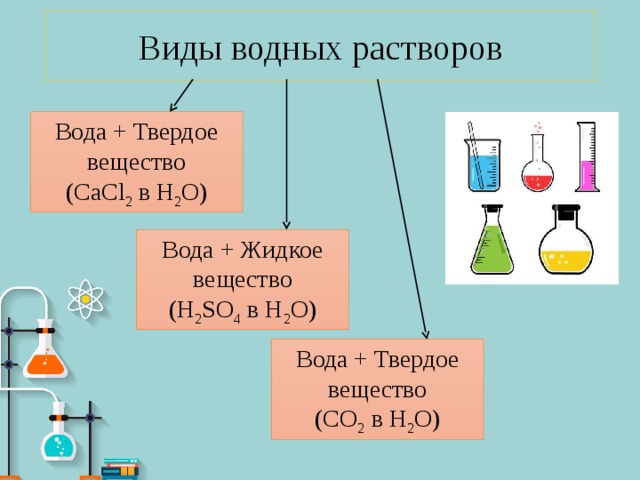
Виды водных растворов
Вода + Твердое вещество
Вода + Жидкое вещество
(H 2 SO 4 в H 2 O)
Вода + Твердое вещество
Как происходит растворение?
— процесс проникновения одних молекул вещества, сквозь другие.
молекулы сахара (белые кружочки)
молекулами воды (темные кружочки)
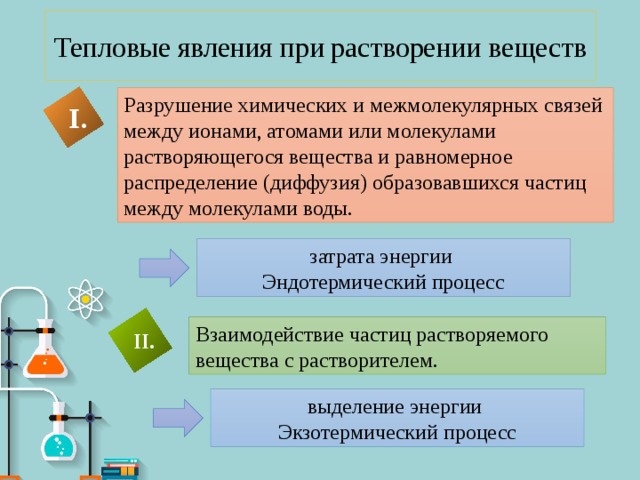
Тепловые явления при растворении веществ
Разрушение химических и межмолекулярных связей между ионами, атомами или молекулами растворяющегося вещества и равномерное распределение (диффузия) образовавшихся частиц между молекулами воды.
Взаимодействие частиц растворяемого вещества с растворителем.
Растворение – это физико-химический процесс, в котором наряду с образованием обычной механической смеси веществ идет процесс взаимодействия частиц растворенного вещества с растворителем.
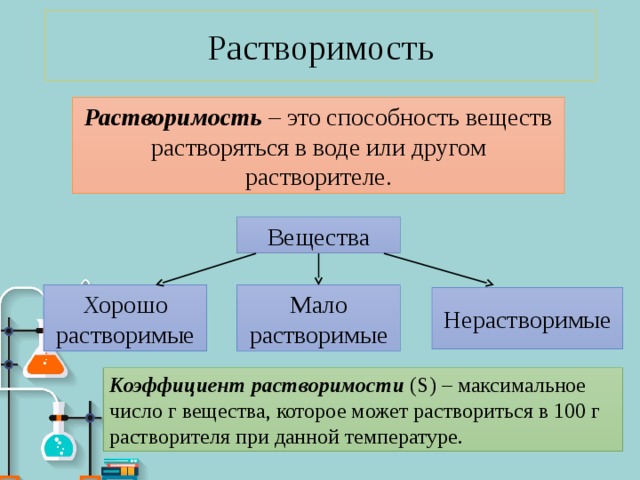
Растворимость – это способность веществ растворяться в воде или другом растворителе.
Коэффициент растворимости (S) – максимальное число г вещества, которое может раствориться в 100 г растворителя при данной температуре.
Насыщенный раствор – это раствор, который находиться в динамическом равновесии с растворяющимся веществом.
— раствор, в котором данное вещество при данной температуре уже больше не растворяется
Факторы влияющие на растворимость
- Природа растворителя
- Природа растворяемого вещества
- Давление
- Температура
Концентрация раствора – это содержание вещества в определенной массе или объеме раствора.
Выражение концентрации раствора
Массовая доля растворенного вещества в растворе – это отношение массы растворенного вещества к массе раствора.
Выражение концентрации раствора
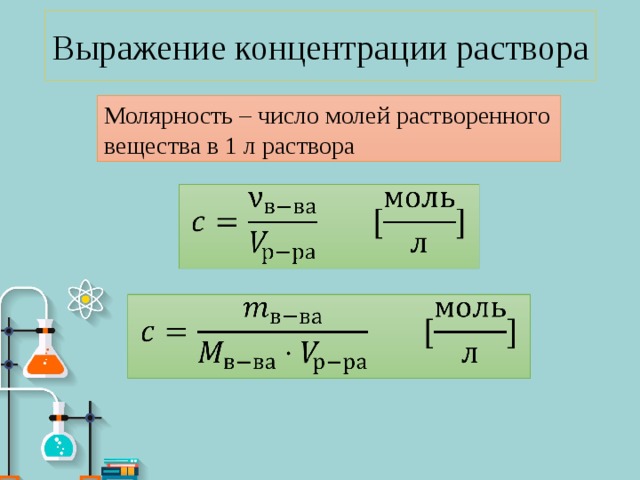
Молярность – число молей растворенного вещества в 1 л раствора
Источник
Презентация по химии на тему «Растворы» (11 класс)
Описание презентации по отдельным слайдам:
Растворы – это гомогенные (однородные) системы, состоящие из двух и более компонентов и продуктов их взаимодействия. Точное определение раствора ( 1887 год Д.И.Менделеев): Раствор – гомогенная (однородная) система, состоящая из частиц растворенного вещества, растворителя и продуктов их взаимодействия. Справочник. Справочник.
Растворы подразделяются: Молекулярные – водные растворы неэлектролитов ( спиртовой раствор иода, раствор глюкозы). Молекулярно-ионные – растворы слабых электролитов ( азотистая и угольная кислоты, аммиачная вода). Ионные растворы – растворы электролитов. Справочник.
Растворение – физико – химический процесс, в котором наряду с образованием обычной механической смеси веществ идет процесс взаимодействия частиц растворенного вещества с растворителем. Справочник.
Растворимость – свойство вещества растворяться в воде или другом растворе. Коэффициент растворимости (S) – максимальное число г вещества , которое может раствориться в 100г растворителя при данной температуре. Хорошо растворимые S > 1г Мало растворимые S =0,01 – 1 г Вещества. Нерастворимые S 6 слайд 
Влияние различных факторов на растворимость. Растворимость Температура Давление Природа растворенных веществ Природа растворителя
Концентрация раствора – это содержание вещества в определенной массе или объеме раствора.
Выражение концентраций растворов. Массовая доля растворенного вещества в растворе – отношение массы растворенного вещества к массе раствора. ( доли единицы/ проценты)
Выражение концентраций растворов. Молярность — число молей растворенного вещества в 1 л раствора. ʋ — количество вещества (моль); V – объем раствора (л);
Выражение концентраций растворов. Эквивалентная концентрация (нормальность) – число эквивалентов растворенного вещества в 1л раствора. ʋ экв. — количество эквивалентов; V – объём раствора, л.
Выражение концентраций растворов. Моляльная концентрация (моляльность) – число молей растворенного вещества на 1000 г растворителя.
Природные растворы. Минеральная вода. Кровь животных. Морская вода.
Практическое применение растворов. Продукты питания. Лекарственные препараты. Минеральные столовые воды. Сырье промышленности. Биологическое значение растворов.
http://tdtka.ru/wpcontent/uploads/2012/10/aneclab_banky.jpg http://www.chemicalnew.com/images/main.jpg https://encryptedtbn3.gstatic.com/images?q=tbn:ANd9GcTgTDZ65NpmSQPa3OSKckFCyY9nXOZDwdz6cToSB0BYlKEeridtgw http://polnota.3dn.ru/Kartinki2/ximia.jpg http://images.ua.prom.st/23326677_w200_h200_chemistry17070901.jpg http://associationplus.kz/ru/wpcontent/themes/association/images/pic1.jpg http://images.myshared.ru/408824/slide_2.jpg http://www.provisor.com.ua/archive/2008/N02/img/vitro_208r2.jpg http://3.bp.blogspot.com/-lZSv3fbm0Y8/Tws3W8giKBI/AAAAAAAAABM/u2J7b3Ywkag/s758/a3584d36.jpg http://vsuet.ru/school-y-chemist/dictionary/8.jpg http://www.syl.ru/misc/i/ai/179232/706080.jpg http://www.syl.ru/misc/i/ai/66594/62790.jpg Материалы, используемые для оформления
Информация для педагога. Ресурс предназначен для учащихся 11 класса. Является иллюстрацией при освоении темы «Растворы. Количественные характеристики растворов». В презентации рассматриваются основные понятия темы, формулы количественных выражений концентраций растворов. Материал может быть фрагментарно использован на уроках химии в 8 – 9 классах. Ресурс рассчитан на использование УМК О.С.Габриеляна.
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 813 человек из 76 регионов
Курс повышения квалификации
Современные педтехнологии в деятельности учителя
- Курс добавлен 23.09.2021
- Сейчас обучается 48 человек из 23 регионов
Курс профессиональной переподготовки
Методическая работа в онлайн-образовании
- Сейчас обучается 23 человека из 12 регионов
Ищем педагогов в команду «Инфоурок»
Номер материала: ДБ-834239
Международная дистанционная олимпиада Осень 2021
Не нашли то что искали?
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Безлимитный доступ к занятиям с онлайн-репетиторами
Выгоднее, чем оплачивать каждое занятие отдельно
Рособрнадзор откажется от ОС Windows при проведении ЕГЭ до конца 2024 года
Время чтения: 1 минута
Минпросвещения разрабатывает образовательный минимум для подготовки педагогов
Время чтения: 2 минуты
В Пензенской области запустят проект по снижению административной нагрузки на учителей
Время чтения: 1 минута
Минпросвещения будет стремиться к унификации школьных учебников в России
Время чтения: 1 минута
В проекте КоАП отказались от штрафов для школ
Время чтения: 2 минуты
В Осетии студенты проведут уроки вместо учителей старше 60 лет
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Источник