- Что такое иммунология?
- Существуют следующие отрасли клинической иммунологии:
- Какие заболевания характерны для иммунологии?
- Симптомы, с которыми следует обратиться к врачу
- Что такое иммунология?
- Существуют следующие отрасли клинической иммунологии:
- Какие заболевания характерны для иммунологии?
- Симптомы, с которыми следует обратиться к врачу
- Иммунология
- Диагностические исследования в иммунологии
- Системная иммунология: секреты Т-клеточного репертуара
- Пятерка по системной биологии
- Т-клеточный рецептор (TCR) — ключевая молекула адаптивного иммунного ответа
- Системная иммунология в контексте курения
- Вакцина из табака
- «Близнецовый метод» в системной иммунологии
- Михаил Погорелый о стипендии ФМИ на базе Сколтеха:
- Эти многоликие Т-лимфоциты
- Софья Касацкая о стипендии:
- Широкие горизонты системной иммунологии
- Заключение
Что такое иммунология?
Иммунитет считается особым механизмом, благодаря которому мы надежно защищены от патогенных микроорганизмов, но бывают ситуации, когда в нем происходят те или иные сбои, вызванные патологического процессом.
Лечение, диагностику и профилактику осуществляет врач-иммунолог, который проводит лабораторные и клинические анализы, назначая компетентное лечение.
Существуют следующие отрасли клинической иммунологии:
Общая иммунология, которая занимается изучением защитных процессов в организме на клеточном и молекулярном уровне;
Инфекционная иммунопатология, ориентирующаяся на болезни, вызванные инфекциями;
Иммунология неинфекционная и аллергологическая.
При этом лечение, выбираемое врачом, носит комплексный характер. Оно основывается на использовании современных терапевтических методов, физиотерапии, ЛФК.
Какие заболевания характерны для иммунологии?
В первую очередь это патологии аллергенной природы, такие как сезонные и круглогодичные риниты и конъюнктивиты, крапивница, аллергический дерматит, астма бронхиальная, пищевые, контактные и неконтактные аллергии.
Консультация иммунолога требуется и при возникновении вирусных и бактериальных инфекций неясной этиологии, при герпетической инфекции, рецидивирующим фурункулезе, лимфаденитах, синдроме хронической усталости, папилломатозе, лихорадках, кожных высыпаниях.
В отдельную категорию внесен вирус иммунодефицита человека, или ВИЧ-инфекция, которая характеризуется хроническим стойким снижением иммунитета из-за репликации вируса. К лечению этой патологии иммунологи применяют специальный подход, назначая анализы на вирусную нагрузку и пожизненную ВААРТ терапию.
Симптомы, с которыми следует обратиться к врачу
Частые простуды и ОРЗ, которые тяжело подаются медикаментозному лечению, причем при использовании антибиотиков последнего поколения;
Появление на коже сыпи, гнойников, фурункулов, частые герпетивные высыпания;
Повышение субферильной температуры, которая держится более недели;
Повышенная утомляемость, хроническое ощущение усталости, бессонница;
Боли в мышцах, ломота, частые судороги;
Наличие часто рецидивирующих гнойных и воспалительных инфекций в полости носоглотки и рта;
Сбои в работе желудочно-кишечного тракта;
Часто повторяющиеся рецидивы хронических заболеваний;
Обострение патологий репродуктивной системы, хронические циститы и уретриты.
При этом обратить внимание на свое здоровье надо после исследования общего анализа крови, который может показать наличие воспалительных процессов в организме. Если в анамнезе имеется повышенный уровень СОЭ или лейкоцитов, то тогда иммунолог может назначить дополнительное обследование.
Какие методы клинической диагностики применяются иммунологами?
В первую очередь врач расспрашивает пациента о его клинических жалобах. Затем проводится визуальный осмотр тела и полости рта, прощупывают локальные и периферические лимфатические узлы.
На следующем этапе диагностики проводится анализ интерферонового и иммунного статуса. Делаются соскобы с кожи. Это принг-тесты и скарификационный тест. Соскоб дополнительно осуществляется с миндалин и корня языка для того, чтобы выявить тип патологических организмов, присутствующих на слизистой полости рта.
При крапивнице или контактном дерматите делаются аллергические тесты, которые помогают выявить аллерген, вызвавший иммунную реакцию со стороны организма. Дополнительно проводится бактериологический посев крови и ПЦР-диагностика вместе со стандартными серологическими исследованиями.
При наличии в анамнезе вируса иммунодефицита проводится ПЦР-тест и анализ на вирусную нагрузку в организме. При подозрении на инфекции верхних осуществляется компьютерная спирометрия. Дополнительно может назначаться ультразвуковое обследование внутренних органов, МРТ, КТ диагностика, ФГС. В целом, обследование носит комплексный и всесторонний характер. После сбора анамнеза иммунолог назначает соответствующее терапевтическое лечение и следит за динамикой заболевания. Обращаться к иммунологу надо и для профилактических осмотров, особенно детям, пожилым людям, беременным женщинам и лицам с хроническими заболеваниями.
Источник
Что такое иммунология?

Иммунитет считается особым механизмом, благодаря которому мы надежно защищены от патогенных микроорганизмов, но бывают ситуации, когда в нем происходят те или иные сбои, вызванные патологического процессом.
Лечение, диагностику и профилактику осуществляет врач-иммунолог, который проводит лабораторные и клинические анализы, назначая компетентное лечение.
Существуют следующие отрасли клинической иммунологии:
Общая иммунология, которая занимается изучением защитных процессов в организме на клеточном и молекулярном уровне;
Инфекционная иммунопатология, ориентирующаяся на болезни, вызванные инфекциями;
Иммунология неинфекционная и аллергологическая.
При этом лечение, выбираемое врачом, носит комплексный характер. Оно основывается на использовании современных терапевтических методов, физиотерапии, ЛФК.
Какие заболевания характерны для иммунологии?
В первую очередь это патологии аллергенной природы, такие как сезонные и круглогодичные риниты и конъюнктивиты, крапивница, аллергический дерматит, астма бронхиальная, пищевые, контактные и неконтактные аллергии.
Консультация иммунолога требуется и при возникновении вирусных и бактериальных инфекций неясной этиологии, при герпетической инфекции, рецидивирующим фурункулезе, лимфаденитах, синдроме хронической усталости, папилломатозе, лихорадках, кожных высыпаниях.
В отдельную категорию внесен вирус иммунодефицита человека, или ВИЧ-инфекция, которая характеризуется хроническим стойким снижением иммунитета из-за репликации вируса. К лечению этой патологии иммунологи применяют специальный подход, назначая анализы на вирусную нагрузку и пожизненную ВААРТ терапию.
Симптомы, с которыми следует обратиться к врачу

Частые простуды и ОРЗ, которые тяжело подаются медикаментозному лечению, причем при использовании антибиотиков последнего поколения;
Появление на коже сыпи, гнойников, фурункулов, частые герпетивные высыпания;
Повышение субферильной температуры, которая держится более недели;
Повышенная утомляемость, хроническое ощущение усталости, бессонница;
Боли в мышцах, ломота, частые судороги;
Наличие часто рецидивирующих гнойных и воспалительных инфекций в полости носоглотки и рта;
Сбои в работе желудочно-кишечного тракта;
Часто повторяющиеся рецидивы хронических заболеваний;
Обострение патологий репродуктивной системы, хронические циститы и уретриты.
При этом обратить внимание на свое здоровье надо после исследования общего анализа крови, который может показать наличие воспалительных процессов в организме. Если в анамнезе имеется повышенный уровень СОЭ или лейкоцитов, то тогда иммунолог может назначить дополнительное обследование.
Какие методы клинической диагностики применяются иммунологами?
В первую очередь врач расспрашивает пациента о его клинических жалобах. Затем проводится визуальный осмотр тела и полости рта, прощупывают локальные и периферические лимфатические узлы.
На следующем этапе диагностики проводится анализ интерферонового и иммунного статуса. Делаются соскобы с кожи. Это принг-тесты и скарификационный тест. Соскоб дополнительно осуществляется с миндалин и корня языка для того, чтобы выявить тип патологических организмов, присутствующих на слизистой полости рта.
При крапивнице или контактном дерматите делаются аллергические тесты, которые помогают выявить аллерген, вызвавший иммунную реакцию со стороны организма. Дополнительно проводится бактериологический посев крови и ПЦР-диагностика вместе со стандартными серологическими исследованиями.
При наличии в анамнезе вируса иммунодефицита проводится ПЦР-тест и анализ на вирусную нагрузку в организме. При подозрении на инфекции верхних осуществляется компьютерная спирометрия. Дополнительно может назначаться ультразвуковое обследование внутренних органов, МРТ, КТ диагностика, ФГС. В целом, обследование носит комплексный и всесторонний характер. После сбора анамнеза иммунолог назначает соответствующее терапевтическое лечение и следит за динамикой заболевания. Обращаться к иммунологу надо и для профилактических осмотров, особенно детям, пожилым людям, беременным женщинам и лицам с хроническими заболеваниями.
Источник
Иммунология
Иммунология — область медицинской микробиологии, она развивается достаточно быстро и взаимодействует с такими науками, как химия, биология, генетика, физиология. Иммунологические реакции используются клинической иммунологией для диагностики, лечения, а также профилактики многих заболеваний.
Данные Всемирной Организации Здравоохранения гласят о том, что на сегодняшний день большая часть заболеваний связана с нарушениями иммунной системы. Повышенная иммунная реакция приводит к аллергии, а, напротив, пониженная, к иммунодефицитным состояниям, которые могут быть врожденными (встречаются редко).
В случае серьезного снижения защитных сил организма человека, возникают хронические воспалительные процессы, которые обуславливаются бактериальной и вирусной активностью. Сюда относят такие заболевания, как вирусные гепатиты, герпес, папилломатоз. Если такие заболевания носят вялотекущий характер, в связи с чем возрастает риск онкологии. Приобретенные нарушения иммунитета гораздо чаще встречаются в более зрелом возрасте. СПИД является примером приобретенного иммунодефицита.
К причинам, вызывающим нарушение защитных свойств организма, относятся: травмы, влияние кортикостероидов, облучение рентгеном, заболевания почек и печени, диабет, злокачественные опухоли. При правильном лечении за счет мощной компенсаторной функции иммунной системы происходит восстановление ее функций.
Диагностические исследования в иммунологии
Диагностика в иммунологии предполагает идентификацию биологических веществ, которые регулируют защиту организма (к ним относят цитокины, интерфероны), определение общего иммуноглобулина (A, E, G, M), уровень активности лимфоцитов, фагоцитов.
Точными и эффективными на сегодняшний день являются разного рода аппаратные и лабораторные анализы отдельных органов человека. Такие диагностические исследования нужны для того, чтобы иметь представление о состоянии организма в целом, а также для эффективного лечения его нарушений. В рамках такой терапии широко применяют иммуномодуляторы (препараты для восстановления естественных реакций защитных механизмов).
Источник
Системная иммунология: секреты Т-клеточного репертуара
Репертуар Т-клеточных рецепторов (TCR) определяет эффективность адаптивного иммунного ответа. Рисунок в оригинальном разрешении.
Автор
Редакторы
Иммунология — одна из самых «прикладных» и «практичных» биологических дисциплин, и эпидемия COVID-19 позволила лишний раз в этом убедиться. Одновременно это, пожалуй, один из самых сложных разделов науки о живом. В реализации иммунного ответа задействованы десятки разных типов клеток; сотни белков-лигандов: цитокинов, хемокинов; тысячи генов. Приложение методов системной биологии к решению иммунологических задач породило самостоятельную дисциплину — системную иммунологию. В третьей статье цикла «Пятерка по системной биологии» мы увидим, как методы системной биологии помогают разобраться в фундаментальных и прикладных аспектах Т-клеточного ответа.
Пятерка по системной биологии
Победителями Стипендиальной программы по системной, клеточной и молекулярной биологии, организованной российскими аффилированными лицами компании «Филип Моррис Интернэшнл» (ФМИ) на базе Центра наук о жизни Сколковского института науки и технологий, ежегодно становятся пять молодых ученых до 35 лет. Знания по своим темам у стипендиатов, без сомнения, также заслуживают «пятерки» — поэтому спецпроект и получил такое название.
В статьях цикла наши авторы пообщаются со стипендиатами разных лет, профессорами и преподавателями Сколтеха, а также с представителями ФМИ.
Партнер спецпроекта — российские аффилированные лица компании «Филип Моррис Интернэшнл» (ФМИ), которая активно ведет исследования в области биомедицины, системной биологии и биотехнологий.
Т-клеточный рецептор (TCR) — ключевая молекула адаптивного иммунного ответа
Иммунная система нашего организма состоит из двух «подсистем»: врожденного и приобретенного (адаптивного) иммунитетов. В основе этого деления лежит фундаментальное различие в молекулярных механизмах распознавания чужеродных молекул — антигенов — в этих двух подсистемах. Значимость изучения иммунной системы сложно переоценить: в 2011 году за это присудили Нобелевскую премию [1–3].
Клетки врожденного иммунитета (наиболее изученные из них — макрофаги) синтезируют множество различных рецепторов, распознающих «типичные» сигналы опасности — например, молекулу липополисахарида (LPS): важный компонент клеточной стенки бактерий. Счет таких рецепторов идет на десятки. Самая известная и хорошо изученная группа — это Toll-подобные рецепторы, но есть и другие. Число антигенов, которые могут распознать рецепторы врожденного иммунитета, может показаться небольшим, но все они проверены миллионами лет естественного отбора, так что в конечном счете врожденный иммунитет, несмотря на свою кажущуюся простоту, — весьма надежная защита. Во всяком случае, беспозвоночные животные, среди которых встречаются и крупные, и достаточно долгоживущие организмы, им обходятся.
Приобретенный (адаптивный) иммунитет устроен совсем иначе. Т-лимфоциты синтезируют лишь один тип рецепторов — Т-клеточные рецепторы (TCR). Однако если взять тысячу макрофагов, синтезирующих рецептор TLR4, то все эти рецепторы будут распознавать одну и ту же молекулу LPS. А если случайным образом выделить из пробы крови тысячу Т-клеток, то они будут распознавать тысячу разных антигенов. Подобное разнообразие достигается благодаря уникальным молекулярным механизмам, задействованным в созревании лимфоцитов: Т- и В-клеток. Подробнее обо всех этих хитросплетениях можно прочесть в статье «Иммунитет: борьба с чужими и. своими» [4].
Ген Т-клеточного рецептора на ранних стадиях созревания Т-лимфоцитов подвергается множеству перестроек и многократно мутирует в той области, которая кодирует часть рецептора, отвечающую за распознавание антигена. В разных клетках-предшественниках этот процесс идет независимо. Так что в результате зрелые Т-лимфоциты несут миллионы вариантов TCR. При этом каждая клетка синтезирует только один определенный вариант рецептора. Миллионы TCR способны распознавать миллионы антигенов — эта способность делает адаптивный иммунный ответ столь точным или, как предпочитают говорить ученые, «специфичным». Разнообразие Т-клеточных рецепторов в организме или в определенной популяции Т-лимфоцитов называется репертуаром TCR («Биомолекула» уже писала об этом [5]).
Чем богаче этот репертуар, тем больше чужеродных молекул способна распознать и обезвредить иммунная система данного человека. Изучение разнообразия Т-клеток и их рецепторов — одно из важнейших направлений современной иммунологии и интереснейшая задача с точки зрения системно-биологических подходов. Вот поэтому стипендия, которую аффилированные лица компании «Филип Моррис Интернэшнл» (ФМИ) в России вручают на базе Сколковского института науки и технологий, поддержала уже три проекта в этой области. Ну а нам особенно приятно отметить, что оба стипендиата, о которых будет рассказано далее, — не только замечательные молодые ученые, но и давние авторы и друзья «Биомолекулы».
Если у вас возник вопрос, что же такое «системная биология» и «системная иммунология», то почитайте нашу предыдущую статью из этого спецпроекта [6].
«Довольно сложно, на мой взгляд, выделить системную иммунологию во что-то отдельное от “просто иммунологии”, — говорит Иван Звягин, с.н.с. отдела геномики адаптивного иммунитета ИБХ РАН. — Методы in silico в настоящее время используются при решении практически любой задачи в иммунологии, да и в других биологических науках. Но для их разработки и совершенствования требуются “мокрые” эксперименты, в результате которых, собственно, и появляются те данные, которые системные биологи позже используют для проверки качества предсказаний. Сложно выделить “вычислительные” методы в самостоятельную науку, на мой взгляд».
Однако термин «системная иммунология» прижился, и ученые, которые заняты преимущественно теоретическими и вычислительными изысканиями в этой области, предпочитают использовать его, чтобы отличать себя от иммунологов-врачей и иммунологов-экспериментаторов.
Системная иммунология в контексте курения
«Биомолекула» спросила у Джулии Хёнг (Julia Hoeng), директора по системной токсикологии «Филип Моррис Интернэшнл», — почему же ФМИ интересно изучать иммунную систему в контексте курения?
Чтобы оценить преимущества, связанные с переходом на альтернативные продукты с пониженным риском, важно полностью понимать последствия курения для здоровья. Курение сигарет, выделяющих множество токсикантов, оказывает пагубное воздействие на иммунную систему, и этот эффект лежит в основе развития многих, если не всех, связанных с курением заболеваний. Иммунная система страдает даже у на первый взгляд здоровых курильщиков. Компоненты табачного дыма затрагивают множество клеточных популяций, участвующих в иммунном ответе, включая эндотелиальные и эпителиальные клетки, лимфоциты, макрофаги, нейтрофилы и дендритные клетки [7].
Воспалительная реакция, управляемая иммунной системой, участвует в развитии сердечно-сосудистых заболеваний (ССЗ), хронической обструктивной болезни легких (ХОБЛ) и астмы. Хроническое воздействие сигаретного дыма приводит к развитию симптомов ХОБЛ у части курильщиков: прогрессирующей потери функции легких, разрушению дыхательных путей и альвеол [8]. Иммунные клетки и их лиганды участвуют в воспалительной реакции при ХОБЛ. Нейтрофилы и макрофаги секретируют сериновые протеазы, включая нейтрофильную эластазу, катепсин G и протеиназу-3, а также матриксные металлопротеиназы ММП-8 и ММП-9, которые могут способствовать разрушению альвеол. Дополнительно было показано влияние цитотоксических CD8+ Т-лимфоцитов, Тh1 и Th17 CD4+ клеток, а также В-клеток на продукцию антител при ХОБЛ. Количество CD8+ Т-лимфоцитов в легких существенно возрастает по мере развития болезни. Эти данные говорят о влиянии иммунного ответа на прогрессирование ХОБЛ [9].
Мы надеемся, что понимание влияния сигаретного дыма на кардиореспираторные заболевания позволит оценить потенциал продуктов с пониженным риском для уменьшения побочных эффектов от курения.
Вакцина из табака
Кстати, говоря о проектах ФМИ в области иммунологии, нельзя не упомянуть и то, что компания «Медикаго», чьим акционером является одна из дочерних компаний ФМИ, достигла соглашения с правительством Канады о сотрудничестве в рамках ускоренной работы над своей кандидатной вакциной от COVID-19. «Медикаго» уже объявила о поставке 76 миллионов доз вакцины в случае ее одобрения Министерством здравоохранения Канады. Для производства вакцины применяют растительные биотехнологии с использованием растений табака (Nicotiana benthamiana).
«Близнецовый метод» в системной иммунологии
Стипендиат 2016 года: Михаил Погорелый, научный сотрудник Института биоорганической химии РАН (отдел геномики адаптивного иммунитета). Автор статьи «Мир до и после изобретения вакцин» [10] в рамках спецпроекта по вакцинации на «Биомолекуле».
Название проекта: «Секвенирование репертуара Т-клеточных рецепторов (TCR) у однояйцевых близнецов после вакцинации против желтой лихорадки».
В формировании иммунитета, как и в любом сложном биологическом процессе, участвуют по меньшей меры две силы: наследственность человека, запечатленная в его генах, и факторы внешней среды, определяющие особенности индивидуального развития. Чтобы сравнить их относительный вклад, в биологии издавна используется близнецовый метод.
Однако репертуар Т-клеточных рецепторов на первый взгляд не кажется особенно подходящим объектом для изучения таким способом. Перестройка гена ТCR [11] происходит случайно не только в каждом организме, но в каждой отдельной клетке-предшественнице (рис. 1), так что, казалось бы, у близнецов не больше шансов иметь клетки с одинаковыми Т-клеточными рецепторами, чем у любых случайно взятых людей. Однако Михаил Погорелый, стипендиат 2016 года, решил проверить, а так ли это на самом деле?
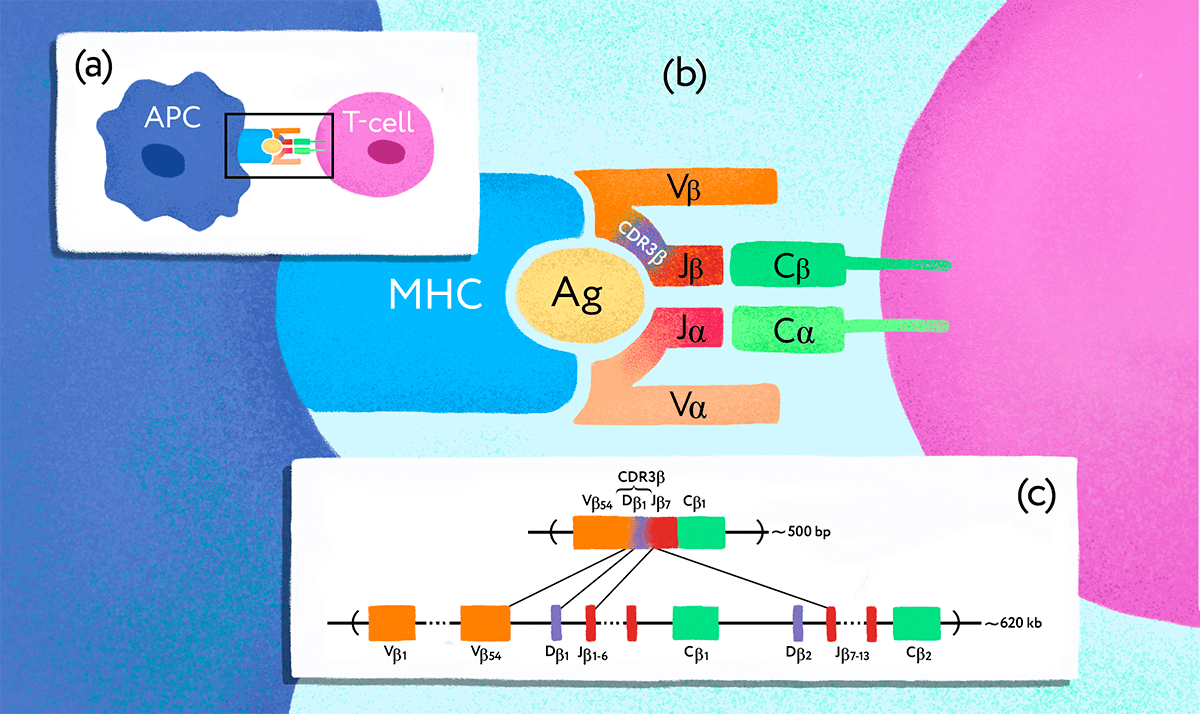
Рисунок 1. Ген Т-клеточного рецептора подвергается перестройке в клетках-предшественниках Т-лимфоцитов. (a) — Взаимодействие антигенпрезентирующей клетки (APC) и Т-лимфоцита (T-cell). (b) — TCR, состоящий из субъединиц ɑ и β, распознает чужеродный антиген (Ag), связанный с MHC. Разнообразие Т-клеточных рецепторов обеспечивается специальными молекулярными механизмами. (c) — В результате процесса, получившего название «VDJ-рекомбинация», в каждой Т-клетке оказывается свой уникальный вариант рабочего гена — так на генетическом уровне формируется репертуар разнообразных TCR.
Первая неожиданность: оказалось, что у близнецов больше клонов Т-лимфоцитов с одинаковым Т-клеточным рецептором! Как такое возможно в свете всего выше изложенного? Дело в том, что иммунная система начинает формироваться еще до рождения человека, хотя полностью «созревает» лишь через несколько лет после рождения. Однояйцевые близнецы делят одну плаценту на двоих, и похоже, что через нее они могут обмениваться иммунными клетками [12].
Дальше исследователи решили проверить, как организмы уже взрослых близнецов реагируют на введение чужеродного антигена.
«Мы использовали вакцину от желтой лихорадки как модель острой вирусной инфекции, — рассказывает Михаил Погорелый “Биомолекуле”. — Отсеквенировали репертуар TCR близнецов в нескольких временных точках, чтобы найти клоны Т-лимфоцитов, которые значимо возросли после вакцинации. Это сработало: нашли, что в каждом человеке около 1000 последовательностей β-цепи TCR проходят клональную экспансию, поскольку специфичны к эпитопам вируса желтой лихорадки».
Рецептор TCR представляет собой гетеродимерный белок, состоящий из двух субъединиц — α и β либо γ и δ, представленных на поверхности клетки (рис. 1). Субъединицы закреплены в мембране и связаны друг с другом дисульфидной связью, α/β вариант рецептора присутствует на подавляющем большинстве Т-лимфоцитов и лучше всего изучен. — Прим. автора статьи.
Михаил продолжает: «Дальше посмотрели на сами эти последовательности. Выяснилось, что:
- совпадений аминокислотной последовательностей между людьми не очень много (из тысячи последовательностей, специфичных к желтой лихорадке, около 20 совпадает с близнецом и всего 1–3 с неродственным донором), то есть набор отвечающих клонов в каждом человеке почти уникальный. Но даже эти несколько совпадений — гораздо больше, чем можно ожидать, если бы клоны выбирались из каждого репертуара случайно. Это значит, что в разных людях для ответа на вакцину отбираются одинаковые последовательности TCR (и еще чаще в близнецах — скорее всего из-за того, что у них совпадают аллели MHC — их антигенпрезентирующие клетки показывают одни и те же антигены);
- внутри набора отвечающих TCR каждого донора много TCR-β-цепей со схожими последовательностями (1–2 а.к. замены). Это объясняется тем, что на один эпитоп одновременно отвечают сразу несколько TCR со схожими последовательностями [13]».
Из результатов этой работы родилась следующая идея. Поскольку в активном иммунном ответе принимает участие много схожих TCR одновременно, то можно создать алгоритм, который будет по единственному образцу репертуара находить TCR, вовлеченные в текущий иммунный ответ (они часто собраны в кластеры схожих последовательностей). Такой алгоритм был разработан и протестирован в лаборатории. И действительно, оказалось, что он позволяет выявлять клоны, отвечающие на вакцинацию, по единственному анализу репертуара (скажем, через три недели после вакцинации). Это, разумеется, куда дешевле и проще, чем делать множество измерений в разных временных точках с той же целью [14].
Проект Михаила — наглядный пример того, как в рамках одного исследования «классическая иммунология», то есть секвенирование рецепторов близнецов, эволюционирует в «системную иммунологию» — разработку алгоритма для поиска кластеров Т-клеток, вовлеченных в текущий иммунный ответ. Именно такой логике следует общее развитие системной иммунологии в наши дни.
Михаил Погорелый о стипендии ФМИ на базе Сколтеха:
Как вы узнали о программе? Какие впечатления от участия в ней?
О программе узнал от коллег. Подготовка документов была достаточно простой, минимум формальностей: всё можно было сделать самостоятельно (без ученых советов/справок/протоколов и пр.), быстро (около одного рабочего дня) и отправить в электронном виде — выгодное отличие от большинства других стипендий. Потом оказалось, что это стиль программы в целом: минимум формальностей и бюрократии, но каждые полгода-год отчеты о ходе твоей работы в форме конференции. При этом на самих конференциях есть реальная обратная связь со стороны экспертов: вопросы, критика и т.д. На последнем году программы нам организовали поездку в Швейцарию, в исследовательский центр ФМИ в Невшателе (рис. 2). Было очень интересно посмотреть, как системная биология применяется большими корпорациями. Сложно придумать, что можно было бы улучшить в программе. Конечно, я бы советовал всем молодым ученым участвовать в ней.
Рисунок 2. Михаил Погорелый с проектом High throughput sequencing of identical twins TCR repertoires after yellow fever vaccination на отчетном семинаре в научно-исследовательском центре ФМИ в швейцарском городе Невшатель
Чем занимаетесь сейчас, через четыре года после получения стипендии?
Мы продолжаем заниматься мониторингом иммунного ответа на инфекции/вакцинацию с помощью секвенирования репертуаров, но под другими углами: на примере других вирусов (лихорадка Денге, новая коронавирусная инфекция [15]) и с большим числом пациентов.
Эти многоликие Т-лимфоциты
Стипендиат 2019 года: Софья Касацкая, аспирант Сколтеха и научный сотрудник Института биоорганической химии РАН (отдела геномики адаптивного иммунитета). Победитель конкурса «Био/Мол/Текст»-2015 «Биомолекулы» со статьей «Т-лимфоциты: путешественники и домоседы» [16] в номинации «Лучшая статья по иммунологии» и участница проекта «Наука на завтрак».
Название проекта: «Исследование формирования функциональных субпопуляций Т-лимфоцитов человека через анализ репертуаров Т-клеточных рецепторов».
Человеку, знакомому с разнообразием клеток врожденного иммунитета (макрофаги, дендритные клетки, нейтрофилы, эозинофилы и так далее), система приобретенного иммунитета может показаться даже примитивной, ведь в ней, казалось бы, всего два типа клеток: Т-лимфоциты и В-лимфоциты. Однако это впечатление ошибочно. Во-первых, Т-клетки делятся на две большие группы: «киллеры» (CD8+) и «хелперы» (CD4+). А во-вторых, даже внутри этих групп, особенно среди Т-хелперов, также наблюдается большое разнообразие. Разные группы Т-хелперов — Th1, Th2, Treg, Th9, Th22 — синтезируют различные типы цитокинов и тем самым обеспечивают разнообразие и гибкость иммунного ответа. Все эти Т-лимфоциты экспрессируют на своей поверхности TCR. Естественным образом возникает вопрос: а насколько одинаковы или, напротив, различны репертуары Т-клеточных рецепторов в разных Т-клеточных популяциях? Поискам ответа на него посвящен проект Софьи Касацкой, стипендиата 2019 года.
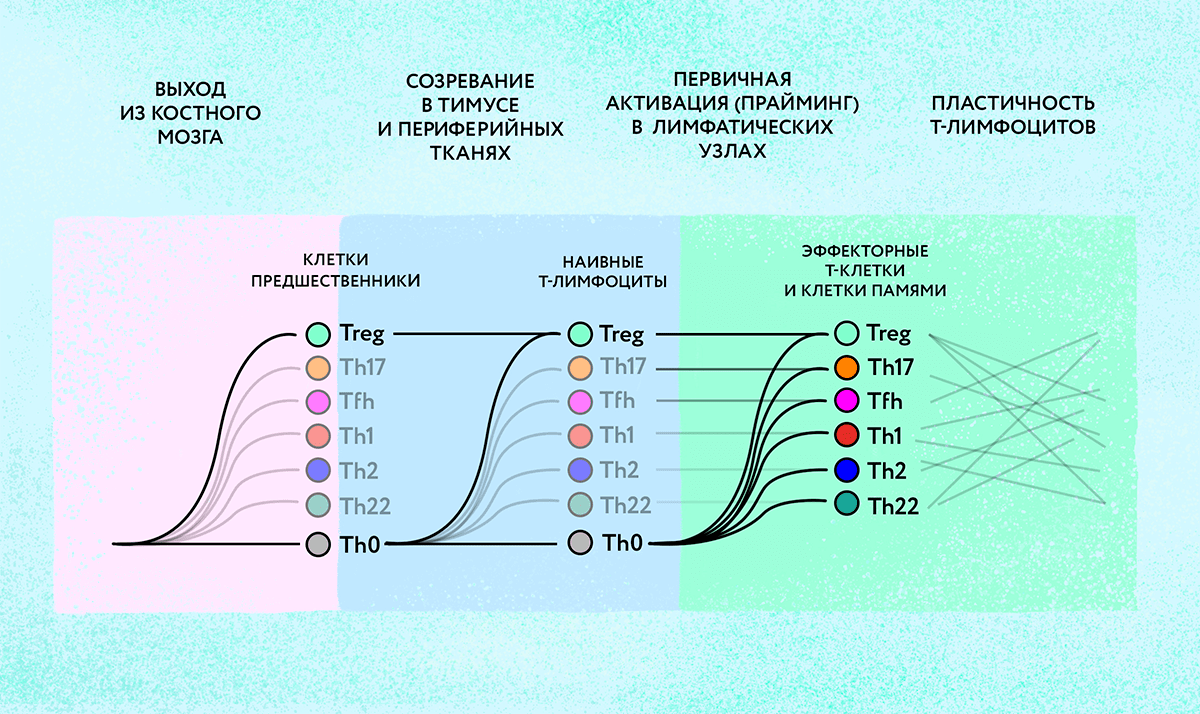
При этом нужно учесть, что различные типы Т-хелперов при определенных условиях способны превращаться («перепрограммироваться») друг в друга (рис. 3). Механизмы и пути таких перевоплощений изучены пока недостаточно. Но анализ репертуаров ТСR может пролить свет на запутанные отношения между различными популяциями Т-лимфоцитов. Совпадение репертуаров рецепторов в двух разных популяциях клеток-хелперов дает основания полагать, что эти группы клеток имеют общее происхождение и, вероятно, способны превращаться друг в друга. И, напротив, различия в репертуарах ТСR будет знаком того, что данные популяции лимфоцитов формируются независимо.
Рисунок 3. Дифференциация Т-лимфоцитов в различные субпопуляции — длительный и сложный процесс, молекулярные механизмы которого изучают иммунологи. Потенциальная способность зрелых Т-лимфоцитов менять свою специализацию (пластичность) является перспективной целью для иммунотерапии различных заболеваний.
иллюстрация Любови Колосовской по данным Софьи Касацкой
Софье удалось показать, что репертуары TCR в популяциях Th17- и Th22-лимфоцитов, играющих важную роль в регуляции аутоиммунных реакций, частично совпадают с репертуаром Th2-клеток, что указывает на тесную связь между этими тремя популяциями. При этом клетки типа Th1-17, обладающие, как это следует из названия, свойствами как Th1, так и Th17-лимфоцитов, имеют общие TCR только с Th1-клетками, но не с Th17. Это позволяет с уверенностью говорить об их происхождении от Th1-лимфоцитов [17]. Так, изучение разнообразия Т-клеточных рецепторов позволяет пролить свет на механизмы пластичности Т-лимфоцитов, понимание которых очень важно, например, при разработке новых видов иммунотерапии.
Особое внимание в проекте уделяется регуляторным Т-клеткам (Treg). Эта популяция Т-лимфоцитов имеет особый путь развития. Их задача в организме — удерживать иммунный ответ в безопасных для организма рамках. Нарушение в активности этих клеток может привести к развитию аутоиммунных заболеваний. Чтобы изучить процесс формирования этой стороны иммунитета, исследователи планируют сравнить TCR-репертуар регуляторных клеток у новорожденных с незрелой иммунной системой, контактировавшей лишь с небольшим числом чужеродных агентов, и у взрослых людей.
Первая статья с результатами по этому проекту уже отправлена в журнал, так что пожелаем Софье скорой и успешной публикации.
Софья Касацкая о стипендии:
Как вы узнали о программе? Какие впечатления от участия в ней?
Я предложила свой проект на конкурс на второй год обучения в аспирантуре: у меня уже были наработки и хорошее понимание проекта, и я знала, что есть такой конкурс, который вместе проводят Philip Morris International и Сколтех. На тот момент мой коллега и соавтор Женя уже получил стипендию на год раньше, с другим проектом.
Евгений Егоров получил стипендию ФМИ в 2017 году, для исследований по теме «Влияние возраста на репертуар Т-клеточных рецепторов наивных Т-лимфоцитов». Результаты этой научной работы опубликованы в статье The Changing Landscape of Naive T Cell Receptor Repertoire With Human Aging [18]. — Прим. автора статьи.
Стипендия, как и другие гранты, на которые я подавала заявки или которые я выигрывала, устроена довольно безлично: я не получала никакой обратной связи по своему проекту ни по начальной заявке, ни по отчету первого года . Это молчаливый процесс: меня просто уведомляют, что мою стипендию одобрили/продлили, ура. Хотелось бы, конечно, получить обратную связь от экспертов, рекомендации, как улучшить проект. Я была бы рада более плотной работе со стипендиатами, будь то научные семинары, менторские программы, возможность поучаствовать в других научных, лидерских или образовательных инициативах для стипендиатов и бывших стипендиатов.
В этом месте менеджер индустриальных проектов Сколтеха Вера Рыбко отмечает, что обычно обратная связь дается на отчетном семинаре, который не проводился только в 2020 году из-за эпидемиологической обстановки. Этот семинар обязательно возобновится в будущем. — Прим. автора статьи.
Тем, кто планирует участвовать в конкурсе, советую побольше обсуждать план проекта для стипендии перед тем, как подавать заявку. Советы старших коллег и кого-то, кого вы хотели бы видеть своим ментором, могут помочь доработать заявку, сделать ее более реалистичной и хорошо спланировать части исследования по годам выполнения проекта. Может быть, советы даст человек, который не так хорошо знает вашу область науки, как вы, но обладает бóльшим опытом организации, администрирования таких проектов. Лучше пройти несколько итераций такой обратной связи, чем подавать сыроватую заявку, когда вы в себе не уверены.
Что вам дало получение стипендии, что изменило в вашей жизни? Что вы планируете делать после ее завершения?
Мое рабочее время делится между несколькими проектами, к которым добавляется участие в проектах моих коллег и коллабораторов. Только часть этой деятельности связана со стипендией и кандидатской диссертацией. Не могу сказать, что стипендия сильно меняет фокус или режим работы или жизни. Но исследования, использующие высокопроизводительное секвенирование, всегда дорогостоящие, и тут поддержка моих экспериментов Сколтехом и стипендией ФМИ очень ценна: получается покрыть стоимость реагентов на 1–2 запуска прибора в год.
Широкие горизонты системной иммунологии
Так получилось, что оба упомянутых в статье стипендиата работают над задачами, связанными с репертуаром Т-клеточных рецепторов. Но это далеко не единственная область иммунологии, где применяются методы системной биологии. Одни ученые собирают и упорядочивают информацию о сигнальных путях иммунных клеток — чтобы использовать ее при анализе разнообразных омиксных данных. Другие строят математические модели, описывающие поведение лимфоцитов. Третьи используют технологии «распознавания образов» (image recognition) для того, чтобы углубить наше знание о взаимодействии иммунных клеток. И это далеко не полный перечень тем и подходов, которые используют иммунологи сегодня. Своими соображениями о будущем системной иммунологии и самых интересных задачах, стоящих перед этой наукой, с нами поделился старший научный сотрудник ИБХ РАН Иван Звягин (рис. 4):
Рисунок 4. Иван Звягин, с.н.с. отдела геномики адаптивного иммунитета ИБХ РАН и зав. лабораторией механизмов иммунотолерантности НИИ трансляционной медицины РНИМУ им. Н.И. Пирогова
«В современной иммунологии есть интереснейшие направления, где алгоритмы анализа больших “иммунологических” и вообще “биологических” данных играют главенствующую роль, так как на их основе можно создавать инструменты, предсказывающие те или иные иммунологические явления и позволяющие манипулировать иммунным ответом в нужном направлении.
В частности, на данный момент мы плохо понимаем, каким образом в каждом конкретном случае происходит связывание Т-клеточного рецептора с комплексом пептид—МНС (pMHC, peptide-loaded major histocompatibility complex), которое приводит к активации Т-лимфоцитов.
Если мы научимся предсказывать силу связывания TCR с тем или иным pMHC на основе их аминокислотных последовательностей, это позволит понять, чем определяется иммуногенность того или иного антигена. В сочетании со знаниями о закономерностях формирования репертуара распознающих рецепторов, это даст возможность разработать алгоритмы для предсказания оптимальных эпитопов для выработки нужного иммунного ответа против новых инфекций или терапии опухолей, оценки риска распознавания “своего” и рационального дизайна узнающей части рецепторов при совершенствовании способов клеточной терапии (например CAR-T-терапия [19]).
С другой стороны, те же алгоритмы будут задействованы и в направлении создания неиммуногенных вариантов белковых последовательностей, когда это важно — например при генотерапии.
Ответы на все эти вопросы — дело ближайшего будущего. Полученные данные и созданные алгоритмы в дальнейшем позволят разрабатывать способы рационального дизайна иммунной системы, исходя из особенностей конкретного человека, с целью снижения риска развития заболеваний и увеличения продолжительности активной жизни».
Свое видение будущего системной иммунологии есть и у Джулии Хёнг из ФМИ:
Ключевая задача биологии и иммунологии XXI века состоит в том, чтобы определить, на какие факторы мы должны воздействовать, чтобы перепрограммировать иммунную систему в нужном нам направлении и улучшить здоровье человека при различных воспалительных заболеваниях. Чтобы добиться этой цели, мы должны понимать сложные молекулярные взаимодействия, которые управляют развитием болезни. Системная иммунология позволяет измерять, как различные компоненты иммунной системы изменяются и взаимодействуют во времени и пространстве в ответ на изменение факторов внешней среды или генетические вариации, с целью точного определения ключевых компонентов (молекул, клеток, тканей) и взаимодействий, которые управляют иммунными реакциями. Вычислительный анализ тысяч молекулярных изменений одновременно должен обеспечить понимание иммунных изменений в пораженной ткани [20], [21].
Кроме того, современные проблемы диагностики и лечения заболеваний заключаются в отсутствии биомаркеров, которые можно было бы обнаружить в образцах, взятых неинвазивным путем (кровь, моча и т.д). Воспаленная ткань посылает сигналы в систему кровообращения, когда ситуация обостряется. Однако если бы болезнь можно было обнаружить на ранних стадиях, у нас было бы больше возможностей для вмешательства. В настоящее время неинвазивные (например, из крови, а не из биоптата тканей) биомаркеры, как правило, основаны на отдельных молекулах и плохо работают в ранней диагностике. Но можно надеяться, что вычислительные методы системной иммунологии, позволяющие анализировать тысячи молекул и их взаимодействий одновременно, позволят найти более эффективные решения для ранней диагностики многих заболеваний [22], [23].
В частности, наша группа продемонстрировала потенциал подобного подхода на примере образцов крови курильщиков [24] и при переходе на продукты с пониженным риском [25].
Заключение
Иммунные клетки, как было рассказано выше, проходят сложные пути дифференциации и развития, которые мы пока понимаем лишь отчасти. Чтобы разобраться в фундаментальных механизмах, определяющих разнообразие клеточных популяций в человеческом теле (около 200 типов!), мы должны опуститься еще глубже — с клеточного на молекулярный уровень — и попытаться понять, каким образом организация хроматина в ядрах клеток определяет их способность участвовать в тех или иных сигнальных путях. Этой интереснейшей теме будет посвящена следующая статья нашего цикла.
Источник