Иммуноферментный анализ (ИФА) в диагностике ВИЧ-инфекции
Самым распространенным методом диагностики ВИЧ-инфекции является иммуноферментный анализ (ИФА) , с помощью которого в сыворотке крови больного выявляются антитела к ВИЧ.
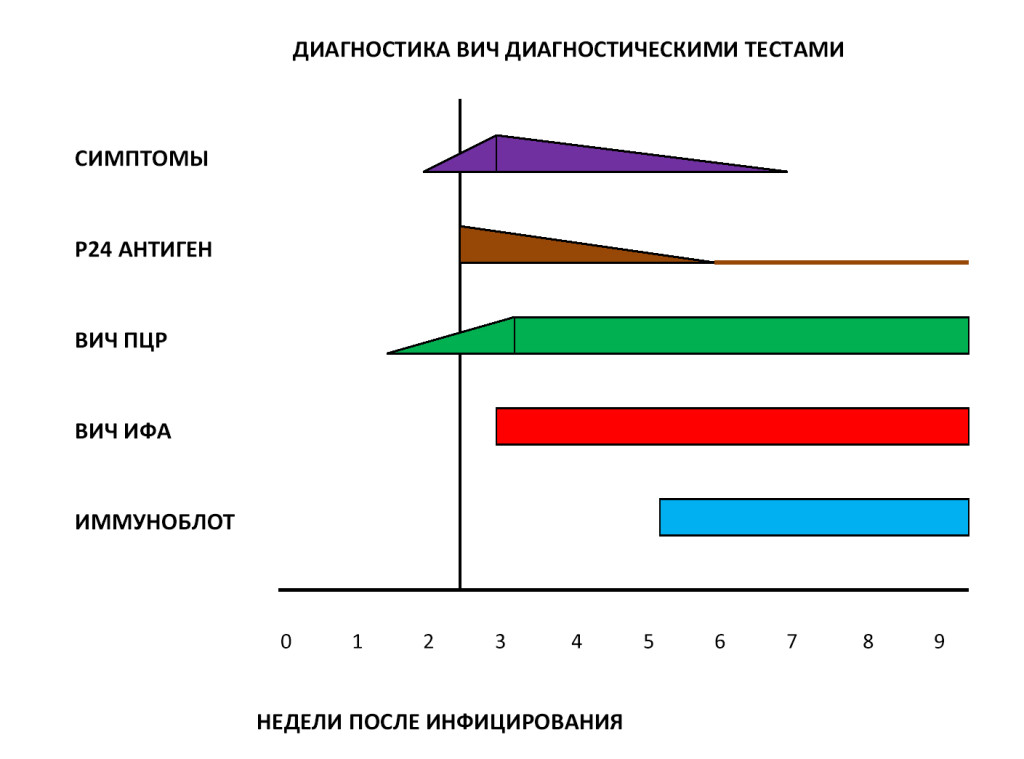
Антитела к вирусу появляются у 90-95 % инфицированных лиц через 4-6 недель от момента заражения, у 5-10% через 3-6 месяцев и у 0,5-1% в более поздние сроки. В связи с этим, период от момента заражения до появления в крови определяемых с помощью общепринятых методов лабораторной диагностики количеств антител к ВИЧ называется «серонегативным окном». В течение этого времени диагноз поставить невозможно, но такой человек может быть источником инфекции и заражать других людей.
Иммуноферментный анализ (ИФА) позволяет выявлять в крови суммарный спектр антител к структурным белкам ВИЧ. В том случае если исследуемая сыворотка или плазма дала дважды положительный результат в ИФА, она тестируется в подтверждающем тесте иммуноблота (II этап). В отличие от ИФА иммуноблот позволяет обнаруживать антитела к индивидуальным белкам вируса. На основании результатов иммуноблота ставится окончательный диагноз ВИЧ-инфекции.
В этом анализе используется два типа реакций: иммунологическая и ферментативная.
Все вариации ИФА основаны на способности антител специфически взаимодействовать только с «собственными» антигенами, т.е. на иммунологической реакции «антиген-антитело».
Наибольшее распространение получил гетерогенный вариант иммуноферментного анализа, при котором антиген (определяемое соединение) или антитела фиксируется на твердой основе, в качестве которой могут выступать полистироловый планшет, полистироловые бусины, пористая подложка или магнитный носитель. Анализ проводят в 3 стадии. В лунку планшета, содержащую на своих стенках тот или иной антиген (т.е. один из белков вируса), добавляют исследуемый биологический материал — сыворотку крови больного. При наличии в организме инфекционного агента, в сыворотке появляются антитела к нему. Они прочно связываются с антигеном и не удаляются при последующей промывке чашки.
На следующем этапе необходимо определить, образовался или нет в лунке иммунный комплекс, то есть произошло ли соединение антигена с антителом. Простым глазом или под микроскопом это нельзя увидеть, поэтому требуются следующие две стадии, которые можно назвать проявляющими.
На второй стадии анализа в лунку вносят специальные (реагирующие с разными антителами) антитела с заранее прикрепленным к ним ферментом (поэтому метод называется ферментным). Слитый в единый комплекс «антитело-фермент» (конъюгат) способен связаться с антителами, уже зацепившимися за антиген, который закреплен на твердой подложке. В результате возникает «молекулярная цепочка», на одном конце которой вирусный белок, а на другом — фермент. После отмывки весь этот многослойный «пирог» остается в лунке планшета. Теперь нужно обнаружить активность фермента, чтобы сделать вывод о наличие антитела. Для этого на третьей стадии в ту же лунку вносят раствор субстрата и специального бесцветного вещества — хромогена, который способен окрашиваться в результате серии биохимических реакций, осуществляемых присутствующим в лунке ферментом. Если в лунке появляется окраска, это означает, что все элементы цепочки присутствуют. Из этого следует вывод: в крови пациента имеются антитела к антигенам ВИЧ и, следовательно, сам пациент инфицирован этим вирусом.
Существуют и другие варианты метода ИФА. Например, можно детектировать не антитела, а сам антиген. Процедура в целом будет похожей, хотя немного более сложной.
Результаты анализа могут быть положительными, отрицательными или сомнительными.
При отрицательном результате и отсутствии подозрения на недавнее (в течение последних 6 месяцев) заражение, можно считать диагноз ВИЧ неподтвержденным. Если есть подозрение на недавнее заражение, проводят повторное исследование.
ИФА может дать как ложноотрицательный, так и ложноположительный результат.
Ложноотрицательный результат ИФА возможен при свежем инфицировании, пока антитела к ВИЧ еще не выработались организмом больного.
Ложноположительные результаты могут быть получены при обследовании больных хроническими заболеваниями и в некоторых других случаях:
Поэтому при получении положительного результата ИФА его обязательно перепроверяют более чувствительными методами.
Источник
Диагностика ВИЧ: методы и исследования
Ранняя диагностика заболеваний – залог успешного лечения. Ставшее крылатым выражение, особенно актуально для ВИЧ-инфекции. Ведь заболевание неизлечимо полностью, и только своевременная диагностика позволяет взять течение болезни под контроль и выбрать тактику лечения, чтобы жить полноценной жизнью.

Важность клинической диагностики ВИЧ
В понимании многих людей ВИЧ-инфицированный человек выглядит болезненно, изнеможенно. Он кашляет, чихает, чешется, стонет, у него все болит… На самом деле это не так! Проблема в том, что после инфицирования ВИЧ и в последующий инкубационный период симптомы полностью отсутствуют. Затем наступает острая фаза, на протяжении которой присутствуют симптомы, напоминающие ОРВИ или грипп. Но и они вскоре проходят, и наступает, так называемый, латентный период – продолжительный промежуток времени, когда ВИЧ-инфекция себя ничем не выдает. С момента инфицирования и до стадии пред-СПИДа может пройти порядка 10 лет, в течение которых, ни сам пациент, ни его окружение, даже и не подозревают о болезни. А когда она уже на полную мощность заявляет о себе, контролировать ее очень трудно. Сложно противостоять осложнениям ВИЧ, поддерживать практически разрушенную иммунную систему человека.
Очень важно понимать, что, хотя и есть группы риска – гомосексуалисты, наркозависимые и девушки легкого поведения – в основной массе, пациенты с ВИЧ-инфекцией – это обычные люди. Они учатся, ходят на работу, посещают общественные места, знакомятся в интернете – в общем, живут как все. К сожалению, но от ВИЧ никто не застрахован. Незащищенный половой контакт в порыве страсти, заветное тату без соблюдения стерильности, маникюр за полцены у начинающего мастера, уличная драка – все эти и множество других житейских ситуаций могут обернуться инфицированием ВИЧ.
Не ошибается лишь тот, кто не живет! Мы не можем знать все наперед, не можем исправить уже совершенных ошибок, но мы можем предпринять простые шаги для исправления их последствий – обратиться в ближайший кожно-венерологический диспансер, в местную клинику или специализированный СПИД-центр для сдачи анализов и ранней диагностики ВИЧ.
Благоприятные сроки для диагностики ВИЧ
Факт возможного инфицирования и плохое самочувствие без видимых причин – два веских основания для обращения к специалистам. Но отрицательный результат тестирования на антитела не всегда означает, что человек не инфицирован, так как существует период “серонегативного окна” (время между заражением и появлением антител), который составляет около трех месяцев. Поэтому лучше повторить их спустя 3 месяца с момента возможного инфицирования. Если же ответ опять будет отрицательным, но ваша тревога не проходит, и вы уверены в заражении ВИЧ, тогда лабораторную диагностику необходимо повторить спустя 6 месяцев после факта заражения.
Что касается плохого самочувствия, то поводом провериться на ВИЧ может быть сочетание следующих симптомов:
- увеличение лимфатических узлов на шее, в паху, в области подмышек;
- лихорадка;
- мышечные или головные боли;
- молочница и грибковые поражения, в том числе кандидоз полости рта;
- воспаление слизистой носа, рта или глотки;
- ночная потливость;
- ломота в суставах;
- длительная диарея;
- тошнота, рвота;
- резкое снижение массы тела;
- высыпания на коже.
Важно понимать, что с момента, когда проявляются первые признаки ВИЧ-инфекции и до момента, когда заболевание переходит в латентную стадию, проходит очень мало времени – около 3-6 недель с факта инфицирования. Нельзя упускать из вида этот промежуток времени! Поскольку последующие 8-10 лет вы будет жить, нормально себя чувствовать и даже не подозревать о том, что больны ВИЧ-инфекцией. Драгоценное время будет упущено.
Современные методы диагностики ВИЧ
В настоящее время в диагностике ВИЧ используется двухуровневый подход – косвенные и прямые тесты. Косвенные тесты позволяют обнаружить в крови пациента специфические антитела к ВИЧ, а прямые тесты помогают выявить собственно сам ВИЧ и определить степень вирусной нагрузки на организм. В России стандартная диагностика ВИЧ включает следующие методы лабораторных исследований:
- ИФА (иммуноферментный анализ).
- Иммуноблот (иммунный блоттинг).
Также могут быть применены следующие методики:
- Экспресс-тест ИХА (иммунохроматография).
- ПЦР (полимеразная цепная реакция).
Диагностические принципы лабораторных исследований и степень их достоверности приведены в нижеследующей таблице.
Источник
Научная электронная библиотека
Морозова В. С., Габрильянц О. А., Мягкова М. А.,
3.2.3. Иммуноферментный метод (ИФА)
Иммуноферментный анализ (сокращённо ИФА, англ. enzyme-linked immunosorbent assay, ELISA) – лабораторный иммунологический метод качественного или количественного определения различных соединений, макромолекул, вирусов и пр., в основе которого лежит специфическая реакция антиген-антитело. Выявление образовавшегося комплекса проводят с использованием фермента в качестве метки для регистрации сигнала.
Твердофазный ИФА был предложен в 1971 году. Основные принципы твердофазного ИФА, независимо от модификации, заключаются в следующем:
1. На 1 этапе реакции адсорбируют антигены или антитела на твердой фазе. При этом не связавшиеся с твердой фазой реагенты легко удаляются отмыванием.
2. В сенсибилизированных лунках инкубируют исследуемый образец. В лунках с положительным контролем – стандартные реагенты. При этом на поверхности твердой фазы формируются иммунные комплексы. Несвязавшиеся компоненты удаляют отмыванием.
3. При добавлении конъюгата антитело-фермент или антиген-фермент и связывании его с иммобилизованным иммунным комплексом активный центр фермента остается доступным для последующего взаимодействия с субстратом. Инкубация субстрата в лунках с иммобилизованным конъюгатом приводит к развитию цветной реакции. Эту реакцию можно остановить на нужной стадии, выраженность окрашивания можно оценить визуально или по оптической плотности.
Из-за разнообразия объектов исследования – от низкомолекулярных соединений до вирусов и бактерий, и многообразия условий проведения ИФА существует большое количество вариантов этого метода.
Одним из принципов классификации методов ИФА является их разделение по типу проводимых на каждой из иммунохимических стадий реакций. В соответствии с эти все методы можно разделить на две группы –
гомогенные и гетерогенные. Если в ходе выполнения анализа все реакции, включая ферментативную стадию, протекают в растворе, то метод является гомогенным. Гетерогенный ИФА объединяет методы, в которых анализ проводится в двухфазной системе, при этом разделение на фазы может происходить на любой стадии определения [16].
В настоящее время EMIT (гомогенный ИФА) широко распространен во всем мире наряду с твердофазным ИФА (тИФА). EMIT по сравнению с тИФА является более экспрессным (до 2-х минут) и менее трудоемким, хотя менее чувствительный, и поэтому используется только в качественном анализе.
Возможна также классификация по типу иммунохимического взаимодействия на первой стадии анализа (в которой происходит связывание определяемого вещества). Если в системе присутствуют только анализируемое соединение и соответствующие ему центры связывания (антиген и специфические антитела), то метод является неконкурентным. Если же на первой стадии в системе одновременно присутствует анализируемое соединение и его аналог (меченное ферментом анализируемое соединение или анализируемое соединение, иммобилизованное на твердой фазе), конкурирующие за ограниченное количество центров специфического связывания, то метод является конкурентным.
Рис. 10. Конкурентный (а) и неконкурентный (б) ИФА
Примером неконкурентного формата ИФА является «сэндвич»-метод. К носителю с иммобилизованными антителами добавляют раствор, содержащий анализируемый антиген. В процессе инкубации на первой стадии на твердой фазе образуется комплекс антиген-антитело. Затем носитель отмывают от несвязавшихся компонентов и добавляют меченные ферментом специфические антитела. После вторичной инкубации и удаления избытка конъюгата антител с ферментом определяют ферментативную активность носителя, которая пропорциональна начальной концентрации исследуемого антигена. На стадии выявления специфического иммунокомплекса антиген оказывается как бы зажатым между молекулами иммобилизованных и меченных антител, что послужило поводом для широкого распространения названия «сэндвич»-метод.
Ферментативная реакция (цветная реакция) проходит в присутствии перекиси водорода и субстрата, представленного неокрашенным соединением, которое в процессе пероксидазной реакции окисляется до окрашенного продукта реакции на заключительном этапе проведения исследования. Интенсивность окрашивания зависит от количества выявленных специфических антител. Результат оценивается спектрофотометрически или визуально.
«Сэндвич»-метод может быть использован для анализа только тех антигенов, на поверхности которых существуют, по крайней мере, две антигенные детерминанты. На этом формате основано большое количество тест-систем для иммуноферментной диагностики различных инфекций: ВИЧ-инфекция, вирусные гепатиты, цитомегаловирусная, герпесная, токсоплазменная и другие инфекции.
Другим типом классификации схем ИФА является разделение по типу определения концентрации анализуемого вещества:
1) прямое определение образовавшихся иммунокомплексов (аналитический сигнал прямо пропорционален концентрации определяемого вещества) – прямой ИФА;
2) определение концентрации оставшихся свободными, т.е. не вступившими в реакцию компексообразования антител – непрямой ИФА.
Так, среди конкурентных схем твердофазного ИФА существует два основных формата:
Прямой конкурентный формат ИФА использует в качестве меченного ферментом реагента одного из участников иммунохимической реакции (рис. 3) – определяемое соединение или специфический к нему диагностический реагент (антитела). В результате схема ИФА состоит из 3-х стадий:
– сорбции (иммобилизации) специфических антител, либо конъюгата антигена,
– аналитической стадии: конкурентной реакция Аг-Ат с участием меченого ферментом реагента (антигена или антител),
– фермент-субстратной реакции, в результате которой образуется окрашенный (или люминисцентный) продукт.
Например, на полистирольный планшет иммобилизуют специфические антитела (рис. 11 в) иммобилизованые на твердой фазе специфические антитела. На второй стадии к иммобилизованным антителам добавляют раствор, содержащий определяемое вещество и фиксированную концентрацию меченого антигена, инкубируют и после отмывки носителя от несвязавшихся компонентов регистрируют ферментативную активность образовавшихся на твердой фазе специфических иммунных комплексов. В этой схеме меченый ферментом и немеченый антиген конкурируют за связывание с иммобилизованными специфическими антителами.
Рис. 11. Виды конкурентного ИФА:
а – непрямой конкурентный ИФА с иммобилизацией конъюгата антигена с высокомолекулярным веществом и использованием меченых антивидовых антител; б – непрямой конкурентный ИФА с иммобилизацией конъюгата антигена с высокомолекулярным веществом и использованием меченых специфических антител; в – прямой конкурентный ИФА с иммобилизацией специфических антител и использованием меченого антигена (аналита)
Преимуществом прямой схемы является небольшое число стадий, что позволяет легко автоматизировать анализ. К недостаткам схемы относятся сложность методов синтеза ферментных конъюгатов, а также возможное влияние компонентов образца на активность фермента.
В непрямом конкурентном формате ИФА используются меченные ферментом антитела (специфические или вторичные) и иммобилизованный на твердой фазе конъюгат антиген-белок-носитель
(рис. 11 а, б). Непрямая схема с использованием меченых антивидовых антител является одной из наиболее распространенных схем ИФА (рис. 11 а). На поверхности носителя иммобилизуют конъюгат антиген-белок, к которому добавляют раствор, содержащий определяемый антиген и фиксированную концентрацию немеченых специфических антител, инкубируют и после удаления несвязавшихся компонентов добавляют фиксированную концентрацию меченых антивидовых антител. После инкубации и отмывки носителя детектируют ферментативную активность образовавшихся на твердой фазе специфических иммунных комплексов. Величина аналитического сигнала в этом случае находится в обратно-пропорциональной зависимости от концентрации определяемого антигена.
Применение универсального реагента – меченых антивидовых антител – даёт возможность выявлять антитела к разным антигенам. Кроме того, анализируемый образец и меченый реагент вводятся в систему на разных стадиях, что устраняет влияние различных эффекторов, содержащихся в образце, на каталитические свойства ферментной метки. Однако такая схема анализа усложняет его проведение из-за введения дополнительных стадий.
ИФА наркотических веществ и их метаболитов в биологических жидкостях и тканях широко используется в ХТЛ, бюро судмедэкспертизы, клинико-диагностических лабораториях, медицинских центрах. Чаще всего применяется полуколичественный вариант методики, т.к. в большинстве случаев необходимо дать заключение о том, превышает ли уровень метаболитов ПАВ в образце определенную пороговую концентрацию. Однако метод ИФА может использоваться (и используется в некоторых случаях) для количественного определения метаболитов ПАВ с высокой чувствительностью – до 10–9 г/л.
Отдельно следует выделить иммунохимический метод выявления фактов употребления наркотиков в отдаленные промежутки времени (до 4 месяцев после последнего употребления ПАВ), основанный на определении антител к наркотическим веществам в крови человека [4, 5]. Данный метод использует прямую неконкурентную схему ИФА.
Компоненты, используемые в ИФА
Ферментные метки обладают чрезвычайно мощным каталитическим действием, одна молекула фермента может реагировать с большим количеством молекул субстрата. Таким образом, фермент, присутствующий в ничтожных количествах, можно выявить и количественно определить по образованию продуктов катализируемой им реакции. Другое преимущество применения ферментов в качестве меток обусловлено наличием в молекуле многочисленных функциональных групп (сульфгидрильных, карбоксильных, остатков тирозина и др.), через которые можно ковалентно присоединить молекулы лиганда.
В ИФА может использоваться не менее 15 различных ферментов. Наибольшее применение, в соответствии с вышеназванными требованиями, нашли пероксидаза хрена (ПХ), щелочная фосфотаза (ЩФ) и β-D-галактозидаза. Все три стабильны и катализируют высокочувствительные реакции. Кроме того, продукты, получаемые в результате реакций, катализируемых этими ферментами, в зависимости от используемого субстрата, могут выявляться не только колориметрическими методами, но также флуоресцентными методами. Другие ферменты используются значительно реже. Это объясняется их более низкой в сравнении с ПХ и ЩФ удельной активностью.
Выбор субстрата в первую очередь определяется используемым в качестве метки ферментом, так как реакция фермент-субстрат высоко специфична.
Чаще используют хромогенные субстраты, которые, разрушаясь, образуют окрашенное вещество. Перспективным является использование высокоэнергетических субстратов – флуоресцентных, хемилюминесцентных.
3. Антигены и антитела.
Аг и Aт, используемые в ИФА, должны быть высокоочищенными и высокоактивными. Кроме того, Аг должны обладать высокой антигенностью, оптимальной плотностью расположения и количеством антигенных детерминант и гомогенностью. Многие синтетические и рекомбинантные Аг вирусов и бактерий хорошо себя зарекомендовали при использовании в ИФА. Это существенно повысило специфичность и воспроизводимость метода за счет сведения к минимуму перекрестных реакций.
Одним из наиболее важных реагентов в ИФА являются антитела. Чувствительность ИФА зависит от концентрации, активности и специфичности используемых антител. Используемые антитела могут быть поли- или моноклинальными, различного класса (IgG или IgM) и подкласса (IgGl, IgG2), антиаллотипическими или антиидиотипическими. При низкой аффинности Ат распад комплекса Аг-Ат приводит к удалению связанного Аг из системы. Чувствительность и специфичность метода повышается при использовании моноклональных антител. В этом случае появляется возможность обнаруживать низкие концентрации Аг (Aт) в испытуемых образцах.
4. Получение конъюгата.
Конъюгат – это антиген или антитело, «сшитые» с ферментной меткой или белком-носителем. Получение коньюгата – один из важных этапов разработки ИФА.
При синтезе конъюгата с ферментом подбирают такой оптимальный метод введения ферментной метки, чтобы оба компонента конъюгата сохраняли свою биологическую активность: фермент – способность взаимодействовать с субстратом, а антиген или антитело – антигенность и антигенсвязывающую активность, соответственно. Наличие меченого, высокоочищенного антигена позволяет использовать конкурентные методы ИФА. Однако антигены разнообразны по своим физико-химическим свойствам и строению, а значит невозможно разработать универсальные методики для получения конъюгата с антигеном. В этом случае получение конъюгата антигена с ферментом представляет собой отдельную сложную задачу. Приготовление меченых антител для ИФА методически более доступно.
Конъюгирование фермента с иммунохимически активными белками производится различными методами: химическая сшивка, ковалентное связывание молекулы фермента с Аг или Aт и образование соединений через нековалентные связи, например, когда связь между ферментом и Аг или Aт осуществляется иммунологически, через взаимодействие антиген-антитело.
В качестве твердой фазы для проведения ИФА можно применять различные материалы: полистирол, поливинилхлорид, полипропилен и другие вещества. Твердой фазой могут служить стенки пробирки, 96-луночные и др. планшеты, шарики, бусины, а также нитроцеллюлозные и другие мембраны, активно сорбирующие белки.
Иммобилизация антигена или антител на твердой фазе возможна тремя путями:
– пассивная адсорбция, основанная на сильных гидрофобных взаимодействиях между белками и синтетической поверхностью;
– ковалентное прикрепление к твердой фазе;
– иммунохимическое и др. (нековалентное и неадсорбционное присоединение).
Пассивная адсорбция белков широко используется при проведении ИФА на платах для титрования, на нитроцеллюлозных мембранах. Пассивная адсорбция идет по принципу насыщения и коррелирует с молекулярной массой адсорбируемого вещества. В стандартных наборах ИФА используются 96-тилуночные прозрачные полистирольные планшеты.
Рис. 12. Набор для ИФА-определения наркотических еществ в биологических жидкостях: – планшет с нанесенным антигеном; 2 – положительный и отрицательный контрольный образец; 3 – реагент для выявления образовавшихся иммунных комплексов; 4 – растворы буфера для приготовления анализируемых образцов; 5 – раствор буфера для проведения фермент-субстратного окрашивания; – раствор для остановки реакции окрашивания субстрата; – инструкция по применению
Свободные сайты на поверхности твердой фазы, не связавшиеся с сорбируемым агентом, могут фиксировать в ходе теста другие молекулы, в том числе и конъюгаты, что приводит к повышению фонового сигнала. Для предотвращения неспецифического связывания после иммобилизации на твердую фазу основного материала проводят обработку нейтральными для теста веществами. Наиболее популярные блокирующие агенты – бычий сывороточный альбумин (БСА), казеин и др. Выбор блокирующего агента и условия проведения этого этапа зависят от типа твердой фазы, чувствительности системы.
Готовый набор для ИФА-определения наркотических веществ в биологических жидкостях выглядит следующим образом (рис. 12).
Источник