- Получение хрома
- Получение хрома на производстве
- Электроосаждение хрома из хромовой кислоты
- Оксид хрома получение
- Электроосаждение хрома хромо-аммонийных квасцов
- Похожие страницы:
- Хром. Химия хрома и его соединений
- Положение в периодической системе химических элементов
- Электронное строение атома хрома
- Физические свойства
- Нахождение в природе
- Способы получения
- Качественные реакции
- Химические свойства
- Оксид хрома (III)
- Способы получения
- Химические свойства
- Оксид хрома (II)
- Химические свойства
- Оксид хрома (VI)
- Способы получения
- Химические свойства
- Гидроксид хрома (III)
- Способы получения
- Химические свойства
- Гидроксид хрома (II)
- Способы получения
- Химические свойства
- Соли хрома
- Соли хрома (II)
- Соли хрома (III)
- Гидролиз солей хрома (III)
- Хромиты
- Соли хрома (VI)
Получение хрома
Получение хрома на производстве

В лабораторных условиях хром получают восстановление его оксидов алюминием или кремнием.
Хром широко применяется в технике для выплавки жаропрочных и нержавеющих сталей. Другими областями применения хрома являются получение антикоррозионных покрытий на поверхности металлических изделий (хромирование), производство красок, химическая промышленность.
В природе хром встречается преимущественно в виде минерала хромита FeO • Сr2O3. Содержание Сr2O3 в хромитовых рудах обычно составляет 40— 55%.
Металлический хром, применяемый для производства специальных сплавов, получался до недавнего времени исключительно путем алюмо- и силикотермического восстановления окиси хрома Сr2O3, получаемой из хромита. Такой металл содержит ряд примесей, за трудняющих его использование. Это привело к разработке способов электроэкстракции хрома из растворов, позволяющих получить электролитный металл высокой чистоты.
Для получения хрома электролизом применяются два типа электролитов: на основе хромовой кислоты и на основе хромо-аммонийных квасцов.
Электроосаждение хрома из хромовой кислоты
Электроосаждение хрома из хромовокислого раствора широко применяется для получения хромовых покрытий. Теория этого процесса подробно изложена в разделе гальванотехники.
Осаждение хрома из хромовокислого раствора в качестве металлургического процесса имеет некоторые особенности. В этом случае стремятся получить мягкие толстые осадки хрома высокой чистоты с возможно низким удельным расходом электроэнергии.
Электроэкстракция из раствора хромовой кислоты проводится в прямоугольных ваннах, футерованных рольным свинцом или фторопластом. Анодами служат свинцовые пластины, катодные основы изготовляются из нержавеющей стали или алюминия. Ввиду обильного газовыделения над ванной образуется туман электролита, чрезвычайно вредный для обслуживающего персонала. Для удаления тумана используется интенсивный бортовой отсос выделяющихся газов. В ряде случаев в ваннах организуется охлаждение раствора с помощью погруженных водоохлаждаемых теплообменников.
Используемые на практике электролиты содержат 250—350 г/л СrО3 и 2,5—5 г/л H2SO4; обычно отношение СrO3: H2SO4 в растворе равно 100:1. При получении хрома температура в ванне поддерживается 25—35° С. Плотность тока колеблется в пределах 2800—8000 а/м 2 . В этих условиях катодный выход по току (в расчете на шестивалентный хром) составляет от 20 до 35%, напряжение на ванне равно 5—8 е. Удельный расход электроэнергии при этом составляет порядка 40000—70000 квт • ч/т. Расход хромового ангидрида равен примерно 2—2,5 т на 1 т металлического хрома.
Оксид хрома получение
Хромовый ангидрид для получения хрома электролизом хромовой кислоты производят химическим путем. Ввиду высоких требований к чистоте СrО3 этот способ получения дорог, и электролитный хром имеет высокую стоимость.
В последнее время разработан процесс получения СrO3 путем анодного растворения феррохрома. Этот процесс имеет несомненные преимущества, так как в качестве исходного сырья для получения хромового ангидрида используется относительно дешевый и получаемый в больших количествах металлургической промышленностью феррохром. Электролиз проводят в концентрированных растворах серной кислоты. Аноды отливают из феррохрома, катоды изготовляют из нерастворимого в серной кислоте металла, обычно из свинца.
Главным анодным процессом получения хрома является процесс его растворения и железа. Хром в раствор может переходить в виде ионов Сr 6+ и Сr 3+ . Шестивалентный хром образует в сернокислом электролите раствор хромового ангидрида, трехвалентный — сульфат хрома Cr2(SO4)3. Железо переходит в раствор в виде Fe2 (SO4)3. На катоде наряду с основным катодным процессом выделения водорода может идти восстановление Сr 6+ до Сr 3+ .
Процесс следует вести таким образом, чтобы предотвратить возможность образования ионов Сr 3+ . Соотношение в растворе ионов Сr 6+ и Сr 3+ зависит от концентрации серной кислоты и плотности тока. С повышением содержания серной кислоты и увеличением плотности тока образование ионов Сr 3+ уменьшается, однако одновременно понижается и выход по току за счет пассивации анода. Вследствие малой растворимости СrO3 в концентрированных растворах H2SO4 большая часть хромового ангидрида выпадает в осадок вместе с Fe2(SO 4)3, что затрудняет их разделение.
Наибольшая разница в растворимости СrО3 и Fe2 (SO4)3 наблюдается в 50%-ной серной кислоте. Пассивация анода в таком растворе крайне незначительна, и возможно получение высоких выходов по току. Однако в этом относительно слабом по концентрации H2SO4 электролите при электролизе в обычной бездиафрагменной ванне идет образование почти исключительно ионов Сr 3+ , главным образом за счет восстановления ионов Сr 6+ на катоде. Чтобы предотвратить это восстановление и получить весь хром в виде хромового ангидрида, анод заключают в керамическую диафрагму, препятствующую проникновению ионов Сг 6+ в прикатодное пространство.
Плотность тока при проведении анодного растворения феррохрома на указанном режиме должна быть не менее 500—1000 а/м 2 . В противном случае, несмотря на применение диафрагмы, возможно образование в растворе ионов Сr 3+ . Кроме того, понижение плотности тока снижает выход по току. При плотности тока 500—1000 а/м 2 выход по току шестивалентного хрома составляет 65—80%.
Электроосаждение хрома хромо-аммонийных квасцов
Суммарной реакцией процесса электроэкстракции хрома из раствора хромо-аммонийных квасцов является реакция разложения сульфата трехвалентного хрома
что аналогично электроэкстракции цинка, марганца и других рассмотренных выше металлов. Электроосаждение хрома, имеющего ярко выраженный отрицательный потенциал и характеризующегося относительно небольшим перенапряжением для водорода, в условиях образования на аноде свободной кислоты возможно только при изоляции анодного пространства от катодного и строгом регулировании рН католита. Поэтому электролиз ведут в ванне с диафрагмой и в электролите с большой буферной емкостью. Последняя создается добавкой сульфата аммония, что на практике достигается применением хромо-аммонийных квасцов.
Катодный процесс при электролизе сульфата хрома состоит в одновременном протекании реакций:
Сr 2+ + 2е ⇄ Сr; φ° = — 0,91 в Сr 3+ + 3е ⇄ Сr; φ° = — 0,74 в Cr 3+ + е ⇄ Сr 2+ ; φ° = — 0,41 в
При поляризации в первую очередь протекает реакция, как обладающая наименее отрицательным потенциалом. В отличие от хромовокислых растворов в сульфатном электролите ионы Сr 2+ устойчивы, и их концентрация может достигать высоких значений. По мере накопления ионов Сr 2+ и сдвига потенциала катода в отрицательную сторону начинается протекание реакций осаждения и . Одновременно на катоде происходит выделение водорода, снижающее выход по току хрома и вызывающее повышение рН прикатодного слоя. Уже при рН около 3 происходит выпадение гидроокиси трехвалентного хрома, поэтому нормальный ход процесса требует рН католита порядка 2,1—2,4. При более низких значениях рН процесс выделения водорода становится доминирующим, и выход по току хрома резко падает. При наличии буферной добавки (NH 4)2SO4 кислотность католита удается стабилизировать в указанном выше интервале рН; выход по току хрома в этих условиях достигает 40—45%.
На аноде происходит в основном окисление молекул воды с выделением кислорода. Наряду с этим наблюдается анодное окисление хрома с образованием хромовой кислоты. Последний процесс приводит к почти полному окислению ионов Сr 3+ , перешедших из катодного пространства в анолит, и последний содержит преимущественно ионы шестивалентного хрома.
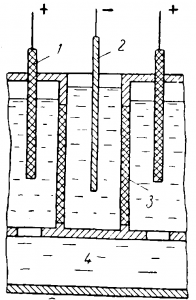
На рис. 2 приведена схема электролизера для электролиза хромо-аммонийных квасцов. Ванна футеруется свинцом или
Рис. 2. Схема устройства ванны для электролиза хромо-аммонийных квасцов:
1 — анод; 2 — катод; 3 — диафрагма; 4 — отстойник.
В качестве анодов применяется сплав свинца с се ребром (1% Ag); катоды изготовляют из алюминия или нержавеющей стали. Катодные и анодные ячейки в этой ванне разделены керамическими диафрагмами, причем анодные ячейки с нижней стороны сообщаются с коллектором анолита, из которого отработанный кислый раствор периодически сливают. Сверху анодные ячейки герметически закрыты и снабжены газоотводами, через которые удаляются анодные газы. Между анолитом и католитом поддерживается постоянная разница в уровнях для обеспечения протекания католита в анодную ячейку через диафрагму. Большое внимание должно быть уделено перемешиванию раствора, чтобы предотвратить расслаивание. Если электролит не перемешивать, то в нижней части его скапливается более кислый раствор. Это приводит к снижению выхода по току и получению неравномерного по толщине осадка.
Поступающий в катодные ячейки свежий электролит содержит до 130 г/л хрома (в виде Сr2(SO 4)3); содержание сульфата аммония в нем составляет около 120 г/л. Средний состав католита в ячейке отвечает содержанию порядка 10—15 г/л Сr 3+ и 10—15 г/л Сr 2+ ; концентрация сульфата аммония удерживается в нем на уровне 200—250 г/л.
В анолите содержание хрома около 15 г/л, при этом на долю трехвалентного хрома приходится всего около 2 г/л. Концентрация свободной серной кислоты в анолите достигает 280 г/л.
Электроэкстракция хрома ведется при катодной плотности тока порядка 800—1000 а/м 2 . Температура электролита —50—55° С. Катодный выход по току (на трехвалентный хром) составляет 40—50%; напряжение на ванне — 4—4,5 в. Удельный расход электроэнергии при этом составляет порядка 18000—20000 квт • ч/т.
Как и при электролизе хромовой кислоты, рентабельное получение металлического хрома из растворов хромо-аммонийных квасцов становится возможным только при наличии достаточно дешевого электролита.
Одним из перспективных способов получения квасцов является электролитический способ. В основе его лежит анодное растворение феррохрома, Растворение производят в ваннах с анодами, отлитыми из феррохрома, и с железными катодами. Электролитом служат обычно промывные воды от промывки железного шлама, получающегося при растворении анодов. Промывные воды содержат примерно 4—20 г/л хрома (в виде (NH4)2Cr 2O7).
Оптимальными условиями процесса можно считать следующие: рН электролита 5—6; анодная плотность тока 1000—1500 а/м 2 температура электролита 70—75° С; концентраций Сг 6+ в конечном электролите 60—70 г/л. В этих условиях выход по току Сr 6+ составляет 64—68%; напряжение 1 на ванне 6—7 в, удельный расход электроэнергии 30000—35000 квт • ч/т.
Полученный таким образом раствор бихромата аммония (NH4)2Cr 2О7 (хроматные щелоки) восстанавливают древесными опилками в присутствии серной кислоты для перевода в хромо-аммонийные квасцы. Раствор образовавшихся квасцов фильтруют и направляют на кристаллизацию. Кристаллы промывают, растворяют и раствор направляют на электроэкстракцию.
Статья на тему Получение хрома
Похожие страницы:
Понравилась статья поделись ей
Источник
Хром. Химия хрома и его соединений
Положение в периодической системе химических элементов
Хром расположен в 6 группе (или в побочной подгруппе VI группы в короткопериодной форме ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение атома хрома
Электронная конфигурация хрома в основном состоянии :
+24Cr 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1 1s 

3s 


Примечательно, что у атома хрома уже в основном энергетическом состоянии происходит провал (проскок) электрона с 4s-подуровня на 3d-подуровень.
Физические свойства
Хром – твердый металл голубовато-белого цвета. Очень чистый хром поддается механической обработке. В природе встречается в чистом виде и широко применяется в различных отраслях науки, техники и производства. Чаще всего хром применяется, как компонент сплавов, которые используются при изготовлении медицинского или химического технологического оборудования и приборов.
Изображение с портала top10a.ru
Температура плавления 1890 о С, температура кипения 2680 о С, плотность хрома 7,19 г/см 3 .
Нахождение в природе
Хром – довольно распространенный металл в земной коре (0,012 масс.%). Основной минерал, содержащий хром – хромистый железняк FeO·Cr2O3 (или Fe(CrO2)2).
Способы получения
Хром получают из хромита железа. Для восстановления используют кокс:
Fe(CrO2)2 + 4C → Fe + 2Cr + 4CO
Еще один способ получения хрома: восстановление из оксида алюминием (алюмотермия):
Качественные реакции
Качественная реакция на ионы хрома +2 – взаимодействие избытка солей хрома (II) с щелочами . При этом образуется коричневый аморфный осадок гидроксида хрома (II).
Например , хлорид хрома (II) взаимодействует с гидроксидом натрия:
CrCl2 + 2NaOH → Cr(OH)2 + 2NaCl
Качественная реакция на ионы хрома +3 – взаимодействие избытка солей хрома (III) с щелочами . При этом образуется серо-зеленый аморфный осадок гидроксида хрома (III).
Например , хлорид хрома (III) взаимодействует с гидроксидом калия:
CrCl3 + 3KOH → Cr(OH)3 + 3KCl
При дальнейшем добавлении щелочи амфотерный гидроксид хрома (III) растворяется с образованием комплексной соли:
Обратите внимание , если мы поместим соль хрома (III) в избыток раствора щелочи, то осадок гидроксида хрома (III) не образуется, т.к. в избытке щелочи соединения хрома (III) сразу переходят в комплекс:
Соли хрома можно обнаружить с помощью водного раствора аммиака. При взаимодействии растворимых солей хрома (II) с водным раствором аммиака также образуется коричневый осадок гидроксида хрома (II).
CrCl2 + 2NH3 + 2H2O → Cr(OH)2↓ + 2NH4Cl
Cr 2+ + 2NH3 + 2H2O → Cr(OH)2↓ + 2NH4 +
При взаимодействии растворимых солей хрома (III) с водным раствором аммиака также образуется серо-зеленый осадок гидроксида хрома (III).
CrCl3 + 3NH3 + 3H2O → Cr(OH)3↓ + 3NH4Cl
Cr 3+ + 3NH3 + 3H2O → Cr(OH)3 ↓ + 3NH4 +
Химические свойства
В соединениях хром может проявлять степени окисления от +1 до +6. Наиболее характерными являются соединения хрома со степенями окисления +3 и +6. Менее устойчивы соединения хрома со степенью окисления +2. Хром образует комплексные соединения с координационным числом 6.
1. При комнатной температуре хром химически малоактивен из-за образования на его поверхности тонкой прочной оксидной пленки. При нагревании оксидная пленка хрома разрушается, и он реагирует практически со всеми неметаллами: кислородом, галогенами, серой, азотом, кремнием, углеродом, фосфором.
1.1. При взаимодействии хрома с галогенами образуются галогениды:
2Cr + 3Cl2 → 2CrCl3
1.2. Хром реагирует с серой с образованием сульфида хрома:
1.3. Хром взаимодействует с фосфором . При этом образуется бинарное соединение – фосфид хрома:
Cr + P → CrP
1.4. С азотом хром реагирует при нагревании до 1000 о С с образованием нитрида:
2Cr + N2 → 2CrN
1.5. Хром не взаимодействует с водородом.
1.6. Хром взаимодействует с кислородом с образованием оксида:
2. Хром взаимодействует и со сложными веществами:
2.1. Хром реагирует с парами воды в раскаленном состоянии:
2.2. В ряду напряжений хром находится левее водорода и поэтому в отсутствии воздуха может вытеснить водород из растворов минеральных кислот (соляной и разбавленной серной кислоты), образуя соли хрома (II).
Например , хром бурно реагирует с соляной кислотой :
Cr + 2HCl → CrCl2 + H2↑
В присутствии кислорода образуются соли хрома (III):
4Cr + 12HCl + 3O2 → 4CrCl3 + 6H2O
2.3. При обычных условиях хром не реагирует с концентрированной серной кислотой из-за пассивации – образования плотной оксидной пленки. При нагревании реакция идет, образуются оксид серы (IV), сульфат хрома (III) и вода:
2.4. Хром не реагирует при обычных условиях с концентрированной азотной кислотой также из-за пассивации.
Только при сильном нагревании концентрированная азотная кислота растворяет хром:
2.5. Растворы щелочей на хром практически не действуют.
2.6. Однако хром способен вытеснять многие металлы , например медь, олово, серебро и др. из растворов их солей.
Например , хром реагирует с хлоридом меди с образованием хлорида хрома (III) и меди:
2Cr + 3CuCl2 → 2CrCl3 + 3Cu
Восстановительные свойства хрома также проявляются при взаимодействии его с сильными окислителями: пероксидом натрия, нитратами и нитритами, хлоратами в щелочной среде.
Например , при сплавлении хрома с хлоратом калия в щелочи хром окисляется до хромата калия:
Хлорат калия и нитрат калия также окисляют хром:
Оксид хрома (III)
Способы получения
Оксид хрома (III) можно получить различными методами :
1. Термическим разложением гидроксида хрома (III):
2. Разложением дихромата аммония:
3. Восстановлением дихромата калия углеродом (коксом) или серой:
Химические свойства
Оксид хрома (III) – типичный амфотерный оксид . При этом оксид химически довольно инертен. В высокодисперсном состоянии с трудом взаимодействует с кислотами и щелочами.
1. При сплавлении оксида хрома (III) с основными оксидами активных металлов образуются соли-хромиты.
Например , оксид хрома (III) взаимодействует с оксидом натрия:
2. Оксид хрома (III) взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—хромиты, а в растворе реакция практически не идет . При этом оксид хрома (III) проявляет кислотные свойства.
Например , оксид хрома (III) взаимодействует с гидроксидом натрия в расплаве с образованием хромита натрия и воды:
3. Оксид хрома (III) не взаимодействует с водой.
4. Оксид хрома (III) проявляет слабые восстановительные свойства . В щелочных расплавах окислителей окисляется до соединений хрома (VI).
Например , оксид хрома (III) взаимодействует с нитратом калия в щелочной среде:
Оксид хрома (III) окисляется бромом в присутствии гидроксида натрия:
Озоном или кислородом:
Нитраты и хлораты в расплаве щелочи также окисляют оксид хрома (III):
5. Оксид хрома (III) в высокодисперсном состоянии при сильном нагревании взаимодействует с сильными кислотами .
Например , оксид хрома (III) реагирует с серной кислотой:
6. Оксид хрома (III) проявляет слабые окислительные свойства при взаимодействии с более активными металлами.
Например , оксид хрома (III) реагирует с алюминием (термит):
Реакция очень экзотермическая, сопровождается выделением большого количества света:

Если сжечь большой объем термита в тигле, то можно получить металлический хром:

7. Оксид хрома (III) – твердый, нелетучий. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Например , из карбоната калия:
Оксид хрома (II)
Химические свойства
Оксид хрома (II) имеет основный характер, ему соответствует гидроксид хрома (II), обладающий основными свойствами.
1. При обычной температуре устойчив на воздухе, выше 100°С окисляется кислородом . Все соединения хрома (II) – сильные восстановители.
2. При высоких температурах оксид хрома (II) диспропорционирует :
3CrO → Cr + Cr2O3
3. Оксид хрома (II) не взаимодействует с водой.
4. Оксид хрома (II) проявляет основные свойства. Взаимодействует с сильными кислотами и кислотными оксидами .
Например , оксид хрома (II) взаимодействует с соляной кислотой:
CrO + 2HCl → CrCl2 + H2O
И с серной кислотой:
Оксид хрома (VI)
Оксид хрома (VI) CrO3 – темно-красное кристаллическое вещество. Гигроскопичен, расплывается на воздухе, малоустойчив, разлагается при нормальных условиях.
Способы получения
Оксид хром (VI) можно получить действием концентрированной серной кислоты на сухие хроматы или дихроматы:
Химические свойства
Оксид хрома (VI) – кислотный. Сильно ядовит. Оксиду хрома (VI) соответствуют хромовая (H2CrO4) и дихромовая (H2Cr2O7) кислоты.

1. При взаимодействии оксида хрома (VI) с водой образуется хромовые кислоты:
2. Оксид хрома (VI) проявляет кислотные свойства. Взаимодействует с основаниями и основными оксидами .
Например , оксид хрома (VI) взаимодействует с гидроксидом калия с образованием хромата калия:
Или с оксидом лития с образованием хромата лития:
3. Оксид хрома (VI) – очень сильный окислитель : окисляет углерод, серу, иод, фосфор, превращаясь при этом в оксид хрома (III).
Например , сера окисляется до оксида серы (IV):
Оксид хрома (VI) также окисляет сложные вещества, например , сульфиты:
И некоторые органические веществ, например , этанол:
Гидроксид хрома (III)
Гидроксид хрома (III) Cr(OH)3 – это твердое вещество серо-зеленого цвета.
Способы получения
1. Гидроксид хрома (III) можно получить действием раствора аммиака на соли хрома (III).
Например , хлорид хрома (III) реагирует с водным раствором аммиака с образованием гидроксида хрома (III) и хлорида аммония:
2. Пропусканием углекислого газа, сернистого газа или сероводорода через раствор гексагидроксохромата калия:
Чтобы понять, как протекает эта реакция, можно использовать несложный прием: мысленно разбить сложное вещество K3[Cr(OH)6] на составные части: KOH и Cr(OH)3. Далее мы определяем, как реагирует углекислый газ с каждым из этих веществ, и записываем продукты их взаимодействия. Т.к. Cr(OH)3 не реагирует с СО2, то мы записываем справа Cr(OH)3 без изменения. Гидроксид калия реагирует с избытком углекислого газа с образованием гидрокарбоната калия
3. Гидроксид хрома (III) можно получить действием недостатка щелочи на избыток соли хрома (III).
Например , хлорид хрома (III) реагирует с недостатком гидроксида калия с образованием гидроксида хрома (III) и хлорида калия:
4. Также гидроксид хрома (III) образуется при взаимодействии растворимых солей хрома (III) с растворимыми карбонатами, сульфитами и сульфидами . Сульфиды, карбонаты и сульфиты хрома (III) необратимо гидролизуются в водном растворе.
Например: бромид хрома (III) реагирует с карбонатом натрия. При этом выпадает осадок гидроксида хрома (III), выделяется углекислый газ и образуется бромид натрия:
Хлорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
Химические свойства
1. Гидроксид хрома (III) реагирует с растворимыми кислотами . При этом образуются средние соли.
Например , гидроксид хрома (III) взаимодействует с соляной кислотой с образованием хлорида хрома (III):
2. Гидроксид хрома (III) взаимодействует с кислотными оксидами сильных кислот .
Например , гидроксид хрома (III) взаимодействует с оксидом серы (VI) с образованием сульфата хрома (III):
3. Гидроксид хрома (III) взаимодействует с растворимыми основаниями (щелочами). При этом в растворе образуются комплексные соли . При этом гидроксид хрома (III) проявляет кислотные свойства.
Например , гидроксид хрома (III) взаимодействует с избытком гидроксидом натрия с образованием гексагидроксохромата:
4. Г идроксид хрома (III) разлагается при нагревании :
5. Под действием окислителей в щелочной среде переходит в хромат.
Например , при взаимодействии с бромом в щелочной среде гидроксид хрома (III) окисляется до хромата:
Гидроксид хрома (II)
Способы получения
1. Гидроксид хрома (II) можно получить действием раствора аммиака на соли хрома (II).
Например , хлорид хрома (II) реагирует с водным раствором аммиака с образованием гидроксида хрома (II) и хлорида аммония:
2. Гидроксид хрома (II) можно получить действием щелочи на соли хрома (II).
Например , хлорид хрома (II) реагирует с гидроксидом калия с образованием гидроксида хрома (II) и хлорида калия:
CrCl2 + 2KOH → Cr(OH)2↓ + 2KCl
Химические свойства
1. Гидроксид хрома (II) проявляет основные свойства . В частности, реагирует с растворимыми кислотами .
Например , гидроксид хрома (II) взаимодействует с соляной кислотой с образованием хлорида хрома (II). Соли хрома (II) окрашивают раствор в синий цвет.
2. Гидроксид хрома (II) взаимодействует с кислотными оксидами сильных кислот .
Например , гидроксид хрома (II) взаимодействует с оксидом серы (VI) с образованием сульфата хрома (II):
3. Гидроксид хрома (II) – сильный восстановитель.
Например , под действием кислорода воздуха гидроксид хрома (II) окисляется до гидроксида хрома (III):
Соли хрома
Соли хрома (II)
Все соли хрома (II) – сильные восстановители. В растворах окисляются даже кислородом воздуха.
Например , хлорид хрома (II) окисляется кислородом в растворе в присутствии щелочи до соединений хрома (III):
Концентрированные кислоты-окислители (азотная и серная) также окисляют соединения хрома (II):
Соли хрома (III)
Хром с валентностью III образует два типа солей:
- Соли, в которых хром (III) является катионом. Например , хлорид хрома (III) CrCl3.
- Соли, в которых хром (III) входит в состав кислотного остатка – хромиты и гидроксокомплексы хрома (III) . Например , хромит калия, KCrO2. или гексагидроксохромат (III) калия K3[Cr(OH)6].
1. Соли хрома (III) проявляют слабые восстановительные свойства . окисляются под действием сильных окислителей в щелочной среде.
Например , бром в присутствии гидроксида калия окисляет хлорид хрома (III):
2CrCl3 + 3Br2 + 16KOH → 2K2CrO4 + 6KBr + 6KCl + 8H2O
или сульфат хрома (III):
Пероксид водорода в присутствии щелочи также окисляет соли хрома (III):
Даже перманганат калия в щелочной среде окисляет соли хрома (III):
Комплексные соли хрома (III) также окисляются сильными окислителями в присутствии щелочей.
Например , гексагидроксохроматы окисляются бромом в щелочи:
Оксид свинца (IV) также окисляет хромиты:
2. Соли хрома (III) в щелочной среде образуют гидроксид хрома (III), который сразу растворяется, образуя гидроксокомплекс.
2CrCl3 + 6KOH → 2Cr(OH)3 + 6KCl
3. Более активные металлы вытесняют хром (III) из солей.
Например , цинк реагирует с хлоридом хрома (III):
Гидролиз солей хрома (III)
Растворимые соли хрома (III) и сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: Cr 3+ + H2O = CrOH 2+ + H +
II ступень: CrOH 2+ + H2O = Cr(OH )2 + + H +
Однако сульфиды, сульфиты, карбонаты хрома (III) и их кислые соли гидролизуются необратимо, полностью, т.е. в водном растворе не существуют, а разлагаются водой в момент образования.
Например , при сливании растворов солей хрома (III) и сульфита, гидросульфита, карбоната или сульфида натрия протекает взаимный гидролиз:
Более подробно про гидролиз можно прочитать в соответствующей статье.
Хромиты
Соли, в которых хром (III) входит в состав кислотного остатка (хромиты) — образуются из оксида хрома (III) при сплавлении с щелочами и основными оксидами:
Для понимания свойств хромитов их удобно мысленно разделить на два отдельных вещества.
Например , хромит натрия мы поделим мысленно на два вещества: оксид хрома (III) и оксид натрия.
NaСrO2 разделяем на Na2O и Cr2O3
При этом очевидно, что хромиты реагируют с кислотами. При недостатке кислоты образуется гидроксид хрома (III):
NaCrO2 + HCl (недостаток) + H2O → Cr(OH)3 + NaCl
В избытке кислоты гидроксид хрома (III) не образуется:
NaCrO2 + 4HCl (избыток) → CrCl3 + NaCl + 2H2O
NaCrO2 + 4HCl → CrCl3 + NaCl + 2H2O
Под действием избытка воды хромиты гидролизуются:
Соли хрома (VI)
Оксиду хрома ( VI ) соответствуют две кислоты – хромовая Н2 CrO 4 и дихромовая Н2 Cr 2 O 7. Поэтому хром в степени окисления +6 образует два типа солей: хроматы и дихроматы.
Например , хромат калия K2CrO4 и дихромат калия K2Cr2O7.
1. Различить эти соли довольно легко: хроматы желтые, а дихроматы оранжевые. Хроматы устойчивы в щелочной среде, а дихроматы устойчивы в кислой среде.
При добавлении к хроматам кислот они переходят в дихроматы.
Например , хромат калия взаимодействует с серной кислотой и разбавленной соляной кислотой с образованием дихромата калия:
И наоборот: дихроматы реагируют с щелочами с образованием хроматов.
Например , дихромат калия взаимодействует с гидроксидом калия с образованием хромата калия:
Видеоопыт взаимных переходов хроматов и дихроматов при добавлении кислоты или щелочи можно посмотреть здесь.
2. Хроматы и дихроматы проявляют сильные окислительные свойства. При взаимодействии с восстановителями они восстанавливаются до соединений хрома (III).
В нейтральной среде хроматы и дихроматы восстанавливаются до гидроксида хрома (III).
Например , дихромат калия реагирует с сульфитом натрия в нейтральной среде:
Хромат калия окисляет сульфид аммония:
При взаимодействии с восстановителями в щелочной среде хроматы и дихроматы образуют комплексные соли.
Например , хромат калия окисляет гидросульфид аммония в щелочной среде:
Хромат натрия окисляет сернистый газ:
Хромат натрия окисляет сульфид натрия:
При взаимодействии с восстановителями в кислой среде хроматы и дихроматы образуют соли хрома (III).
Например , дихромат калия окисляет сероводород в присутствии серной кислоты:
Дихромат калия окисляет йодид калия, фосфид кальция, соединения железа (II), сернистый газ, концентрированную соляную кислоту:
Источник








