- Хром: свойства, способы добычи и применение
- Структура и состав металла
- Виды хромовых руд
- Эндогенные
- Экзогенные
- Техногенные
- Способы добычи хрома
- Алюмотермический метод
- Металлотермическая плавка
- Лабораторный метод
- Хранение и транспортировка
- Область применения хрома
- Производство стали
- Хромирование
- Сохранение древесины и обработка кожи
- Изготовление красок
- Ювелирная промышленность
- Месторождения в России и мире
- Мировые запасы
- Страны, добывающие хром
- Получение хрома
- Получение хрома на производстве
- Электроосаждение хрома из хромовой кислоты
- Оксид хрома получение
- Электроосаждение хрома хромо-аммонийных квасцов
- Похожие страницы:
Хром: свойства, способы добычи и применение
Хром – достаточно распространённый в природе тяжёлый металл, голубовато-белого цвета. Благодаря тому, что химические соединения этого элемента имеют разные цвета, он и получил своё название, переводимое на русский язык с греческого как «краска».
Заслуга открытия этого природного минерала, выделенного в чистом виде Ф. Тассертом на рубеже XVIII-XIX веков, принадлежит французскому профессору химии Никола Луи Воклену и немецким учёным М. Г. Клапротом и Т. Е. Ловицем.
- Один из самых твёрдых и пластичных материалов (при проведении по стеклу, оставляет след).
- Металл становится очень хрупким (легко ломается при незначительных физических воздействиях) при наличии примесей в виде: азота, кислорода и углерода.
- Хорошо поддаётся механической обработке.
- Электро- и теплопроводен.
- Обладает металлическим блеском.
- При температуре +37…+39 0 C начинает менять ряд физических характеристик: снижается упругость, изменяется электропроводность и коэффициент линейного расширения.
- Плотность металла =» 7,19 гм/см 3 .
- Температура плавления составляет +1875 0 C.
- Температура кипения равняется +2680 0 C.
- В нормальных условиях малоактивен, что позволяет использовать его в качестве антикоррозийной добавки при выплавке железа.
- При контакте с водой и кислородом воздуха не окисляется и не теряет своего блеска.
- Не вступает в реакцию с азотной и серной кислотами.
- Проявляет химическую активность при повышенных температурах, вступая в реакции с бромом, хлором и кислородом.
- В определённых условиях образует множество химических соединений, обладающих окислительными и восстановительными свойствами, и при этом являющихся ядами!
Структура и состав металла
Как металл, хром имеет кристаллическую структуру в виде объёмно-центрированной кубической решётки, подверженной гранецентрированной модификации при температуре в +1830 0 C. Сама решётка состоит из ионов минерала и подвижных электронов. Имеется провал одного электрона с подуровня на другой подуровень.
Виды хромовых руд
В достаточной степени распространённый в земной коре металл, хром представлен среди полезных ископаемых двумя своими основными соединениями:
- Хромитом – называемым также железняком или шпинелем.
- Крокоитом – красной свинцовой рудой класса хроматов.
Всего в природе насчитывается более 20 хромовых минералов, но промышленное значение имеют только шпинели: магнохромит, люмохромит, хромпикотит. Как те, так и другие минералы обладают определённой спецификой природного или производственно-хозяйственного происхождения. Второе справедливо в случае использования технологических отходов.
Эндогенные
Эндогенные хромовые руды представляют собой залежи ископаемых, образовавшихся в результате извержения магмы или жидких, а также газовых растворов, содержащих в себе минералы, располагающиеся в глубинах земных недр. Процесс их внутри земного формирования в своё время происходил под воздействием высоких температур и значительного давления.
В свою очередь, по времени образования эндогенные руды подразделяются:
- на раннемагматические (в их нижних горизонтах и залегают хромовые руды)
- и позднемагматические (те, в которых образуются линзы, столбы и жилы искомого минерала).
Кроме того, в зависимости от физико-химических процессов и содержания, насчитывается пять основных генетических групп руд:
- магматические,
- пегматитовые,
- карбонатитовые,
- скарновые,
- гидротермальные.
Промышленное значение имеют альпинотипный и стратиформный типы месторождений. Оба они отличаются высоким содержанием хрома, железа и глинозёма.
Экзогенные
Разрушение эндогенных руд посредством процессов выветривания привело к возникновению экзогенных (россыпных) залежей, подразделяющихся на прибрежно-морские, элювиальные, делювиальные отложения.
Техногенные
Фактически представляют собой остатки технологических процессов освоения и переработки хромовых промышленных руд: специальные отвалы и хвосты. Их освоение требует соответствующих специфике исследований, а также научно-исследовательских и конструкторских разработок.
Способы добычи хрома
Основными технологиями добычи хрома, как и ряда других полезных ископаемых, выступают открытый, подземный и комбинированный способы.
Самым распространённым и популярным является открытый, карьерный способ. Это объясняется доступностью залежей и возможностью быстрой организации широкого фронта работ с привлечением максимума тяжёлой техники.
Однако такое бывает далеко не всегда. В случае глубинных залежей хромовых руд приходится строить шахты, прокладывать горизонтальные квершлаги, штольни, штреки. Способ достаточно затратный, но эффективный в плане добычи самых богатых залежей полезных ископаемых.
Если рудное тело располагается на разных глубинах, то уместным становится совмещение открытого и закрытого способа, то есть комбинированного, позволяющего в наибольшей степени освоить месторождение.
Так как добытое перечисленными способами сырьё насыщено примесями, а для потребителей нужен чистый хром, то для его получения прибегают к разнообразным физико-химическим способам переработки извлечённых руд.
Алюмотермический метод
Частный случай металлотермии, изобретённый в 1859 году российским академиком Н. Н. Бекетовым и внедрённый в промышленную эксплуатацию на рубеже XIX-XX веков Г. Гольдшмидтом, представляет собой не что иное, как метод восстановления оксида хрома с помощью алюминия сопровождающийся значительным выделением тепла. Температура подобного процесса может достигать 3000 0 C.
Для осуществления процесса используется облицованная магнезитовым кирпичом специальная шахта, смонтированная на вагонетке. Внутри полости размещается шихта и запальная смесь. Для усиления реакции добавляются хромовокислые соли и флюсы. В результате чего исходное сырьё преобразуется в сплав, содержащий в своём составе до 92% хрома и предназначенный для слива шлак.
Металлотермическая плавка
Суть металлотермии заключается в восстановлении металлов (в нашем случае – хрома) из их соединений под воздействием высокой температуры с помощью других, более активных в химическом отношении металлов. Сами процессы металлотермии могут протекать в вакууме, электрических печах и вне печей, если позволяет температура реакции.
Дифференцированное сырьё, включает в себя:
- Рудную часть =» концентрат + известь.
- Восстановительные материалы =» концентрат + алюминиевый порошок.
- Запальную смесь =» концентрат + алюминиевый порошок + натриевая селитра.
Всю эту массу загружают в электропечной агрегат. В течение 1-1,5 часа смесь плавят и восстанавливают, чтобы затем слить в изложницу, отделив, содержащий 80% хрома сплав от шлака.
Лабораторный метод
Фактически – электролиз, осуществляемый в лабораторных условиях. Для чего используется специальная ёмкость – электролизёр, заполненный серной кислотой, куда добавляется хромой ангидрид. При пропускании электрического тока, на катоде оседает чистый хром с попутным выделением водорода. Метод не имеет большого практического применения, вследствие малой востребованности получаемого состава.
Хранение и транспортировка
Изготовленный в виде кусков металлический хром, относящийся к третьему классу опасности, следует хранить в специализированных контейнерах или стальных барабанах. При необходимости длительного хранения, барабаны должны быть окрашены в серый цвет.
Транспортировка упакованного материала может осуществляться всеми видами транспорта с соблюдением действующих норм и правил перевозки грузов.
Область применения хрома
Производство стали
Благодаря своим свойствам, хром находит широкое применение в сталелитейном производстве. Этот легирующий элемент позволяет защитить железо от коррозии, повысить его твёрдость и уменьшить критическую скорость охлаждения во время закалки.
Хромистые стали используются для изготовления оружия, броневых плит, несгораемых шкафов, а также корпусов кораблей и подводных лодок.
Хромирование
Электролитическим способом на поверхность готового изделия или детали наносится тончайшая плёнка, толщиной порядка 0,005 мм, что позволяет сформировать хромированную поверхность. Такой защитный слой – хромовое покрытие или хромирование не только делает изделие изящным и красивым, но и защищает его от влаги и воздуха в течение длительного времени.
Сохранение древесины и обработка кожи
Не только металлы нуждаются в защите, но и древесина. Обработанная хромовыми солями, она становится не доступной для разрушения микроорганизмами, насекомыми и плюс к тому имеет меньшую вероятность механического повреждения.
В процессе производства обуви или галантереи кожевенные изделия проходят стабилизацию под воздействием хромовых квасцов.
Изготовление красок
Благодаря богатейшей палитре цветов ряда химических соединений, хрома входит в состав разнообразных красителей и пигментирующих веществ. Оксиды хрома и некоторых металлов служат художественными красками, также они применятся при протравливании тканей перед крашением.
Характерный для некоторых декоративных стеклянных изделий зелёный или жёлтый цвет имеет в своей основе этот же минерал.
Ювелирная промышленность
Драгоценные камни, столь незаменимые в готовых ювелирных изделиях часто содержат в своём составе хром. Это – прежде всего рубин, который к тому же используется в лазерных установках, а также шпинель и уваровит.
Безусловно, все перечисленные отрасли не исчерпывают области применения этого минерала. Он находит достаточно широкое употребление при изготовлении:
- Фотографий (желатин).
- Полиграфической продукции.
- Электронной аппаратуры.
- Пластмасс.
- Фармацевтических веществ.
- Огнеупоров.
- Металлокерамики.
- Электродов.
Месторождения в России и мире
Хром – достаточно распространённый в природе металл (0,03% массы земной коры), поэтому его залежи встречаются в Европе, Азии и Африке. Однако наиболее крупные месторождения располагаются в ЮАР, Казахстане, Российской Федерации, Мадагаскаре и Зимбабве. Менее богаты залежами Армения, Турция, Индия, Бразилия, Филиппины.
На территории нашей страны существуют несколько достаточно крупных месторождений с запасами от 1 до 10 млн. тонн руды:
- Сопчеозёрское в Мурманской области.
- Аганозерское в Карелии.
- Цетральное в Ямало-Ненецком Автономном Округе.
- Главное Сарановское и Южно-Сарановское в Пермском крае, Свердловской и Челябинской областях.
Также запасами руд этого минерала располагают Башкортостан, Оренбургская и Читинская области, Ханты-Мансийский АО, Красноярский и Алтайские края, остров Сахалин.
Мировые запасы
15 млрд. тонн – таковы выявленные мировые запасы хромовых руд на территории 47 стран мира. В процентном отношении ресурсы распределены таким образом:
- Север ЮАР – 78%.
- Актюбинская область Казахстана – 7%.
- Зимбабве – 6%.
- США – 1,5%.
- Гренландия – 1,1%.
- Финляндия – 1%.
- Индия – 0,9%.
К началу III тысячелетия подтверждённые запасы 300 месторождений в 32 странах мира составляли 4,5 млрд. тонн.
Страны, добывающие хром
Общемировое ежегодное потребление хрома оценивается в 15 млн. тонн. Значительную долю в эту цифру вносят страны, добывающие руды:
- закрытым способом: ЮАР, Зимбабве, Турция, Греция;
- открытым методом – Бразилия, Финляндия, Мадагаскар, Индия.
- комбинированным способом – Филиппины.
Кроме того, в этот список входят такие страны. Казахстан, Китай, Россия. В целом можно отметить, что ситуация на мировом рынке хрома в последнее десятилетие несколько стабилизировалась. А подтверждённых запасов этого природного полезного ископаемого хватит на ближайшие несколько десятков лет.
Источник
Получение хрома
Получение хрома на производстве

В лабораторных условиях хром получают восстановление его оксидов алюминием или кремнием.
Хром широко применяется в технике для выплавки жаропрочных и нержавеющих сталей. Другими областями применения хрома являются получение антикоррозионных покрытий на поверхности металлических изделий (хромирование), производство красок, химическая промышленность.
В природе хром встречается преимущественно в виде минерала хромита FeO • Сr2O3. Содержание Сr2O3 в хромитовых рудах обычно составляет 40— 55%.
Металлический хром, применяемый для производства специальных сплавов, получался до недавнего времени исключительно путем алюмо- и силикотермического восстановления окиси хрома Сr2O3, получаемой из хромита. Такой металл содержит ряд примесей, за трудняющих его использование. Это привело к разработке способов электроэкстракции хрома из растворов, позволяющих получить электролитный металл высокой чистоты.
Для получения хрома электролизом применяются два типа электролитов: на основе хромовой кислоты и на основе хромо-аммонийных квасцов.
Электроосаждение хрома из хромовой кислоты
Электроосаждение хрома из хромовокислого раствора широко применяется для получения хромовых покрытий. Теория этого процесса подробно изложена в разделе гальванотехники.
Осаждение хрома из хромовокислого раствора в качестве металлургического процесса имеет некоторые особенности. В этом случае стремятся получить мягкие толстые осадки хрома высокой чистоты с возможно низким удельным расходом электроэнергии.
Электроэкстракция из раствора хромовой кислоты проводится в прямоугольных ваннах, футерованных рольным свинцом или фторопластом. Анодами служат свинцовые пластины, катодные основы изготовляются из нержавеющей стали или алюминия. Ввиду обильного газовыделения над ванной образуется туман электролита, чрезвычайно вредный для обслуживающего персонала. Для удаления тумана используется интенсивный бортовой отсос выделяющихся газов. В ряде случаев в ваннах организуется охлаждение раствора с помощью погруженных водоохлаждаемых теплообменников.
Используемые на практике электролиты содержат 250—350 г/л СrО3 и 2,5—5 г/л H2SO4; обычно отношение СrO3: H2SO4 в растворе равно 100:1. При получении хрома температура в ванне поддерживается 25—35° С. Плотность тока колеблется в пределах 2800—8000 а/м 2 . В этих условиях катодный выход по току (в расчете на шестивалентный хром) составляет от 20 до 35%, напряжение на ванне равно 5—8 е. Удельный расход электроэнергии при этом составляет порядка 40000—70000 квт • ч/т. Расход хромового ангидрида равен примерно 2—2,5 т на 1 т металлического хрома.
Оксид хрома получение
Хромовый ангидрид для получения хрома электролизом хромовой кислоты производят химическим путем. Ввиду высоких требований к чистоте СrО3 этот способ получения дорог, и электролитный хром имеет высокую стоимость.
В последнее время разработан процесс получения СrO3 путем анодного растворения феррохрома. Этот процесс имеет несомненные преимущества, так как в качестве исходного сырья для получения хромового ангидрида используется относительно дешевый и получаемый в больших количествах металлургической промышленностью феррохром. Электролиз проводят в концентрированных растворах серной кислоты. Аноды отливают из феррохрома, катоды изготовляют из нерастворимого в серной кислоте металла, обычно из свинца.
Главным анодным процессом получения хрома является процесс его растворения и железа. Хром в раствор может переходить в виде ионов Сr 6+ и Сr 3+ . Шестивалентный хром образует в сернокислом электролите раствор хромового ангидрида, трехвалентный — сульфат хрома Cr2(SO4)3. Железо переходит в раствор в виде Fe2 (SO4)3. На катоде наряду с основным катодным процессом выделения водорода может идти восстановление Сr 6+ до Сr 3+ .
Процесс следует вести таким образом, чтобы предотвратить возможность образования ионов Сr 3+ . Соотношение в растворе ионов Сr 6+ и Сr 3+ зависит от концентрации серной кислоты и плотности тока. С повышением содержания серной кислоты и увеличением плотности тока образование ионов Сr 3+ уменьшается, однако одновременно понижается и выход по току за счет пассивации анода. Вследствие малой растворимости СrO3 в концентрированных растворах H2SO4 большая часть хромового ангидрида выпадает в осадок вместе с Fe2(SO 4)3, что затрудняет их разделение.
Наибольшая разница в растворимости СrО3 и Fe2 (SO4)3 наблюдается в 50%-ной серной кислоте. Пассивация анода в таком растворе крайне незначительна, и возможно получение высоких выходов по току. Однако в этом относительно слабом по концентрации H2SO4 электролите при электролизе в обычной бездиафрагменной ванне идет образование почти исключительно ионов Сr 3+ , главным образом за счет восстановления ионов Сr 6+ на катоде. Чтобы предотвратить это восстановление и получить весь хром в виде хромового ангидрида, анод заключают в керамическую диафрагму, препятствующую проникновению ионов Сг 6+ в прикатодное пространство.
Плотность тока при проведении анодного растворения феррохрома на указанном режиме должна быть не менее 500—1000 а/м 2 . В противном случае, несмотря на применение диафрагмы, возможно образование в растворе ионов Сr 3+ . Кроме того, понижение плотности тока снижает выход по току. При плотности тока 500—1000 а/м 2 выход по току шестивалентного хрома составляет 65—80%.
Электроосаждение хрома хромо-аммонийных квасцов
Суммарной реакцией процесса электроэкстракции хрома из раствора хромо-аммонийных квасцов является реакция разложения сульфата трехвалентного хрома
что аналогично электроэкстракции цинка, марганца и других рассмотренных выше металлов. Электроосаждение хрома, имеющего ярко выраженный отрицательный потенциал и характеризующегося относительно небольшим перенапряжением для водорода, в условиях образования на аноде свободной кислоты возможно только при изоляции анодного пространства от катодного и строгом регулировании рН католита. Поэтому электролиз ведут в ванне с диафрагмой и в электролите с большой буферной емкостью. Последняя создается добавкой сульфата аммония, что на практике достигается применением хромо-аммонийных квасцов.
Катодный процесс при электролизе сульфата хрома состоит в одновременном протекании реакций:
Сr 2+ + 2е ⇄ Сr; φ° = — 0,91 в Сr 3+ + 3е ⇄ Сr; φ° = — 0,74 в Cr 3+ + е ⇄ Сr 2+ ; φ° = — 0,41 в
При поляризации в первую очередь протекает реакция, как обладающая наименее отрицательным потенциалом. В отличие от хромовокислых растворов в сульфатном электролите ионы Сr 2+ устойчивы, и их концентрация может достигать высоких значений. По мере накопления ионов Сr 2+ и сдвига потенциала катода в отрицательную сторону начинается протекание реакций осаждения и . Одновременно на катоде происходит выделение водорода, снижающее выход по току хрома и вызывающее повышение рН прикатодного слоя. Уже при рН около 3 происходит выпадение гидроокиси трехвалентного хрома, поэтому нормальный ход процесса требует рН католита порядка 2,1—2,4. При более низких значениях рН процесс выделения водорода становится доминирующим, и выход по току хрома резко падает. При наличии буферной добавки (NH 4)2SO4 кислотность католита удается стабилизировать в указанном выше интервале рН; выход по току хрома в этих условиях достигает 40—45%.
На аноде происходит в основном окисление молекул воды с выделением кислорода. Наряду с этим наблюдается анодное окисление хрома с образованием хромовой кислоты. Последний процесс приводит к почти полному окислению ионов Сr 3+ , перешедших из катодного пространства в анолит, и последний содержит преимущественно ионы шестивалентного хрома.
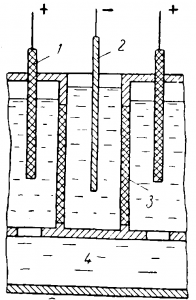
На рис. 2 приведена схема электролизера для электролиза хромо-аммонийных квасцов. Ванна футеруется свинцом или
Рис. 2. Схема устройства ванны для электролиза хромо-аммонийных квасцов:
1 — анод; 2 — катод; 3 — диафрагма; 4 — отстойник.
В качестве анодов применяется сплав свинца с се ребром (1% Ag); катоды изготовляют из алюминия или нержавеющей стали. Катодные и анодные ячейки в этой ванне разделены керамическими диафрагмами, причем анодные ячейки с нижней стороны сообщаются с коллектором анолита, из которого отработанный кислый раствор периодически сливают. Сверху анодные ячейки герметически закрыты и снабжены газоотводами, через которые удаляются анодные газы. Между анолитом и католитом поддерживается постоянная разница в уровнях для обеспечения протекания католита в анодную ячейку через диафрагму. Большое внимание должно быть уделено перемешиванию раствора, чтобы предотвратить расслаивание. Если электролит не перемешивать, то в нижней части его скапливается более кислый раствор. Это приводит к снижению выхода по току и получению неравномерного по толщине осадка.
Поступающий в катодные ячейки свежий электролит содержит до 130 г/л хрома (в виде Сr2(SO 4)3); содержание сульфата аммония в нем составляет около 120 г/л. Средний состав католита в ячейке отвечает содержанию порядка 10—15 г/л Сr 3+ и 10—15 г/л Сr 2+ ; концентрация сульфата аммония удерживается в нем на уровне 200—250 г/л.
В анолите содержание хрома около 15 г/л, при этом на долю трехвалентного хрома приходится всего около 2 г/л. Концентрация свободной серной кислоты в анолите достигает 280 г/л.
Электроэкстракция хрома ведется при катодной плотности тока порядка 800—1000 а/м 2 . Температура электролита —50—55° С. Катодный выход по току (на трехвалентный хром) составляет 40—50%; напряжение на ванне — 4—4,5 в. Удельный расход электроэнергии при этом составляет порядка 18000—20000 квт • ч/т.
Как и при электролизе хромовой кислоты, рентабельное получение металлического хрома из растворов хромо-аммонийных квасцов становится возможным только при наличии достаточно дешевого электролита.
Одним из перспективных способов получения квасцов является электролитический способ. В основе его лежит анодное растворение феррохрома, Растворение производят в ваннах с анодами, отлитыми из феррохрома, и с железными катодами. Электролитом служат обычно промывные воды от промывки железного шлама, получающегося при растворении анодов. Промывные воды содержат примерно 4—20 г/л хрома (в виде (NH4)2Cr 2O7).
Оптимальными условиями процесса можно считать следующие: рН электролита 5—6; анодная плотность тока 1000—1500 а/м 2 температура электролита 70—75° С; концентраций Сг 6+ в конечном электролите 60—70 г/л. В этих условиях выход по току Сr 6+ составляет 64—68%; напряжение 1 на ванне 6—7 в, удельный расход электроэнергии 30000—35000 квт • ч/т.
Полученный таким образом раствор бихромата аммония (NH4)2Cr 2О7 (хроматные щелоки) восстанавливают древесными опилками в присутствии серной кислоты для перевода в хромо-аммонийные квасцы. Раствор образовавшихся квасцов фильтруют и направляют на кристаллизацию. Кристаллы промывают, растворяют и раствор направляют на электроэкстракцию.
Статья на тему Получение хрома
Похожие страницы:
Понравилась статья поделись ей
Источник








